治療スケジュール
概要
監修医師
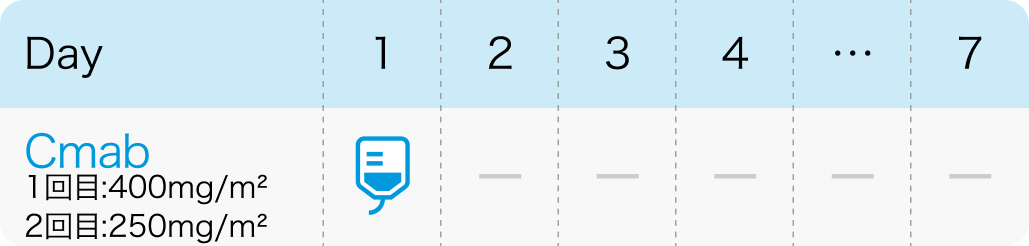
Cmab (1週間間隔):Cetuximab(アービタックス®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 400mg/m² 点滴 | 1~ | Day1 |
| 250mg/m² 点滴 | 2~ | Day1 |
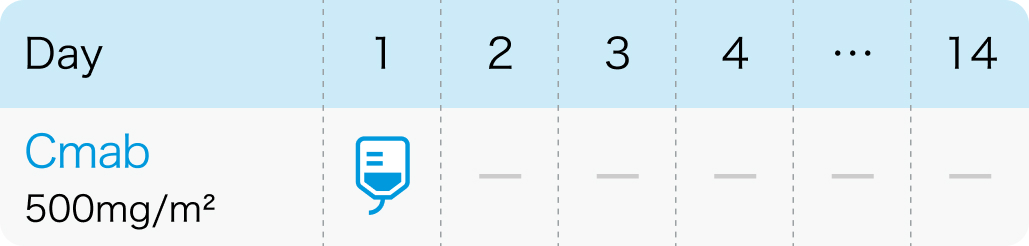
Cmab (2週間間隔):Cetuximab(アービタックス®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 500mg/m² 点滴 | 1~ | Day1 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
アービタックス® (添付文書¹⁾ / 適正使用情報²⁾* )
*メルクバイオファーマ株式会社の外部サイトへ遷移します
用法用量
電子添文¹⁾の用法および用量
1週間間隔
2週間間隔
アービタックス®電子添文 (2023年12月改訂 第4版)¹⁾より作図
前投薬
infusion reactionを軽減させるため、 投与前に抗ヒスタミン剤の前投薬を行うこと。
さらに、 投与前に副腎皮質ホルモン剤を投与すると、 infusion reactionが軽減されることがある。
アービタックス®電子添文 (2023年12月改訂 第4版)¹⁾より引用
主な有害事象
ASPECCT試験³⁾
主な有害事象 (カッコ内はGrade3~4)
- 発疹 51.1% (3.6%)
- 尋常性ざ瘡様皮膚炎 27.0% (2.8%)
- 低Mg血症 17.7% (2.6%)
- 下痢 17.7% (1.8%)
- 乾燥肌 15.7% (0%)
- かゆみ 17.5% (0.2%)
- 倦怠感 17.5% (3.6%)
- 食欲減退 15.5% (1.4%)
- 悪心 11.3% (1.4%)
- 腹痛 16.5% (2.8%)
- 嘔吐 10.1% (1.4%)
- 爪囲炎 14.9% (2.0%)
- にきび 13.7% (1.0%)
- 皮膚裂傷 8.5% (0.6%)
- 便秘 14.3% (0.6%)
- 低K血症 4.6% (1.6%)
- 咳 7.6% (0%)
- 腰痛 7.8% (0.6%)
- 無力症 9.5% (1.6%)
- 貧血 6.4% (3.0%)
- 発熱 11.1% (0.8%)
- 不眠症 9.1% (0%)
- 低Ca血症 3.2% (1.2%)
- 爪障害 6.2% (0.4%)
- 口内炎 6.8% (0%)
- 体重減少 4.2% (0%)
- 末梢性浮腫 8.0% (1.0%)
- 呼吸困難 7.6% (1.4%)
- 粘膜炎 5.0% (0.6%)
- 消化不良 5.2% (0.2%)
- 頭痛 7.2% (0%)
- 上気道感染 5.6% (0%)
- 皮膚および皮下組織の毒性 87.5% (9.5%)
- 注入反応 14.3% (1.8%)
Lancet Oncol. 2014 May;15(6):569-79³⁾より引用
出典
- メルクバイオファーマ株式会社. アービタックス®電子添文 (2023年12月改訂 第4版) [最終閲覧 : 2024/7/12]
- メルクバイオファーマ株式会社. アービタックス®適正使用ガイド (2023年12月作成) [最終閲覧 : 2024/7/12]
- Panitumumab versus cetuximab in patients with chemotherapy-refractory wild-type KRAS exon 2 metastatic colorectal cancer (ASPECCT): a randomised, multicentre, open-label, non-inferiority phase 3 study. Lancet Oncol. 2014 May;15(6):569-79. PMID: 24739896
最終更新日 : 2024年8月8日
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
Cmab
セツキシマブ (アービタックス®)
2024年09月27日更新
Cmab (1週間間隔):Cetuximab(アービタックス®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 400mg/m² 点滴 | 1~ | Day1 |
| 250mg/m² 点滴 | 2~ | Day1 |
Cmab (2週間間隔):Cetuximab(アービタックス®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 500mg/m² 点滴 | 1~ | Day1 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
アービタックス® (添付文書¹⁾ / 適正使用情報²⁾* )
*メルクバイオファーマ株式会社の外部サイトへ遷移します
用法用量
電子添文¹⁾の用法および用量
1週間間隔

2週間間隔

アービタックス®電子添文 (2023年12月改訂 第4版)¹⁾より作図
前投薬
infusion reactionを軽減させるため、 投与前に抗ヒスタミン剤の前投薬を行うこと。
さらに、 投与前に副腎皮質ホルモン剤を投与すると、 infusion reactionが軽減されることがある。
アービタックス®電子添文 (2023年12月改訂 第4版)¹⁾より引用
主な有害事象
ASPECCT試験³⁾
主な有害事象 (カッコ内はGrade3~4)
- 発疹 51.1% (3.6%)
- 尋常性ざ瘡様皮膚炎 27.0% (2.8%)
- 低Mg血症 17.7% (2.6%)
- 下痢 17.7% (1.8%)
- 乾燥肌 15.7% (0%)
- かゆみ 17.5% (0.2%)
- 倦怠感 17.5% (3.6%)
- 食欲減退 15.5% (1.4%)
- 悪心 11.3% (1.4%)
- 腹痛 16.5% (2.8%)
- 嘔吐 10.1% (1.4%)
- 爪囲炎 14.9% (2.0%)
- にきび 13.7% (1.0%)
- 皮膚裂傷 8.5% (0.6%)
- 便秘 14.3% (0.6%)
- 低K血症 4.6% (1.6%)
- 咳 7.6% (0%)
- 腰痛 7.8% (0.6%)
- 無力症 9.5% (1.6%)
- 貧血 6.4% (3.0%)
- 発熱 11.1% (0.8%)
- 不眠症 9.1% (0%)
- 低Ca血症 3.2% (1.2%)
- 爪障害 6.2% (0.4%)
- 口内炎 6.8% (0%)
- 体重減少 4.2% (0%)
- 末梢性浮腫 8.0% (1.0%)
- 呼吸困難 7.6% (1.4%)
- 粘膜炎 5.0% (0.6%)
- 消化不良 5.2% (0.2%)
- 頭痛 7.2% (0%)
- 上気道感染 5.6% (0%)
- 皮膚および皮下組織の毒性 87.5% (9.5%)
- 注入反応 14.3% (1.8%)
Lancet Oncol. 2014 May;15(6):569-79³⁾より引用
出典
- メルクバイオファーマ株式会社. アービタックス®電子添文 (2023年12月改訂 第4版) [最終閲覧 : 2024/7/12]
- メルクバイオファーマ株式会社. アービタックス®適正使用ガイド (2023年12月作成) [最終閲覧 : 2024/7/12]
- Panitumumab versus cetuximab in patients with chemotherapy-refractory wild-type KRAS exon 2 metastatic colorectal cancer (ASPECCT): a randomised, multicentre, open-label, non-inferiority phase 3 study. Lancet Oncol. 2014 May;15(6):569-79. PMID: 24739896
最終更新日 : 2024年8月8日
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(消化器)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。

