概要
監修医師
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*ノバルティス ファーマの外部サイトへ遷移します
*チェプラファームの外部サイトへ遷移します
用法用量
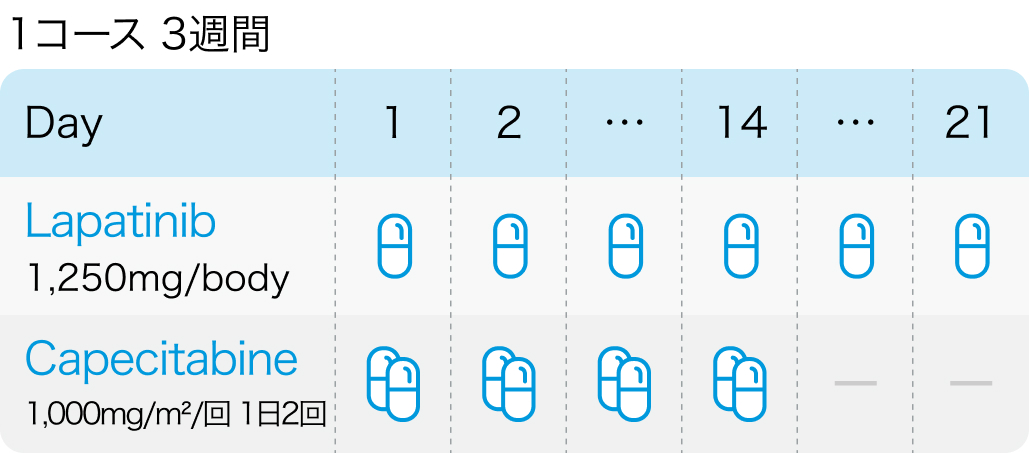
前投薬
- カペシタビンの手足症候群に対して、 予防的に保湿剤を処方しセルフケアを指導する。
- 下痢症状が出現するため、 あらかじめ止瀉薬を処方する。
投与開始基準
EGF100151試験¹⁾より抜粋
HER2陽性の局所進行乳癌またはアントラサイクリン、 タキサン、 トラスツズマブを含むレジメンによる治療後に進行した転移性乳癌の患者
減量・休薬・中止基準
ラパチニブの減量・休薬・中止基準

カペシタビンの減量・休薬・中止基準

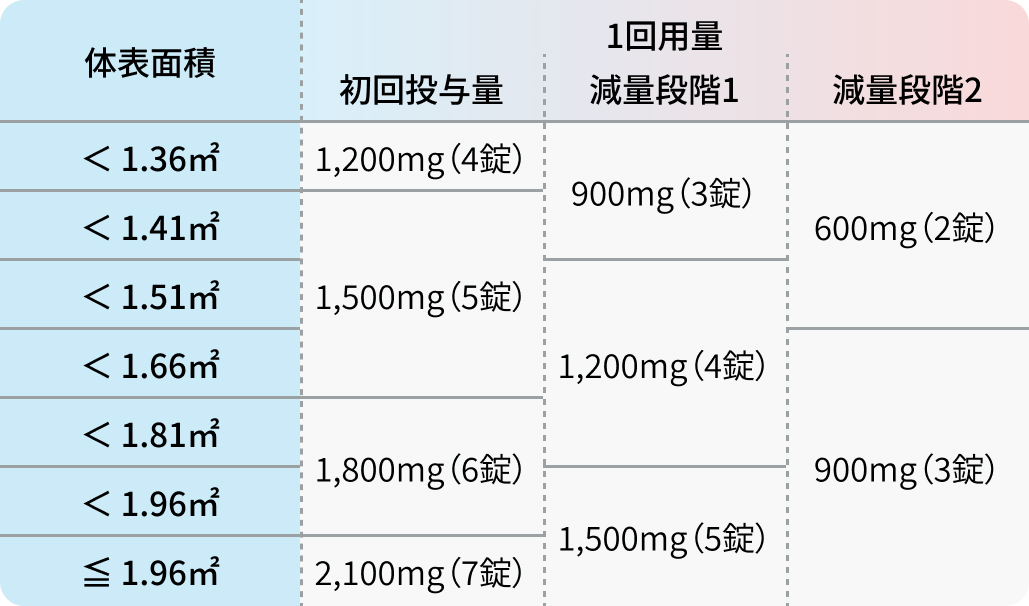
カペシタビンの初回基準量と減量レベル
主な有害事象
EGF109749試験²⁾
- 手掌・足底発赤知覚不全症候群 76.5%
- 下痢 64.7%
- 口内炎 41.2%
EGF100151試験¹⁾
有害事象データを一部引用 (カッコ内は≧Grade3)
主な有害事象
- 下痢 59.8% (12.8%)
- 悪心 43.9% (1.8%)
- 嘔吐 26.2% (1.8%)
- 口内炎 14.6% (0%)
- 便秘 9.8% (0%)
- 倦怠感 17.7% (1.8%)
- 粘膜炎 11.0% (0%)
注意すべき有害事象
- 手足症候群 48.8% (7.3%)
特徴と注意点
- HER2過剰発現が確認された手術不能又は再発乳癌が対象。
- カペシタビンと併用する場合には、 アントラサイクリン系抗悪性腫瘍剤、 タキサン系抗悪性腫瘍剤及びトラスツズマブ (遺伝子組換え) による化学療法後の増悪もしくは再発例が対象。
- カペシタビンとの併用の場合のラパチニブの投与量は1250mg/日。
- ラパチニブは食事の影響を受けるため、 食事の前後1時間を避けて1日1回経口投与する。
- 低脂肪食 (5%脂肪:500 kcal) 及び高脂肪食 (50%脂肪:1000 kcal)とともに投与すると、 空腹時と比べてAUC0-∞がそれぞれ約2.7倍及び4.3倍に増加し、 Cmaxはそれぞれ約2.4倍及び3.0倍に増加すると報告がある。
- カペシタビンは1日2回朝夕食後、 食後30分以内に経口投与する。
- ラパチニブは、 主としてCYP3Aにより代謝される。 また、 P-糖蛋白質及びBCRPの基質である。 更にin vitroにおいてラパチニブのCYP3A4、 CYP2C8、 P-糖蛋白質、 BCRP及びOATP1B1に対する阻害作用が示されている。 そのため、 CYP3A4を阻害、 または誘導する薬物との併用はラパチニブの濃度が変化する可能性があるため注意が必要である。 服用期間中はグレープフルーツ (ジュース) の摂取を避けるようにする。
- 重篤な有害事象として、 肝機能障害、 間質性肺疾患、 心障害、 下痢が出現することがある。 心障害や間質性肺疾患を疑うような初期症状について十分に説明し、 症状が出現した場合には速やかに申し出るように指導をする。
関連する臨床試験|EGF100151試験¹⁾
アントラサイクリン、 タキサン、 およびトラスツズマブを含むレジメンによる治療後に進行したHER2陽性進行乳癌患者において、 カペシタビンへのラパチニブ上乗せ効果を検証した第III相ランダム化比較試験EGF100151の結果より、 無増悪期間 (TTP) に対する有効性が示された。
TTP中央値
- 併用療法群 : 6.2ヵ月
- 単独療法群 : 4.3ヵ月
HR 0.57 (95%CI 0.43-0.77)、 p<0.001
PFS中央値
- 併用療法群 : 8.4ヵ月
- 単独療法群 : 4.1ヵ月
HR 0.47 (95%CI 0.33-0.67)、 p<0.001
OS中央値
- 併用療法群 : 15.6ヵ月
- 単独療法群 : 15.3ヵ月
HR 0.78 (95%CI 0.55-1.12)、 p=0.177
ORR
- 併用療法群 : 23.7%
(95%CI 18.0-30.3%)
- 単独療法群 : 13.9%
(95%CI 9.5-19.5%)
オッズ比 1.9 (95%CI 1.1-3.4)、 p=0.017
CBR
- 併用療法群 : 29.3%
(95%CI 23.1-36.2%)
- 単独療法群 : 17.4%
(95%CI 12.4-23.4%)
オッズ比 2.0 (95%CI 1.2-3.3)、 p=0.008
参考文献
- Lapatinib plus capecitabine for HER2-positive advanced breast cancer. N Engl J Med. 2006 Dec 28;355(26):2733-43. PMID: 17192538
- タイケルブ®添付文書*
*PMDAの外部サイトに遷移
最終更新日:2024年1月26日
監修医師:HOKUTO編集部監修医師
執筆:公益財団法人 がん研究会 がん研有明病院 薬剤部 平岡 知子先生
Lapatinib+Capecitabine
ラパチニブ(タイケルブ®)+カペシタビン(ゼローダ®)
2024年07月11日更新
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*ノバルティス ファーマの外部サイトへ遷移します
*チェプラファームの外部サイトへ遷移します
用法用量

前投薬
- カペシタビンの手足症候群に対して、 予防的に保湿剤を処方しセルフケアを指導する。
- 下痢症状が出現するため、 あらかじめ止瀉薬を処方する。
投与開始基準
EGF100151試験¹⁾より抜粋
HER2陽性の局所進行乳癌またはアントラサイクリン、 タキサン、 トラスツズマブを含むレジメンによる治療後に進行した転移性乳癌の患者
減量・休薬・中止基準
ラパチニブの減量・休薬・中止基準

カペシタビンの減量・休薬・中止基準

カペシタビンの初回基準量と減量レベル

主な有害事象
EGF109749試験²⁾
- 手掌・足底発赤知覚不全症候群 76.5%
- 下痢 64.7%
- 口内炎 41.2%
EGF100151試験¹⁾
有害事象データを一部引用 (カッコ内は≧Grade3)
主な有害事象
- 下痢 59.8% (12.8%)
- 悪心 43.9% (1.8%)
- 嘔吐 26.2% (1.8%)
- 口内炎 14.6% (0%)
- 便秘 9.8% (0%)
- 倦怠感 17.7% (1.8%)
- 粘膜炎 11.0% (0%)
注意すべき有害事象
- 手足症候群 48.8% (7.3%)
特徴と注意点
- HER2過剰発現が確認された手術不能又は再発乳癌が対象。
- カペシタビンと併用する場合には、 アントラサイクリン系抗悪性腫瘍剤、 タキサン系抗悪性腫瘍剤及びトラスツズマブ (遺伝子組換え) による化学療法後の増悪もしくは再発例が対象。
- カペシタビンとの併用の場合のラパチニブの投与量は1250mg/日。
- ラパチニブは食事の影響を受けるため、 食事の前後1時間を避けて1日1回経口投与する。
- 低脂肪食 (5%脂肪:500 kcal) 及び高脂肪食 (50%脂肪:1000 kcal)とともに投与すると、 空腹時と比べてAUC0-∞がそれぞれ約2.7倍及び4.3倍に増加し、 Cmaxはそれぞれ約2.4倍及び3.0倍に増加すると報告がある。
- カペシタビンは1日2回朝夕食後、 食後30分以内に経口投与する。
- ラパチニブは、 主としてCYP3Aにより代謝される。 また、 P-糖蛋白質及びBCRPの基質である。 更にin vitroにおいてラパチニブのCYP3A4、 CYP2C8、 P-糖蛋白質、 BCRP及びOATP1B1に対する阻害作用が示されている。 そのため、 CYP3A4を阻害、 または誘導する薬物との併用はラパチニブの濃度が変化する可能性があるため注意が必要である。 服用期間中はグレープフルーツ (ジュース) の摂取を避けるようにする。
- 重篤な有害事象として、 肝機能障害、 間質性肺疾患、 心障害、 下痢が出現することがある。 心障害や間質性肺疾患を疑うような初期症状について十分に説明し、 症状が出現した場合には速やかに申し出るように指導をする。
関連する臨床試験|EGF100151試験¹⁾
アントラサイクリン、 タキサン、 およびトラスツズマブを含むレジメンによる治療後に進行したHER2陽性進行乳癌患者において、 カペシタビンへのラパチニブ上乗せ効果を検証した第III相ランダム化比較試験EGF100151の結果より、 無増悪期間 (TTP) に対する有効性が示された。
TTP中央値
- 併用療法群 : 6.2ヵ月
- 単独療法群 : 4.3ヵ月
HR 0.57 (95%CI 0.43-0.77)、 p<0.001
PFS中央値
- 併用療法群 : 8.4ヵ月
- 単独療法群 : 4.1ヵ月
HR 0.47 (95%CI 0.33-0.67)、 p<0.001
OS中央値
- 併用療法群 : 15.6ヵ月
- 単独療法群 : 15.3ヵ月
HR 0.78 (95%CI 0.55-1.12)、 p=0.177
ORR
- 併用療法群 : 23.7%
(95%CI 18.0-30.3%)
- 単独療法群 : 13.9%
(95%CI 9.5-19.5%)
オッズ比 1.9 (95%CI 1.1-3.4)、 p=0.017
CBR
- 併用療法群 : 29.3%
(95%CI 23.1-36.2%)
- 単独療法群 : 17.4%
(95%CI 12.4-23.4%)
オッズ比 2.0 (95%CI 1.2-3.3)、 p=0.008
参考文献
- Lapatinib plus capecitabine for HER2-positive advanced breast cancer. N Engl J Med. 2006 Dec 28;355(26):2733-43. PMID: 17192538
- タイケルブ®添付文書*
*PMDAの外部サイトに遷移
最終更新日:2024年1月26日
監修医師:HOKUTO編集部監修医師
執筆:公益財団法人 がん研究会 がん研有明病院 薬剤部 平岡 知子先生
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(乳腺)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。