GEM:ゲムシタビン(ジェムザール®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1000mg/m² 点滴 | 1~ | Day1、8 |
S-1:テガフール・ギメラシル・オテラシル(ティーエスワン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 60~100mg/m² 分2 経口 | 1~ | Day1~14 |
その他
| 1コース21日間。 |
| ゲムシタビン+S-1をGS療法と呼ぶ。 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*日本イーライリリーの外部サイトへ遷移します
- ティーエスワン® (添付文書)
用法用量
JCOG 0805試験¹⁾プロトコル
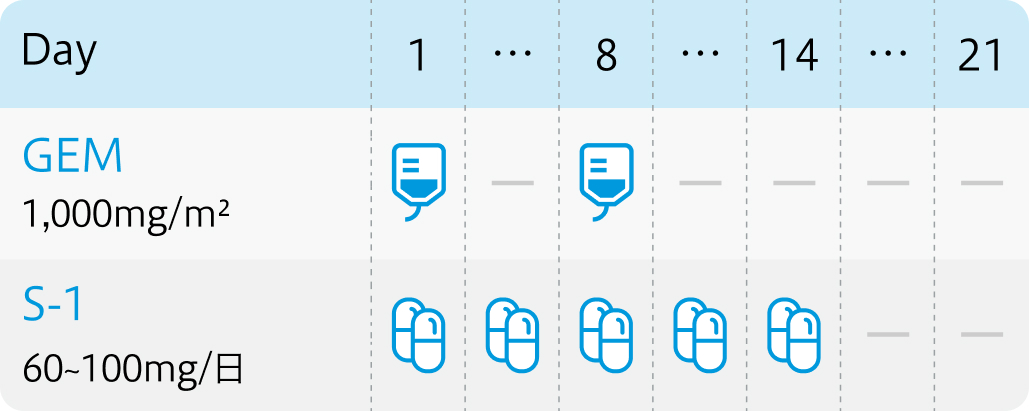
Cancer Sci. 2013 Sep;104(9):1211-6. より作図
投与開始基準
JCOG 0805試験プロトコル¹⁾
切除不能または再発性疾患の胆道がんで20~79歳の患者
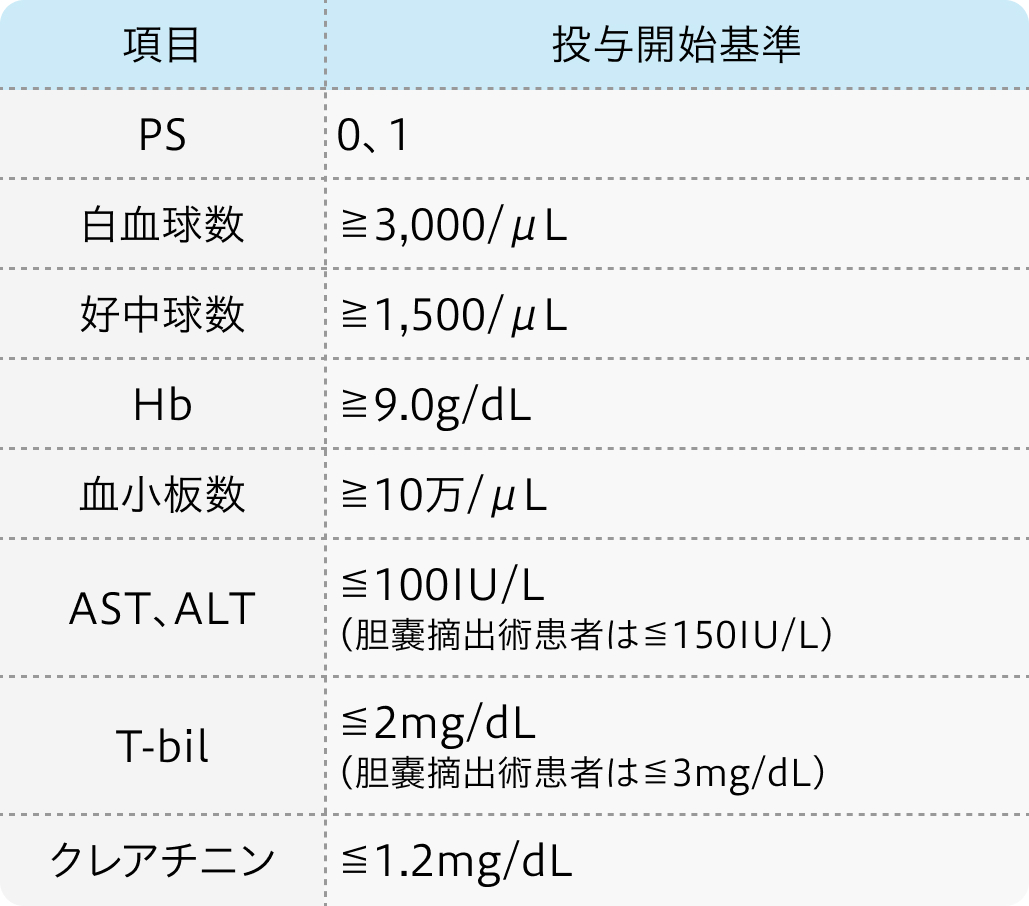
Cancer Sci. 2013 Sep;104(9):1211-6. より作図
減量・休薬・中止基準
JCOG 0805試験¹⁾プロトコル
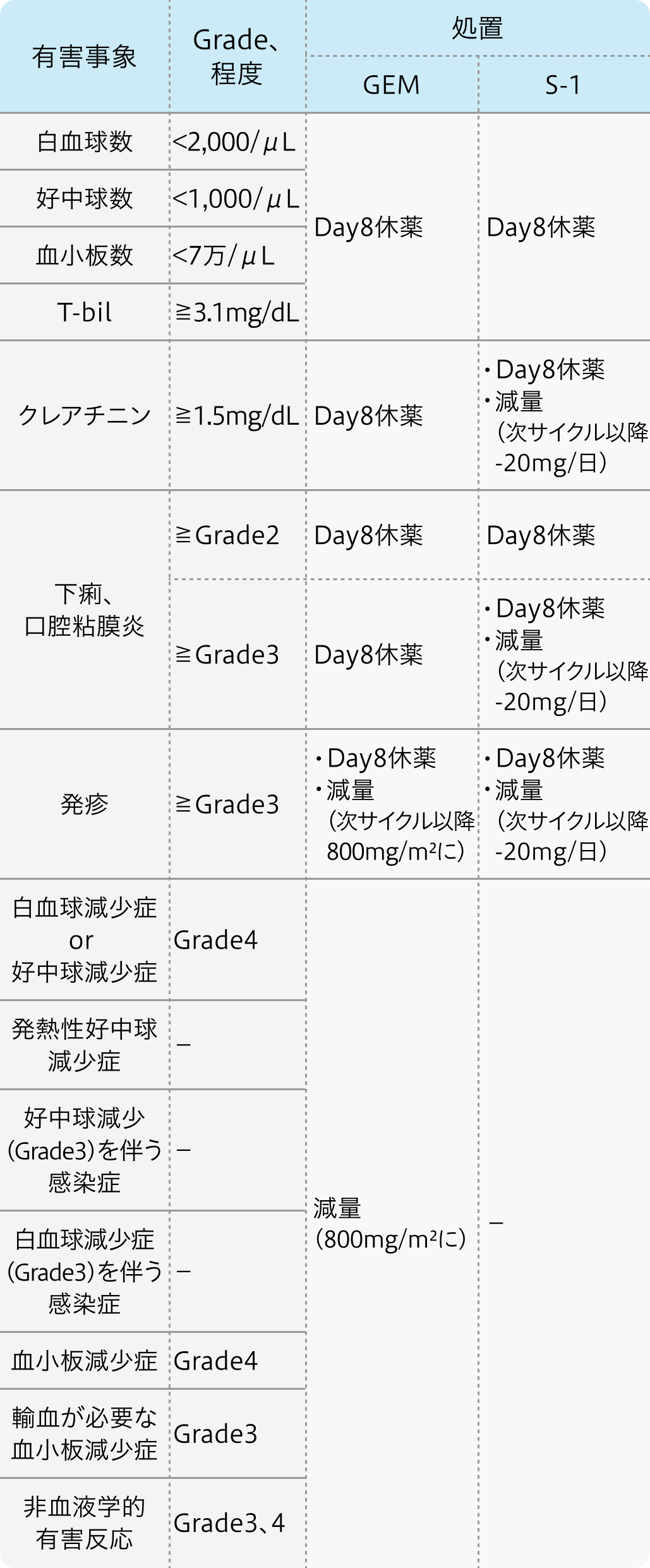
Cancer Sci. 2013 Sep;104(9):1211-6. より作図
主な有害事象
JCOG 0805試験¹⁾
主な有害事象 (カッコ内はGrade3~4)
Cancer Sci. 2013 Sep;104(9):1211-6. より引用
- 白血球数減少 90.2% (29.4%)
- 好中球数減少 88.2% (60.7%)
- ヘモグロビン減少 82.4% (11.8%)
- AST上昇 72.5% (11.8%)
- ALP上昇 70.6% (7.8%)
- 血小板数減少 51.0% (11.8%)
- 発熱性好中球減少症 2.0% (2.0%)
- 倦怠感 56.9% (7.8%)
- 発熱 39.2% (0%)
- 悪心 35.3% (2.0%)
- 便秘 31.4% (0%)
- 下痢 19.6% (2.0%)
- 嘔吐 13.7% (2.0%)
注意すべき有害事象 (カッコ内はGrade3~4)
Cancer Sci. 2013 Sep;104(9):1211-6. より引用
- 白血球数減少 90.2% (29.4%)
- 脱毛症 13.7% (0%)
特徴と注意点
GC療法時代に、 S-1を併用し、 非劣性が示されたレジメンです¹⁾。 S-1は単独投与と比較し、 一段階減量での併用となっています。 長時間の補液が不要なことがメリットです。 複合免疫療法の時代となり、 使用頻度は今後、 減少することが考えられます。
関連する臨床試験|JCOG 0805試験¹⁾
再発または切除不能な胆道癌患者において、 ゲムシタビン+S-1 (GS) の併用療法の効果を、 S-1単独療法を対照に検証した第Ⅱ相ランダム化比較試験JCOG 0805の結果より、 全生存期間 (OS)および無増悪生存期間(PFS)、 奏効率 (ORR)を有意に改善させることが示された。
OS中央値
- GS群 : 12.5ヵ月
(95%CI 9.0-15.4ヵ月)
- S-1単独群 : 9.0ヵ月
(95%CI 7.3-12.7ヵ月)
HR 0.859 (95%CI 0.543-1.360)、 p=0.52
OS率 (1年時)
- GS群 : 52.9%
- S-1単独群 : 40.0%
サブグループ解析
- 両群とも胆嚢癌患者の生存率は、 非胆嚢癌患者の生存率より悪かった。
- 両群とも再発患者の生存率は、 II/III期、 IV期の患者より良好であった。
PFS中央値
- GS群 : 7.1ヵ月
(95%CI 5.7-8.6ヵ月)
- S-1単独群 : 4.2ヵ月
(95%CI 2.5-5.0ヵ月)
HR 0.437 (95%CI 0.286-0.669)、 p<0.0001
測定可能病変を有する患者におけるORR
- GS群 : 36.4%
- S-1単独群 : 17.4%
胆嚢癌患者
- GS群 : 12.5%
- S-1群 : 16.7%
非胆嚢癌患者
- GS群 : 50%
- S-1群 : 17.9%
出典
- Randomized phase II study of gemcitabine plus S-1 versus S-1 in advanced biliary tract cancer: a Japan Clinical Oncology Group trial (JCOG 0805). Cancer Sci. 2013 Sep;104(9):1211-6. PMID: 23763511
- 日本イーライリリー. ジェムザール®電子添文 (2021年8月改訂第1版) [最終閲覧 : 2024/03/06]
- 大鵬薬品. ティーエスワン®電子添文 (2023年9月改訂第3版) [最終閲覧 : 2024/03/06]
最終更新日 : 2024年3月13日
監修医:神奈川県立がんセンター 消化器内科 上野 誠先生
GS (GEM+S-1)
GEM:ゲムシタビン(ジェムザール®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1000mg/m² 点滴 | 1~ | Day1、8 |
S-1:テガフール・ギメラシル・オテラシル(ティーエスワン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 60~100mg/m² 分2 経口 | 1~ | Day1~14 |
その他
| 1コース21日間。 |
| ゲムシタビン+S-1をGS療法と呼ぶ。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*日本イーライリリーの外部サイトへ遷移します
- ティーエスワン® (添付文書)
用法用量
JCOG 0805試験¹⁾プロトコル

Cancer Sci. 2013 Sep;104(9):1211-6. より作図
投与開始基準
JCOG 0805試験プロトコル¹⁾
切除不能または再発性疾患の胆道がんで20~79歳の患者

Cancer Sci. 2013 Sep;104(9):1211-6. より作図
減量・休薬・中止基準
JCOG 0805試験¹⁾プロトコル

Cancer Sci. 2013 Sep;104(9):1211-6. より作図
主な有害事象
JCOG 0805試験¹⁾
主な有害事象 (カッコ内はGrade3~4)
Cancer Sci. 2013 Sep;104(9):1211-6. より引用
- 白血球数減少 90.2% (29.4%)
- 好中球数減少 88.2% (60.7%)
- ヘモグロビン減少 82.4% (11.8%)
- AST上昇 72.5% (11.8%)
- ALP上昇 70.6% (7.8%)
- 血小板数減少 51.0% (11.8%)
- 発熱性好中球減少症 2.0% (2.0%)
- 倦怠感 56.9% (7.8%)
- 発熱 39.2% (0%)
- 悪心 35.3% (2.0%)
- 便秘 31.4% (0%)
- 下痢 19.6% (2.0%)
- 嘔吐 13.7% (2.0%)
注意すべき有害事象 (カッコ内はGrade3~4)
Cancer Sci. 2013 Sep;104(9):1211-6. より引用
- 白血球数減少 90.2% (29.4%)
- 脱毛症 13.7% (0%)
特徴と注意点
GC療法時代に、 S-1を併用し、 非劣性が示されたレジメンです¹⁾。 S-1は単独投与と比較し、 一段階減量での併用となっています。 長時間の補液が不要なことがメリットです。 複合免疫療法の時代となり、 使用頻度は今後、 減少することが考えられます。
関連する臨床試験|JCOG 0805試験¹⁾
再発または切除不能な胆道癌患者において、 ゲムシタビン+S-1 (GS) の併用療法の効果を、 S-1単独療法を対照に検証した第Ⅱ相ランダム化比較試験JCOG 0805の結果より、 全生存期間 (OS)および無増悪生存期間(PFS)、 奏効率 (ORR)を有意に改善させることが示された。
OS中央値
- GS群 : 12.5ヵ月
(95%CI 9.0-15.4ヵ月)
- S-1単独群 : 9.0ヵ月
(95%CI 7.3-12.7ヵ月)
HR 0.859 (95%CI 0.543-1.360)、 p=0.52
OS率 (1年時)
- GS群 : 52.9%
- S-1単独群 : 40.0%
サブグループ解析
- 両群とも胆嚢癌患者の生存率は、 非胆嚢癌患者の生存率より悪かった。
- 両群とも再発患者の生存率は、 II/III期、 IV期の患者より良好であった。
PFS中央値
- GS群 : 7.1ヵ月
(95%CI 5.7-8.6ヵ月)
- S-1単独群 : 4.2ヵ月
(95%CI 2.5-5.0ヵ月)
HR 0.437 (95%CI 0.286-0.669)、 p<0.0001
測定可能病変を有する患者におけるORR
- GS群 : 36.4%
- S-1単独群 : 17.4%
胆嚢癌患者
- GS群 : 12.5%
- S-1群 : 16.7%
非胆嚢癌患者
- GS群 : 50%
- S-1群 : 17.9%
出典
- Randomized phase II study of gemcitabine plus S-1 versus S-1 in advanced biliary tract cancer: a Japan Clinical Oncology Group trial (JCOG 0805). Cancer Sci. 2013 Sep;104(9):1211-6. PMID: 23763511
- 日本イーライリリー. ジェムザール®電子添文 (2021年8月改訂第1版) [最終閲覧 : 2024/03/06]
- 大鵬薬品. ティーエスワン®電子添文 (2023年9月改訂第3版) [最終閲覧 : 2024/03/06]
最終更新日 : 2024年3月13日
監修医:神奈川県立がんセンター 消化器内科 上野 誠先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
