治療スケジュール
概要
監修医師
RAM:Ramucirumab(サイラムザ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 8mg/kg 点滴 | 1~ | Day1,15 |
PTX:Paclitaxel(タキソール®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 80mg/m² 点滴 | 1~ | Day1,8,15 |
その他
| 1コース28日間。 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*日本イーライリリー株式会社の外部サイトへ遷移します
用法用量
RAINBOW試験⁴⁾のプロトコル
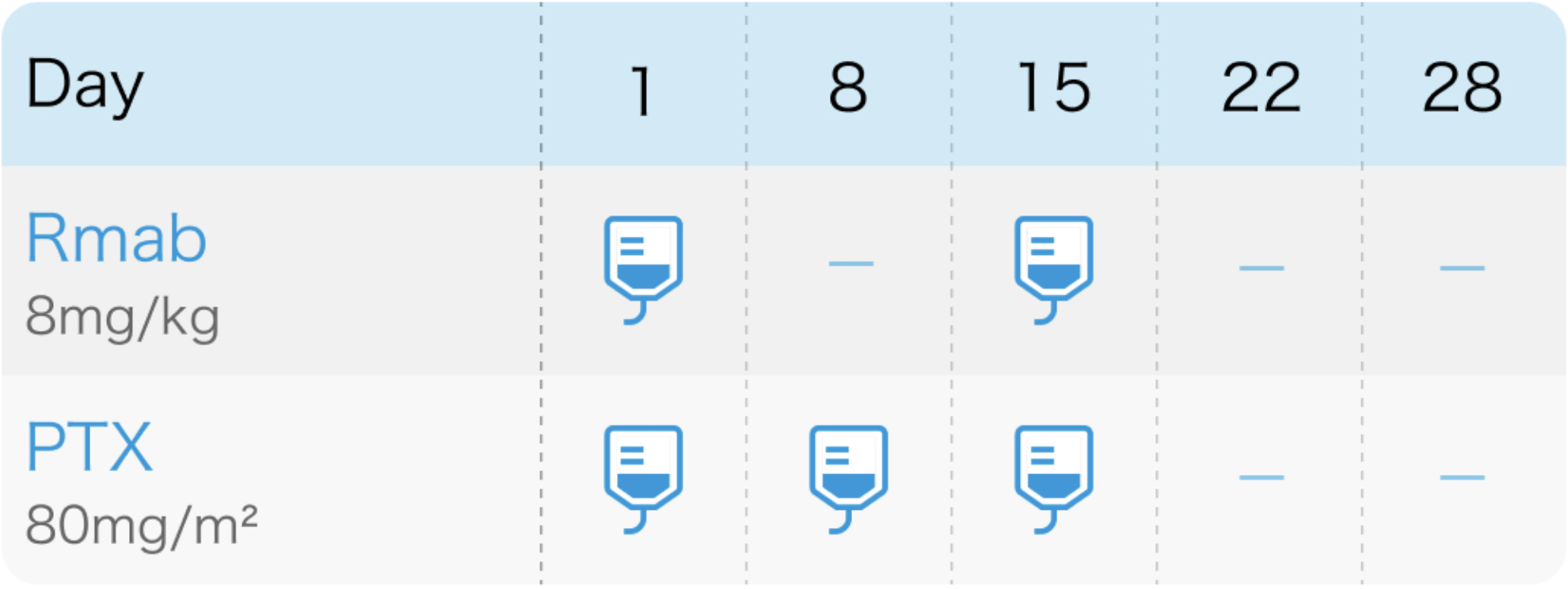
Lancet Oncol. 2014 Oct;15(11):1224-35⁴⁾より作図
投与開始基準
適正使用ガイド³⁾の基準
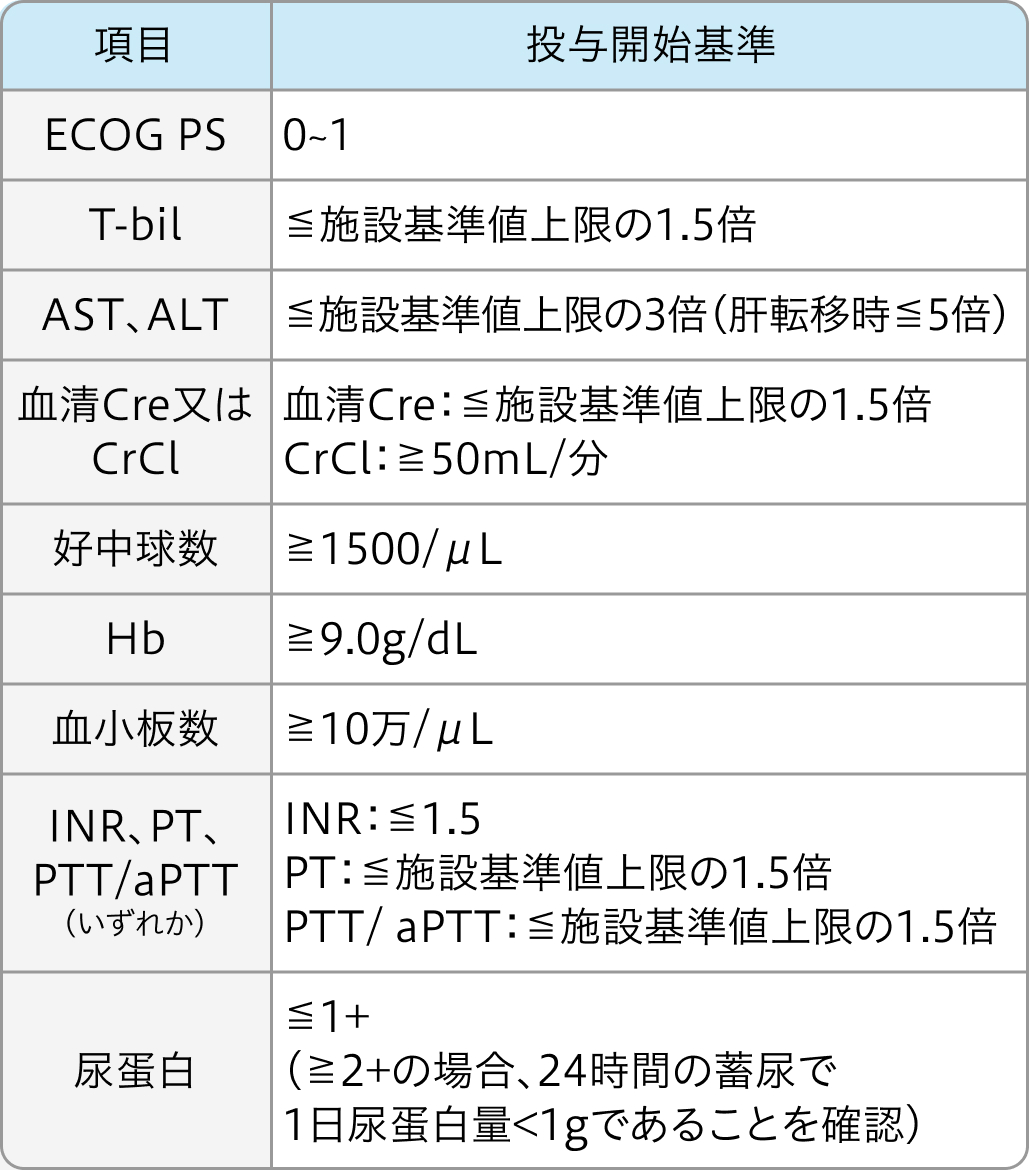
サイラムザ®適正使用ガイド (2024年6月作成)³⁾より作図
継続投与基準
適正使用ガイド³⁾の基準
ラムシルマブの継続投与基準

サイラムザ®適正使用ガイド (2024年6月作成)³⁾より作図
パクリタキセルの継続投与基準
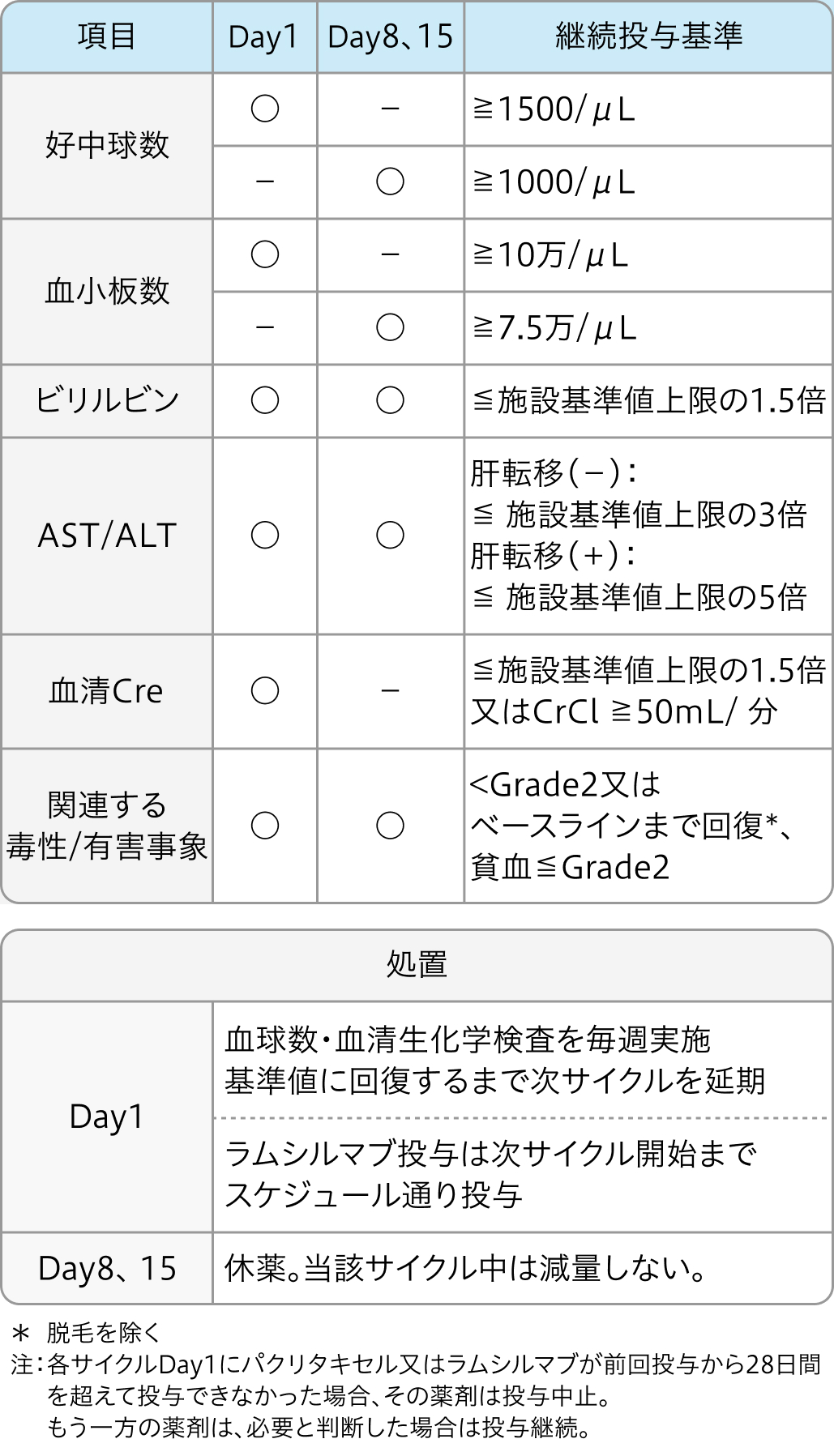
サイラムザ®適正使用ガイド (2024年6月作成)³⁾より作図
減量・中止基準
ラムシルマブ電子添文²⁾の基準
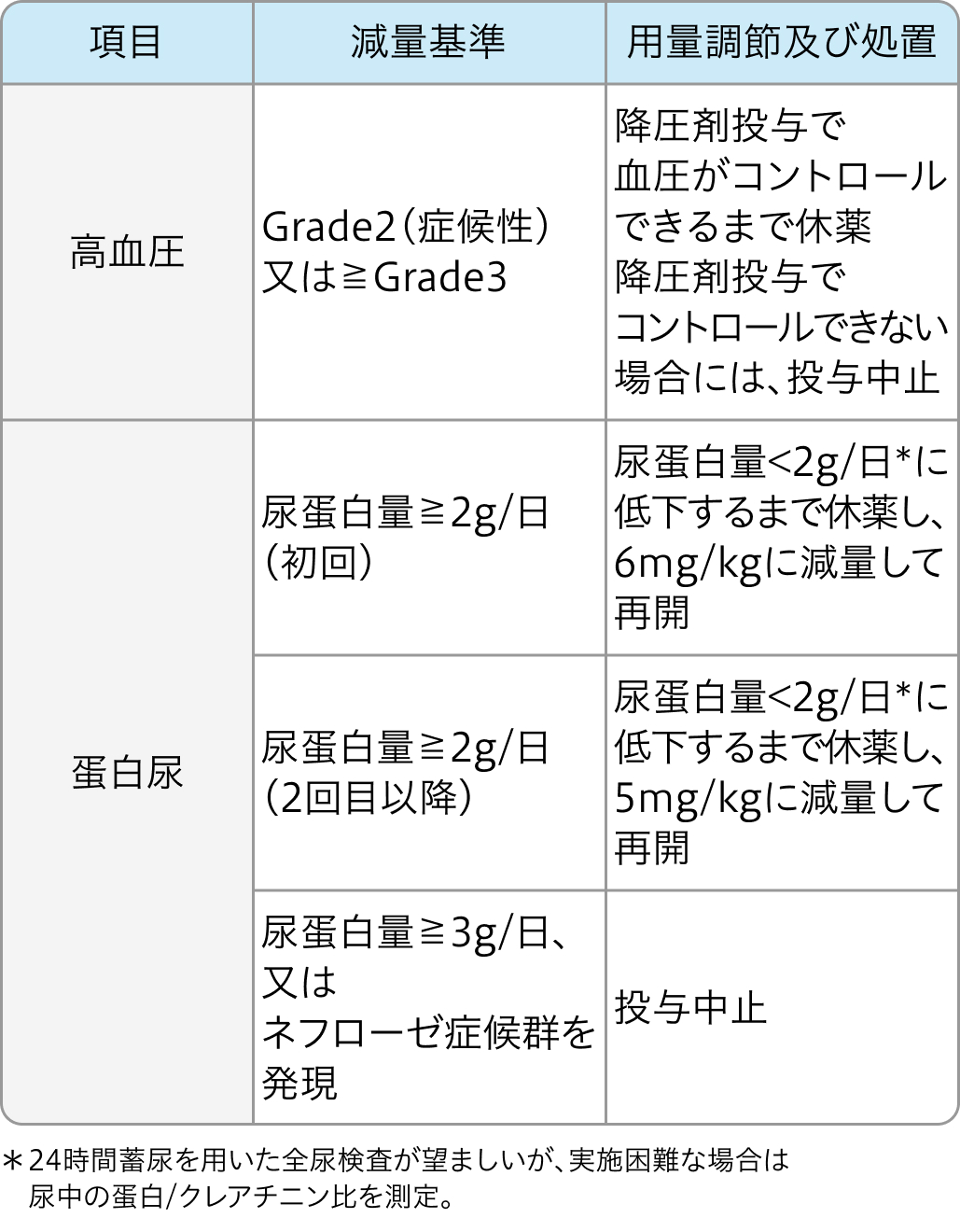
サイラムザ®電子添文 (2024年6月改訂第4版)²⁾より作図
適正使用ガイド³⁾の基準
ラムシルマブの中止基準
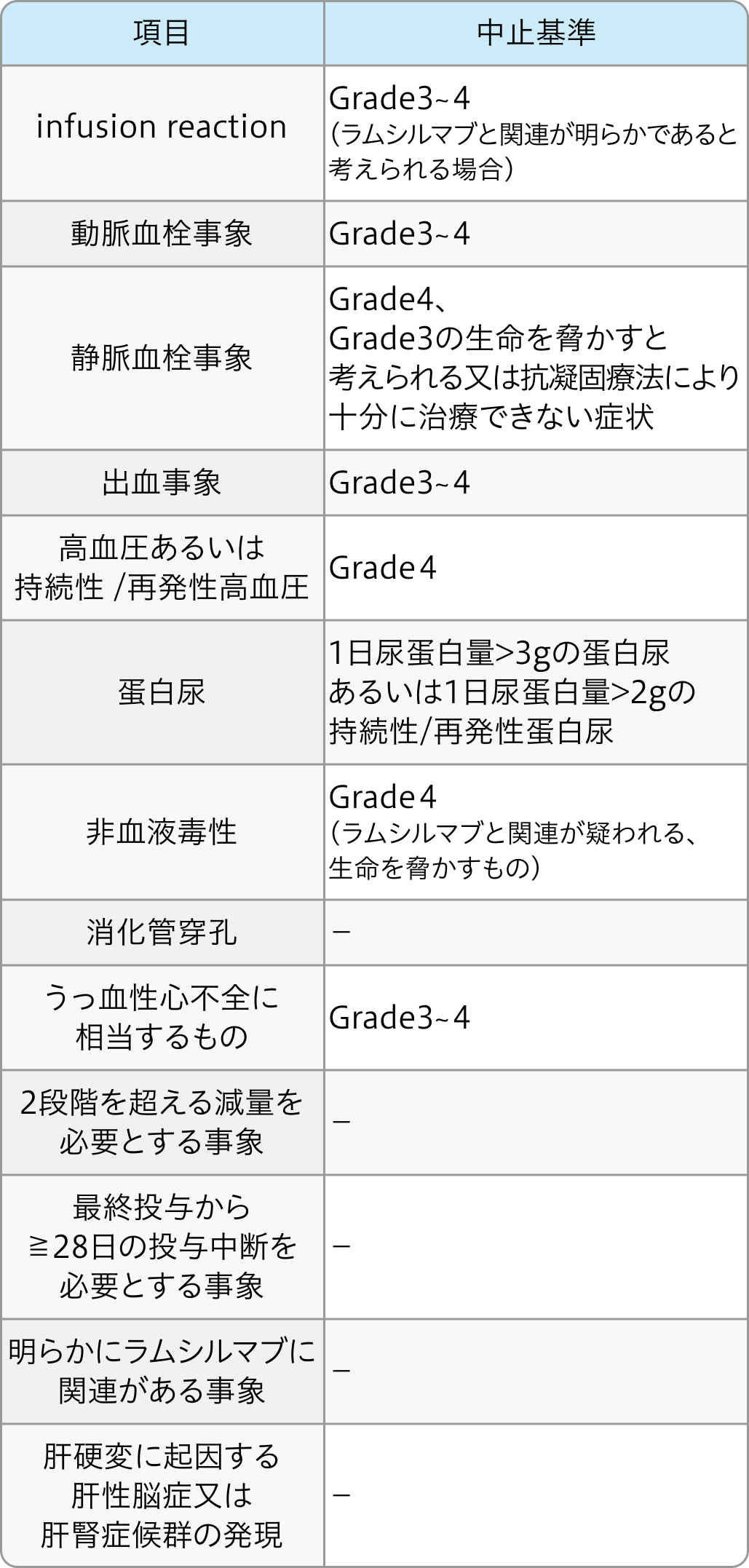
サイラムザ®適正使用ガイド (2024年6月作成)³⁾より作図
パクリタキセルの中止基準
- infusion reaction:Grade3~4 (パクリタキセルと関連が明らかであると考えられる)
- 2段階を超える減量を必要とする事象
- 最終投与から ≧28日の投与中断を必要とする事象
- 明らかにパクリタキセルに関連がある事象 (再発性あるいは持続性のニューロパチー等)
サイラムザ®適正使用ガイド (2024年6月作成)³⁾より作図
主な有害事象
RAINBOW試験⁴⁾
主な有害事象 (カッコ内はGrade3~4)
- 好中球減少症 54.4% (40.7%)
- 貧血 33.9% (9.2%)
- 白血球減少症 33.9% (17.4%)
- 血小板減少症 13.1% (1.5%)
- 悪心 35.2% (1.8%)
- 下痢 32.4% (3.7%)
- 嘔吐 26.9% (3.1%)
- 便秘 21.4% (0%)
- 口内炎 19.6% (0.6%)
- 疲労 39.8% (7.0%)
- 発熱 18.0% (0.9%)
- 体重減少 13.8% (1.8%)
- AST増加 8.3% (1.8%)
- ALT増加 6.1% (1.2%)
- 食欲減退 40.1% (3.1%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 末梢性感覚ニューロパチー 17.4% (1.8%)
- 末梢性ニューロパチー 14.4% (3.1%)
- 蛋白尿 16.5% (1.2%)
- 脱毛症 32.7% (0%)
- 高血圧 23.9% (14.1%)
Lancet Oncol. 2014 Oct;15(11):1224-35⁴⁾より引用
上手に使うためのワンポイント
- RAINBOW試験⁴⁾におけるPTXの減量方法は10mg/m²ずつ減量するとされている。 60mg/m²投与で減量が必要なイベントが発生した場合は、 PTX投与を中止することになっていたが、 リアルワールドでは、 PTXのday8投与を計画的にskipする実質PTX隔週投与で継続することも選択肢となる。
- REGARD試験⁵⁾の結果によりRAM単剤でも効果があるため、 PTXが何らかの理由で終了したとしてもRAMのみ継続する。
- RAMによる尿蛋白1+出現時には、 次コースからのUPCRの事前測定を考慮する。 UPCR<2.0で投与可能。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
特徴と注意点
- PTXは無水エタノールで溶解されているため、 投与前までにアルコール不耐でないかの確認をすること、 投与後には車の運転は控えるように指導する。
- 添加物であるポリオキシエチレンヒマシ油へのアレルギーがある患者や、 アルコール不耐の患者には使用不能のためnPTX+RAMの使用を考慮する。 また一次治療終了時にCIPN G2の場合はIRI+RAMを考慮する。
- RAINBOW試験⁴⁾において好中球減少発現の中央値がday15だった。 実臨床でもday15に好中球減少を経験するが、 その際にはPTXの投与をskipし、 RAMのみ投与する。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
関連する臨床試験|RAINBOW試験⁴⁾
1次治療後に進行した胃または食道胃接合部腺癌患者において、 ラムシルマブ+パクリタキセルの併用療法の効果を、 プラセボ+パクリタキセルを対照に検証した第Ⅲ相二重盲検ランダム化比較試験RAINBOWの結果より、 全生存期間 (OS) に対する有効性が示された。
OS中央値
- ラムシルマブ群:9.6ヵ月
(95%CI 8.5-10.8ヵ月)
- プラセボ群:7.4ヵ月
(95%CI 6.3-8.4ヵ月)
HR 0.807 (95%CI 0.678-0.962)、 p=0.017
OS率 (6ヵ月時、 12ヵ月時)
- ラムシルマブ群:72%、 40%
- プラセボ群:57%、 30%
OSの多変量解析
多変量解析により、 生存率改善に寄与する下記の7つの因子が同定された。
- ECOG PS0
- 体重減少10%未満
- 転移部位は2箇所まで
- 腹水なし
- 腫瘍が高分化または中分化
- 胃切除の既往
PFS中央値
- ラムシルマブ群:4.4ヵ月
(95%CI 4.2-5.3ヵ月)
- プラセボ群:2.9ヵ月
(95%CI 2.8-3.0ヵ月)
HR 0.635 (95%CI 0.536-0.752)、 p<0.0001
PFS率 (6ヵ月時、 9ヵ月時)
- ラムシルマブ群:36%、 22%
- プラセボ群:17%、 10%
ORR
- ラムシルマブ群:28%
(95%CI 23-33%)
- プラセボ群:16%
(95%CI 13-20%)
p=0.0001
病勢コントロール率
- ラムシルマブ群:80%
(95%CI 75-84%)
- プラセボ群:64%
(95%CI 58-69%)
p<0.0001
奏効期間 (中央値)
- ラムシルマブ群:4.4ヵ月
- プラセボ群:2.8ヵ月
出典
- クリニジェン株式会社. タキソール®電子添文 (2023年7月改訂 第2版) [最終閲覧 : 2024/03/14]
- 日本イーライリリー株式会社. サイラムザ®電子添文 (2024年6月改訂第4版) [最終閲覧 : 2024/7/11]
- 日本イーライリリー株式会社. サイラムザ®適正使用ガイド (2024年6月作成) [最終閲覧 : 2024/7/11]
- Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW): a double-blind, randomised phase 3 trial. Lancet Oncol. 2014 Oct;15(11):1224-35. PMID: 25240821
- Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (REGARD): an international, randomised, multicentre, placebo-controlled, phase 3 trial. Lancet. 2014 Jan 4;383(9911):31-39. PMID: 24094768
最終更新日:2024年8月21日
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
PTX + RAM
パクリタキセル (タキソール®) + ラムシルマブ (サイラムザ®)
2024年08月21日更新
RAM:Ramucirumab(サイラムザ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 8mg/kg 点滴 | 1~ | Day1,15 |
PTX:Paclitaxel(タキソール®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 80mg/m² 点滴 | 1~ | Day1,8,15 |
その他
| 1コース28日間。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*日本イーライリリー株式会社の外部サイトへ遷移します
用法用量
RAINBOW試験⁴⁾のプロトコル

Lancet Oncol. 2014 Oct;15(11):1224-35⁴⁾より作図
投与開始基準
適正使用ガイド³⁾の基準

サイラムザ®適正使用ガイド (2024年6月作成)³⁾より作図
継続投与基準
適正使用ガイド³⁾の基準
ラムシルマブの継続投与基準

サイラムザ®適正使用ガイド (2024年6月作成)³⁾より作図
パクリタキセルの継続投与基準

サイラムザ®適正使用ガイド (2024年6月作成)³⁾より作図
減量・中止基準
ラムシルマブ電子添文²⁾の基準

サイラムザ®電子添文 (2024年6月改訂第4版)²⁾より作図
適正使用ガイド³⁾の基準
ラムシルマブの中止基準

サイラムザ®適正使用ガイド (2024年6月作成)³⁾より作図
パクリタキセルの中止基準
- infusion reaction:Grade3~4 (パクリタキセルと関連が明らかであると考えられる)
- 2段階を超える減量を必要とする事象
- 最終投与から ≧28日の投与中断を必要とする事象
- 明らかにパクリタキセルに関連がある事象 (再発性あるいは持続性のニューロパチー等)
サイラムザ®適正使用ガイド (2024年6月作成)³⁾より作図
主な有害事象
RAINBOW試験⁴⁾
主な有害事象 (カッコ内はGrade3~4)
- 好中球減少症 54.4% (40.7%)
- 貧血 33.9% (9.2%)
- 白血球減少症 33.9% (17.4%)
- 血小板減少症 13.1% (1.5%)
- 悪心 35.2% (1.8%)
- 下痢 32.4% (3.7%)
- 嘔吐 26.9% (3.1%)
- 便秘 21.4% (0%)
- 口内炎 19.6% (0.6%)
- 疲労 39.8% (7.0%)
- 発熱 18.0% (0.9%)
- 体重減少 13.8% (1.8%)
- AST増加 8.3% (1.8%)
- ALT増加 6.1% (1.2%)
- 食欲減退 40.1% (3.1%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 末梢性感覚ニューロパチー 17.4% (1.8%)
- 末梢性ニューロパチー 14.4% (3.1%)
- 蛋白尿 16.5% (1.2%)
- 脱毛症 32.7% (0%)
- 高血圧 23.9% (14.1%)
Lancet Oncol. 2014 Oct;15(11):1224-35⁴⁾より引用
上手に使うためのワンポイント
- RAINBOW試験⁴⁾におけるPTXの減量方法は10mg/m²ずつ減量するとされている。 60mg/m²投与で減量が必要なイベントが発生した場合は、 PTX投与を中止することになっていたが、 リアルワールドでは、 PTXのday8投与を計画的にskipする実質PTX隔週投与で継続することも選択肢となる。
- REGARD試験⁵⁾の結果によりRAM単剤でも効果があるため、 PTXが何らかの理由で終了したとしてもRAMのみ継続する。
- RAMによる尿蛋白1+出現時には、 次コースからのUPCRの事前測定を考慮する。 UPCR<2.0で投与可能。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
特徴と注意点
- PTXは無水エタノールで溶解されているため、 投与前までにアルコール不耐でないかの確認をすること、 投与後には車の運転は控えるように指導する。
- 添加物であるポリオキシエチレンヒマシ油へのアレルギーがある患者や、 アルコール不耐の患者には使用不能のためnPTX+RAMの使用を考慮する。 また一次治療終了時にCIPN G2の場合はIRI+RAMを考慮する。
- RAINBOW試験⁴⁾において好中球減少発現の中央値がday15だった。 実臨床でもday15に好中球減少を経験するが、 その際にはPTXの投与をskipし、 RAMのみ投与する。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
関連する臨床試験|RAINBOW試験⁴⁾
1次治療後に進行した胃または食道胃接合部腺癌患者において、 ラムシルマブ+パクリタキセルの併用療法の効果を、 プラセボ+パクリタキセルを対照に検証した第Ⅲ相二重盲検ランダム化比較試験RAINBOWの結果より、 全生存期間 (OS) に対する有効性が示された。
OS中央値
- ラムシルマブ群:9.6ヵ月
(95%CI 8.5-10.8ヵ月)
- プラセボ群:7.4ヵ月
(95%CI 6.3-8.4ヵ月)
HR 0.807 (95%CI 0.678-0.962)、 p=0.017
OS率 (6ヵ月時、 12ヵ月時)
- ラムシルマブ群:72%、 40%
- プラセボ群:57%、 30%
OSの多変量解析
多変量解析により、 生存率改善に寄与する下記の7つの因子が同定された。
- ECOG PS0
- 体重減少10%未満
- 転移部位は2箇所まで
- 腹水なし
- 腫瘍が高分化または中分化
- 胃切除の既往
PFS中央値
- ラムシルマブ群:4.4ヵ月
(95%CI 4.2-5.3ヵ月)
- プラセボ群:2.9ヵ月
(95%CI 2.8-3.0ヵ月)
HR 0.635 (95%CI 0.536-0.752)、 p<0.0001
PFS率 (6ヵ月時、 9ヵ月時)
- ラムシルマブ群:36%、 22%
- プラセボ群:17%、 10%
ORR
- ラムシルマブ群:28%
(95%CI 23-33%)
- プラセボ群:16%
(95%CI 13-20%)
p=0.0001
病勢コントロール率
- ラムシルマブ群:80%
(95%CI 75-84%)
- プラセボ群:64%
(95%CI 58-69%)
p<0.0001
奏効期間 (中央値)
- ラムシルマブ群:4.4ヵ月
- プラセボ群:2.8ヵ月
出典
- クリニジェン株式会社. タキソール®電子添文 (2023年7月改訂 第2版) [最終閲覧 : 2024/03/14]
- 日本イーライリリー株式会社. サイラムザ®電子添文 (2024年6月改訂第4版) [最終閲覧 : 2024/7/11]
- 日本イーライリリー株式会社. サイラムザ®適正使用ガイド (2024年6月作成) [最終閲覧 : 2024/7/11]
- Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW): a double-blind, randomised phase 3 trial. Lancet Oncol. 2014 Oct;15(11):1224-35. PMID: 25240821
- Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (REGARD): an international, randomised, multicentre, placebo-controlled, phase 3 trial. Lancet. 2014 Jan 4;383(9911):31-39. PMID: 24094768
最終更新日:2024年8月21日
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(消化器)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
