本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
テセントリク®点滴静注 (アテゾリズマブ)
*中外製薬株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】3週間 (維持療法は3又は4週間)
【催吐性】 中等度催吐性*
【FN発症】低リスク**
*CBDCA併用レジメンは、 CBDCA AUC≧4の場合、 5-HT3受容体拮抗薬、 デキサメタゾン、 NK1受容体拮抗薬を併用
**IMpower133試験のFN発生率1.0%³⁾を基に編集部が分類
1~4コース : 化学療法併用
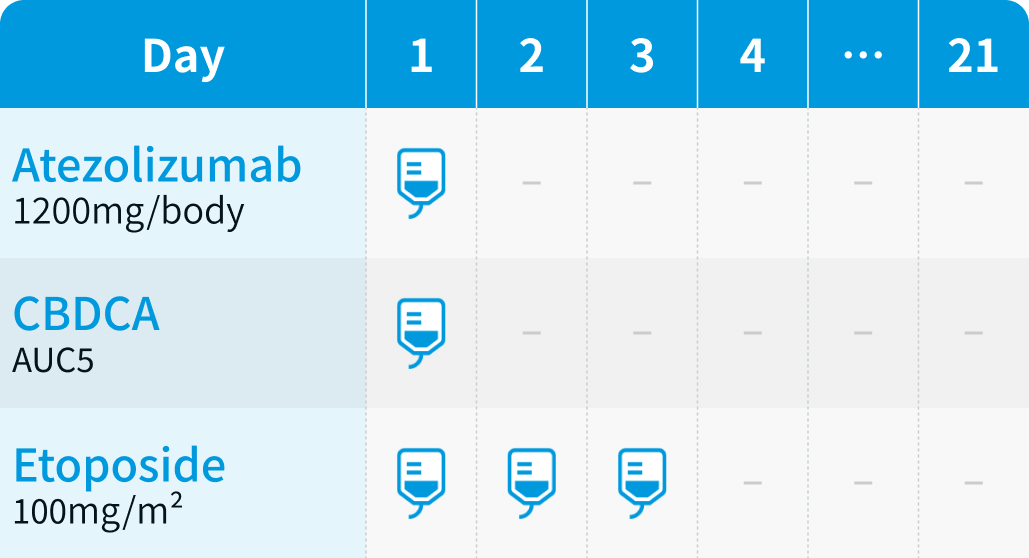
5コース目以降 : 維持療法

2025年9月19日、 1回1680mgを4週間ごとに点滴静注する用法・用量が追加承認された。
👨⚕️q4wの追加承認により、 単剤療法の利便性が向上した。 一方で、 併用療法においてはq4w投与が未承認である点に留意が必要である。
和歌山県立医科大学附属病院 赤松弘朗先生
Key Data|臨床試験結果
IMpower-133試験³⁾ >>詳しくみる
SCLC患者の初回治療としてCBDCA/Etop+Atezolizumab併用の有効性と安全性を、 プラセボ併用群と比較した国際第Ⅲ相ランダム化比較試験 (201名 vs 202名)
【有効性】CE+Atezolizumab併用群の結果
- ORR 60.2%
- mPFS 5.2ヵ月
- mOS 12.3ヵ月
【安全性】主な有害事象 (括弧内はGrade3~4)
- 貧血 38.9% (14.1%)
- 好中球数減少症 36.4%(23.2%)
- 悪心 31.8% (0.5%)
- 疲労 21.2% (1.5%)
- 食欲不振 20.7% (1.0%)
- 好中球数の減少 17.7% (14.1%)
- 血小板減少症 16.2% (10.1%)
👨⚕️監修医師コメント : アテゾリズマブとデュルバルマブで有効性および安全性に大きな差はない。 デュルバルマブはCDDPでも使用可能、 3-4週毎で投与可能な点が異なる。
>>Durvalumab併用 (CASPIAN試験)はこちら
プロトコル
IMpower133試験のプロトコル³⁾⁴⁾より引用
投与開始基準例
- 好中球≧1500/mm³ - リンパ球≧500/mm³
- 血小板≧10万/mm³ - Hb≧9.0g/dL
- AST / ALT / ALP ≦2.5×正常域上限(ULN)
- 血清Bil≦1.25×ULN - 血清Cre≦1.5×ULN
- INR 又はAPTT≦1.5×ULN
N Engl J Med. 2018 Dec 6;379(23):2220-2229. より引用
休薬・減量・中止基準例
非血液毒性 : ベースライン値以下 (又は Grade 1以下) に回復するまで、 最長63日間休薬
血液毒性 : 好中球≧1,500/mm³かつ血小板≧10万/mm³に回復するまで、 最長63日間休薬
N Engl J Med. 2018 Dec 6;379(23):2220-2229. より引用
再開・中止基準
一度減量した場合、 用量を100%に増量することはできない (以下の表参照)。 2回の減量後にGrade 3又は4の毒性が発現した場合、 もしくは毒性のために63日間を超えて投与を延期した場合は投与を中止すること。
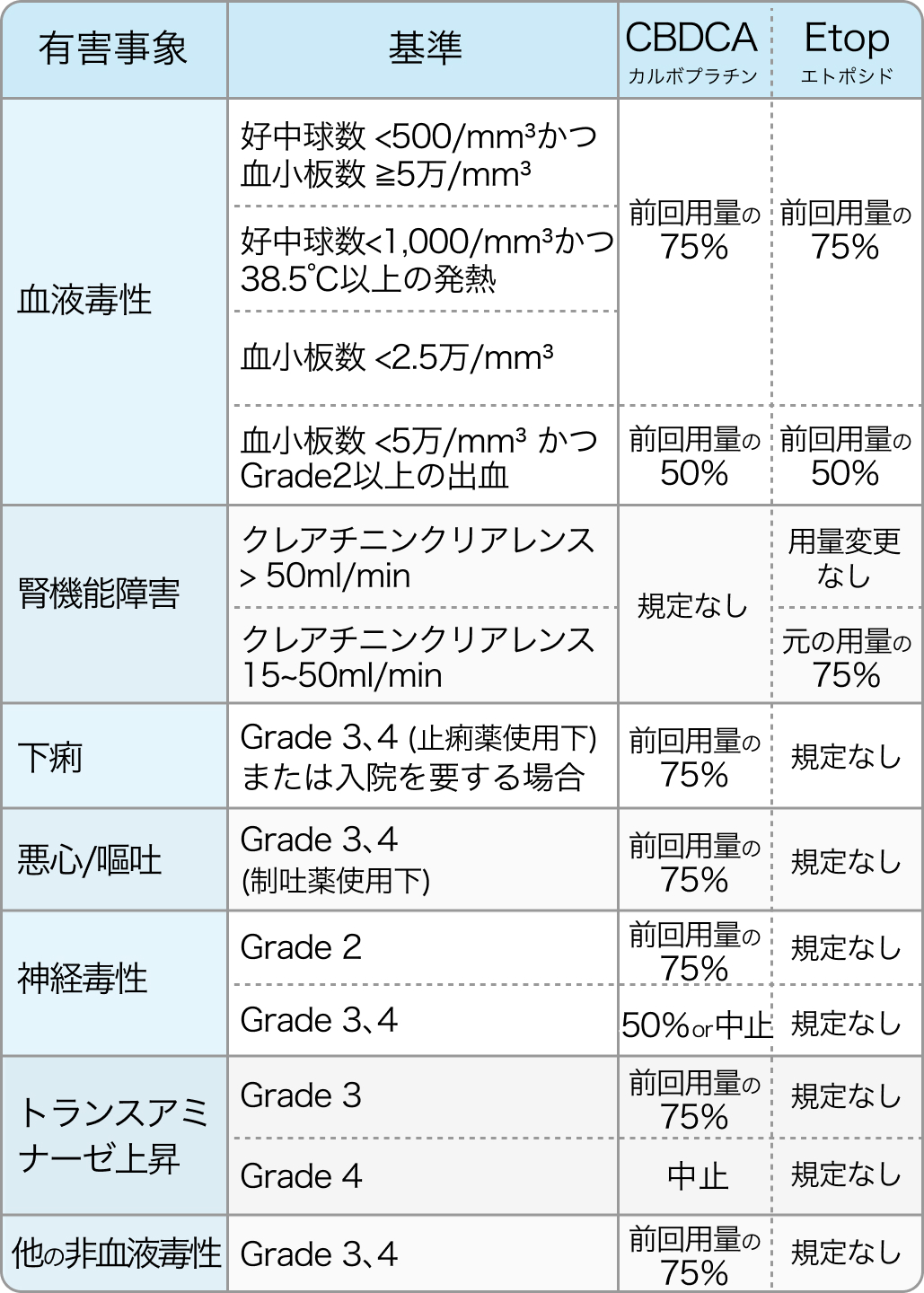
N Engl J Med. 2018 Dec 6;379(23):2220-2229. より引用
レジメンの特徴と注意点
肺癌診療ガイドライン2025の推奨⁵⁾
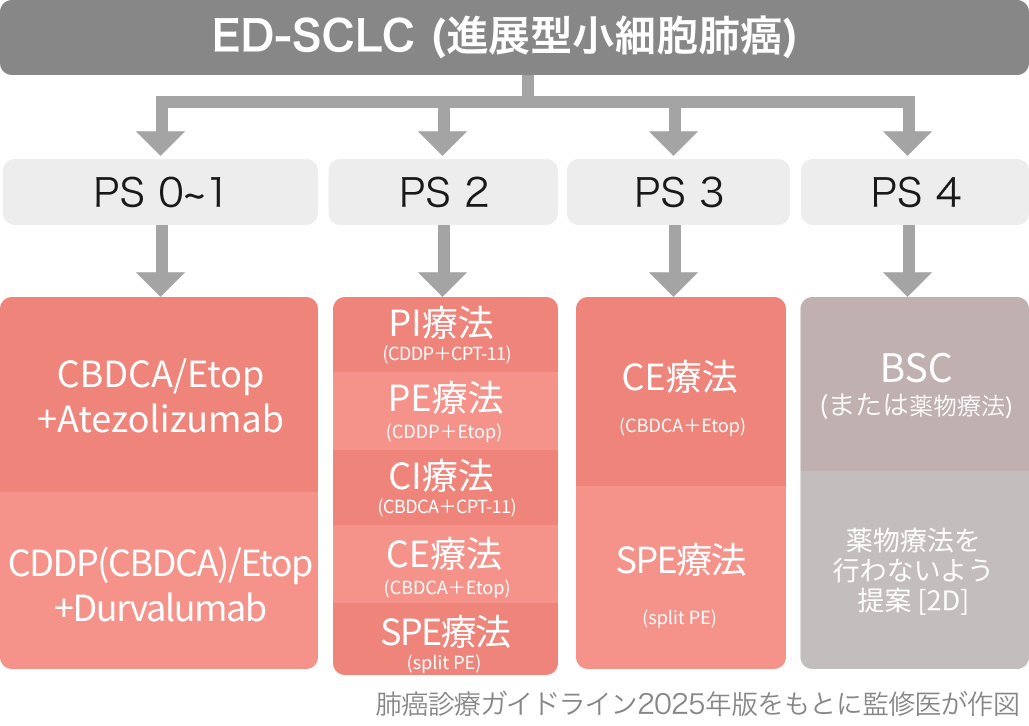
進展型小細胞肺癌 (PS 0-1) には、 プラチナ製剤/エトポシド併用療法+PD-L1阻害薬の併用治療を行うよう強く推奨 (1A)
投与開始前の注意点
- EGFR遺伝子変異やALK融合遺伝子がないことを事前に確認する。
- PD-L1の発現頻度により効果に差がある。
- コンパニオン診断薬については「肺癌患者におけるPD-L1検査の手引き⁴⁾」を参照する。
- CBDCAによるアレルギー既往を確認する。
- PSが0~1が治験時の患者登録基準である。
- 自己免疫疾患、 間質性肺疾患等の既往がある患者はirAEのリスク因子となるため投与前に事前に評価を行う。
- 4コース終了後はPD、 有害事象あるいは臨床上の利益がない状況となるまでアテゾリズマブ単剤での維持療法の継続について判断が必要なことに留意する。
副作用と対策
- 本剤のT細胞活性化作用により、 過度の免疫反応に起因すると考えられる様々な疾患や病態 (irAE) が現れることがある。
- CBDCAとアミノグリコシド系抗菌薬の併用によって聴覚障害や腎毒性が増強する可能性があるため注意。
- 内分泌機能検査 (TSH、 FT4、 ACTHなど) を定期的に実施し、モニタリングする。
- その他尿検査や画像評価などの定期的なモニタリングも必要である。
- 有害事象が疑われた場合には、 各専門医へのコンサルトも検討する。
使用上のワンポイント
ED-SCLCは根治不能であり、 患者のQOL改善と生存期問延長を重視した選択が重要。 PS良好例では、 第一選択として以下の理由から白金製剤併用+ICIが挙がる。 ICIが併用できないときや、間質性肺疾患合併時にはIP療法またはPE療法が候補となる。
IP療法 (CDDP+CPT-11) が標準であった
📊JCOG9511試験
PS0~2の70歳以下を対象として、 IP療法 (CDDP+CPT-11)とPE療法 (CDDP+ETP)と比較した第Ⅲ相試験。 2回目の中間解析で有効中止され、 IP療法が優越性を示した。 OS中央値 : 12.8ヵ月 vs 9.4ヵ月。
その後、白金製剤併用+ICIが標準療法に
📊IMpower133試験
CE療法 +Atezolizumabが、 CE療法に対してOSを優位に延長した。 OS中央値 : 12.3ヵ月 vs 10.3ヵ月。
📊CASPIAN試験
PE/CE療法+Durvalumabが、 PE/CE療法に対してOSを優位に延長した。 OS中央値 : 13.0ヵ月 vs 10.3ヵ月。
ICIそれぞれの併用療法比較
1.維持療法中の投与間隔が異なる
- CASPIAN試験 : Durvalumab 4週
- IMpower133試験 : Atezolizumab 3週
2.CASPIAN試験ではCDDPの使用が可能
直接比較した臨床試験はないが、 いずれの薬剤もPD-L1阻害薬であり、 効果・副作用に関しても同様と考えられる。
出典
1) 中外製薬株式会社. テセントリク®電子添文 (2025年12月改訂 第12版)
2) 中外製薬株式会社. テセントリク®適正使用ガイド (2025年12月改訂)
5) 日本肺癌学会. 肺癌診療ガイドライン-胸膜中皮腫・ 胸腺腫瘍含む-2025年版
最終更新日 : 2026年1月7日
HOKUTO編集部医師監修
Atezolizumab+CBDCA/Etop
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
テセントリク®点滴静注 (アテゾリズマブ)
*中外製薬株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】3週間 (維持療法は3又は4週間)
【催吐性】 中等度催吐性*
【FN発症】低リスク**
*CBDCA併用レジメンは、 CBDCA AUC≧4の場合、 5-HT3受容体拮抗薬、 デキサメタゾン、 NK1受容体拮抗薬を併用
**IMpower133試験のFN発生率1.0%³⁾を基に編集部が分類
1~4コース : 化学療法併用

5コース目以降 : 維持療法

2025年9月19日、 1回1680mgを4週間ごとに点滴静注する用法・用量が追加承認された。
👨⚕️q4wの追加承認により、 単剤療法の利便性が向上した。 一方で、 併用療法においてはq4w投与が未承認である点に留意が必要である。
和歌山県立医科大学附属病院 赤松弘朗先生
Key Data|臨床試験結果
IMpower-133試験³⁾ >>詳しくみる
SCLC患者の初回治療としてCBDCA/Etop+Atezolizumab併用の有効性と安全性を、 プラセボ併用群と比較した国際第Ⅲ相ランダム化比較試験 (201名 vs 202名)
【有効性】CE+Atezolizumab併用群の結果
- ORR 60.2%
- mPFS 5.2ヵ月
- mOS 12.3ヵ月
【安全性】主な有害事象 (括弧内はGrade3~4)
- 貧血 38.9% (14.1%)
- 好中球数減少症 36.4%(23.2%)
- 悪心 31.8% (0.5%)
- 疲労 21.2% (1.5%)
- 食欲不振 20.7% (1.0%)
- 好中球数の減少 17.7% (14.1%)
- 血小板減少症 16.2% (10.1%)
👨⚕️監修医師コメント : アテゾリズマブとデュルバルマブで有効性および安全性に大きな差はない。 デュルバルマブはCDDPでも使用可能、 3-4週毎で投与可能な点が異なる。
>>Durvalumab併用 (CASPIAN試験)はこちら
プロトコル
IMpower133試験のプロトコル³⁾⁴⁾より引用
投与開始基準例
- 好中球≧1500/mm³ - リンパ球≧500/mm³
- 血小板≧10万/mm³ - Hb≧9.0g/dL
- AST / ALT / ALP ≦2.5×正常域上限(ULN)
- 血清Bil≦1.25×ULN - 血清Cre≦1.5×ULN
- INR 又はAPTT≦1.5×ULN
N Engl J Med. 2018 Dec 6;379(23):2220-2229. より引用
休薬・減量・中止基準例
非血液毒性 : ベースライン値以下 (又は Grade 1以下) に回復するまで、 最長63日間休薬
血液毒性 : 好中球≧1,500/mm³かつ血小板≧10万/mm³に回復するまで、 最長63日間休薬
N Engl J Med. 2018 Dec 6;379(23):2220-2229. より引用
再開・中止基準
一度減量した場合、 用量を100%に増量することはできない (以下の表参照)。 2回の減量後にGrade 3又は4の毒性が発現した場合、 もしくは毒性のために63日間を超えて投与を延期した場合は投与を中止すること。

N Engl J Med. 2018 Dec 6;379(23):2220-2229. より引用
レジメンの特徴と注意点
肺癌診療ガイドライン2025の推奨⁵⁾

進展型小細胞肺癌 (PS 0-1) には、 プラチナ製剤/エトポシド併用療法+PD-L1阻害薬の併用治療を行うよう強く推奨 (1A)
投与開始前の注意点
- EGFR遺伝子変異やALK融合遺伝子がないことを事前に確認する。
- PD-L1の発現頻度により効果に差がある。
- コンパニオン診断薬については「肺癌患者におけるPD-L1検査の手引き⁴⁾」を参照する。
- CBDCAによるアレルギー既往を確認する。
- PSが0~1が治験時の患者登録基準である。
- 自己免疫疾患、 間質性肺疾患等の既往がある患者はirAEのリスク因子となるため投与前に事前に評価を行う。
- 4コース終了後はPD、 有害事象あるいは臨床上の利益がない状況となるまでアテゾリズマブ単剤での維持療法の継続について判断が必要なことに留意する。
副作用と対策
- 本剤のT細胞活性化作用により、 過度の免疫反応に起因すると考えられる様々な疾患や病態 (irAE) が現れることがある。
- CBDCAとアミノグリコシド系抗菌薬の併用によって聴覚障害や腎毒性が増強する可能性があるため注意。
- 内分泌機能検査 (TSH、 FT4、 ACTHなど) を定期的に実施し、モニタリングする。
- その他尿検査や画像評価などの定期的なモニタリングも必要である。
- 有害事象が疑われた場合には、 各専門医へのコンサルトも検討する。
使用上のワンポイント
ED-SCLCは根治不能であり、 患者のQOL改善と生存期問延長を重視した選択が重要。 PS良好例では、 第一選択として以下の理由から白金製剤併用+ICIが挙がる。 ICIが併用できないときや、間質性肺疾患合併時にはIP療法またはPE療法が候補となる。
IP療法 (CDDP+CPT-11) が標準であった
📊JCOG9511試験
PS0~2の70歳以下を対象として、 IP療法 (CDDP+CPT-11)とPE療法 (CDDP+ETP)と比較した第Ⅲ相試験。 2回目の中間解析で有効中止され、 IP療法が優越性を示した。 OS中央値 : 12.8ヵ月 vs 9.4ヵ月。
その後、白金製剤併用+ICIが標準療法に
📊IMpower133試験
CE療法 +Atezolizumabが、 CE療法に対してOSを優位に延長した。 OS中央値 : 12.3ヵ月 vs 10.3ヵ月。
📊CASPIAN試験
PE/CE療法+Durvalumabが、 PE/CE療法に対してOSを優位に延長した。 OS中央値 : 13.0ヵ月 vs 10.3ヵ月。
ICIそれぞれの併用療法比較
1.維持療法中の投与間隔が異なる
- CASPIAN試験 : Durvalumab 4週
- IMpower133試験 : Atezolizumab 3週
2.CASPIAN試験ではCDDPの使用が可能
直接比較した臨床試験はないが、 いずれの薬剤もPD-L1阻害薬であり、 効果・副作用に関しても同様と考えられる。
出典
1) 中外製薬株式会社. テセントリク®電子添文 (2025年12月改訂 第12版)
2) 中外製薬株式会社. テセントリク®適正使用ガイド (2025年12月改訂)
5) 日本肺癌学会. 肺癌診療ガイドライン-胸膜中皮腫・ 胸腺腫瘍含む-2025年版
最終更新日 : 2026年1月7日
HOKUTO編集部医師監修
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。