Nivo:Nivolumab(オプジーボ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 240mg/body 点滴 | 1~ | Day1 |
L-OHP:Oxaliplatin(エルプラット®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 85mg/m² 点滴 | 1~ | Day1 |
l-LV:levofolinate(アイソボリン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg/m² 点滴 | 1~ | Day1 |
5-FU: Fluorouracil(フルオロウラシル®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 400mg/m² 急速静注 | 1~ | Day1 |
| 2,400mg/m² 持続静注 | 1~ | Day1~3 |
その他
| 1コース14日間 |
| オキサリプラチン+レボホリナート+フルオロウラシルをFOLFOX療法と呼ぶ。 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*小野薬品工業株式会社の外部サイトへ遷移します
用法用量
CheckMate 649試験⁶⁾のプロトコル
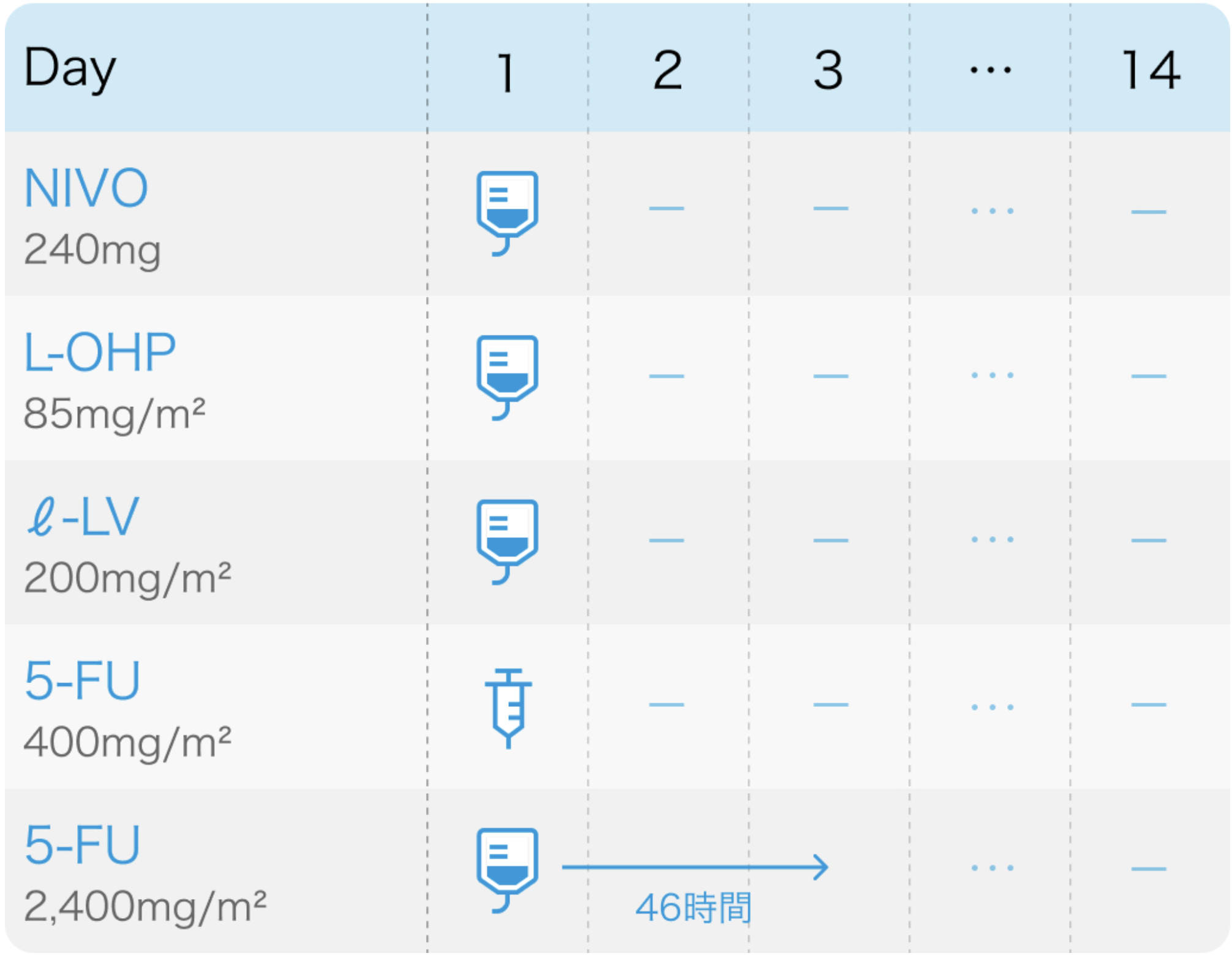
Lancet. 2021 Jul 3;398(10294):27-40⁶⁾より作図
前投薬
5-HT3受容体拮抗薬+デキサメタゾンday1-3
CINVリスク因子保有症例はNK1受容体拮抗薬の併用を考慮
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
投与開始基準
CheckMate 649試験⁶⁾のプロトコル
FOLFOX + Nivoの開始基準

Lancet. 2021 Jul 3;398(10294):27-40⁶⁾より作図
Nivoの投与延期・再開基準
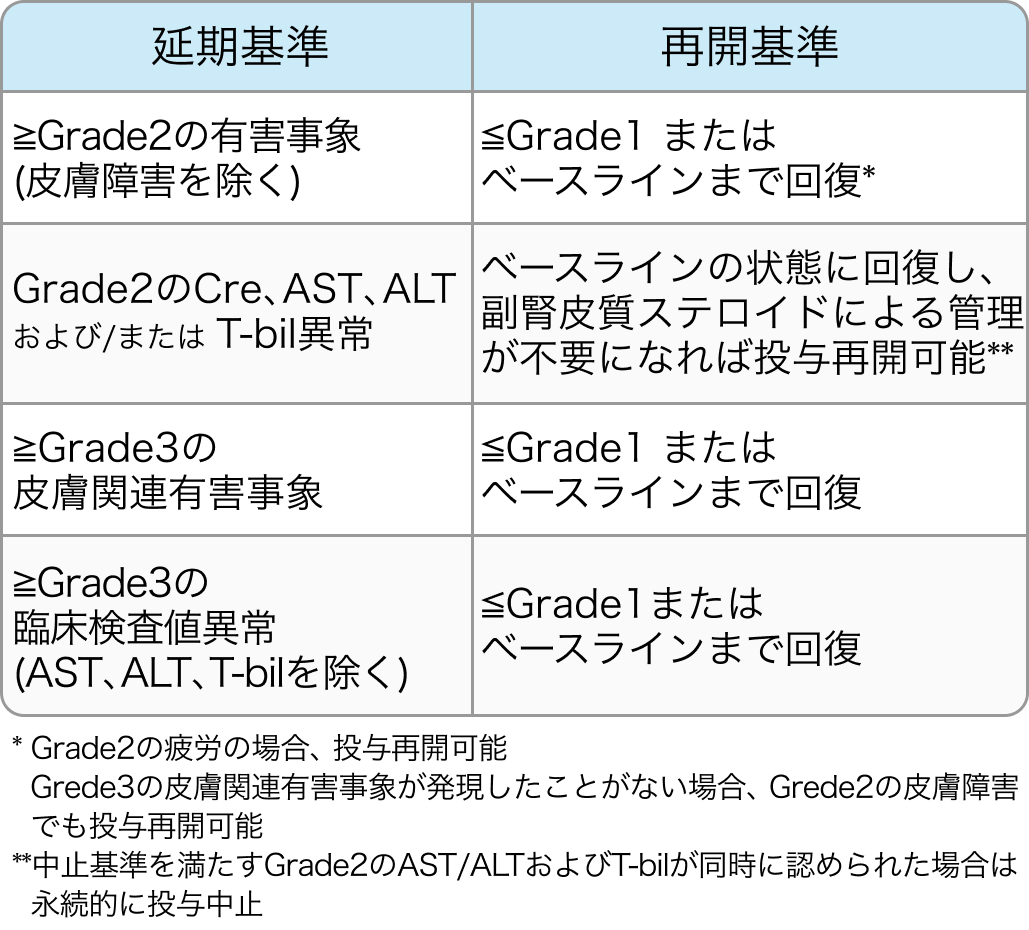
Lancet. 2021 Jul 3;398(10294):27-40⁶⁾より作図
減量基準
CheckMate 649試験⁶⁾のプロトコル
FOLFOX基準
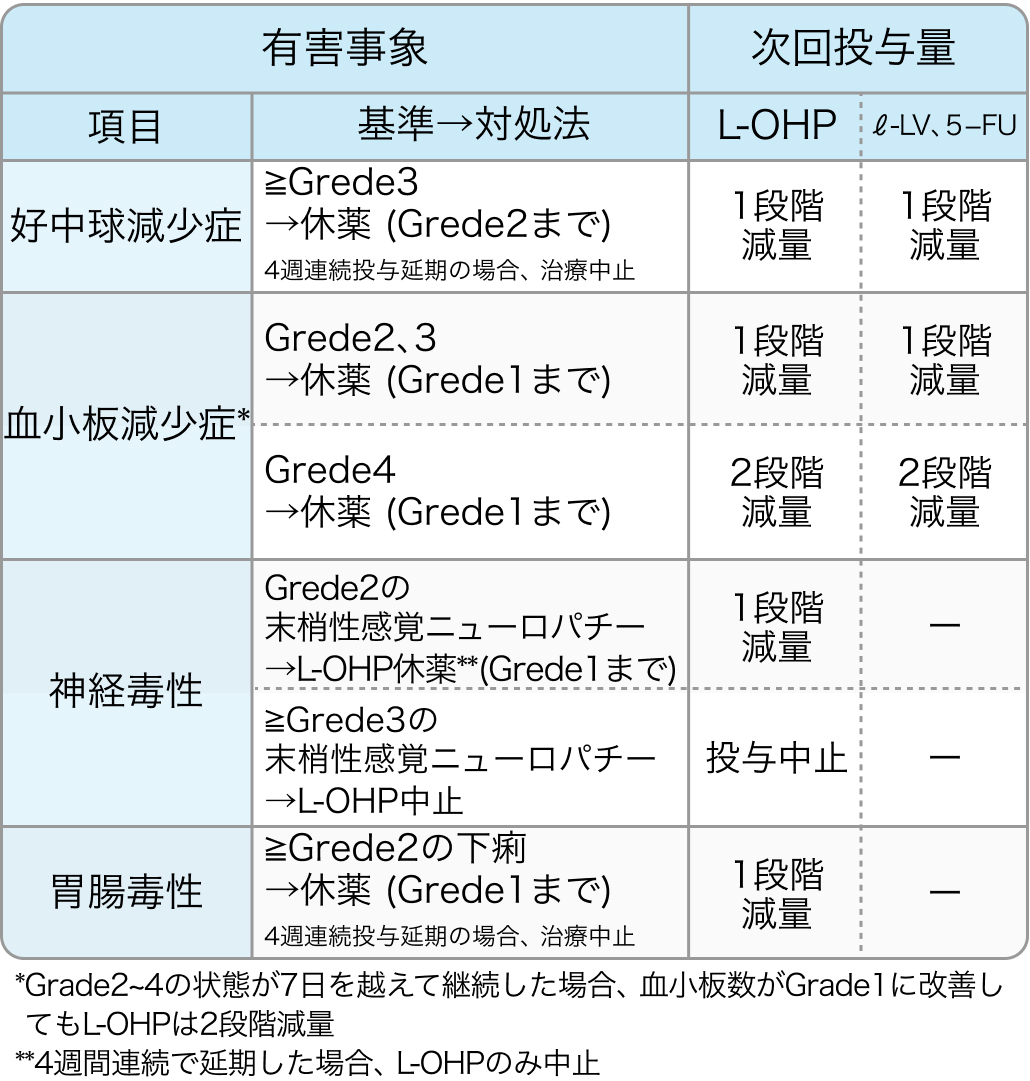
Lancet. 2021 Jul 3;398(10294):27-40⁶⁾より作図
初回基準量と減量レベル

Lancet. 2021 Jul 3;398(10294):27-40⁶⁾より作図
中止基準
CheckMate 649試験⁶⁾のプロトコル
Nivoの基準
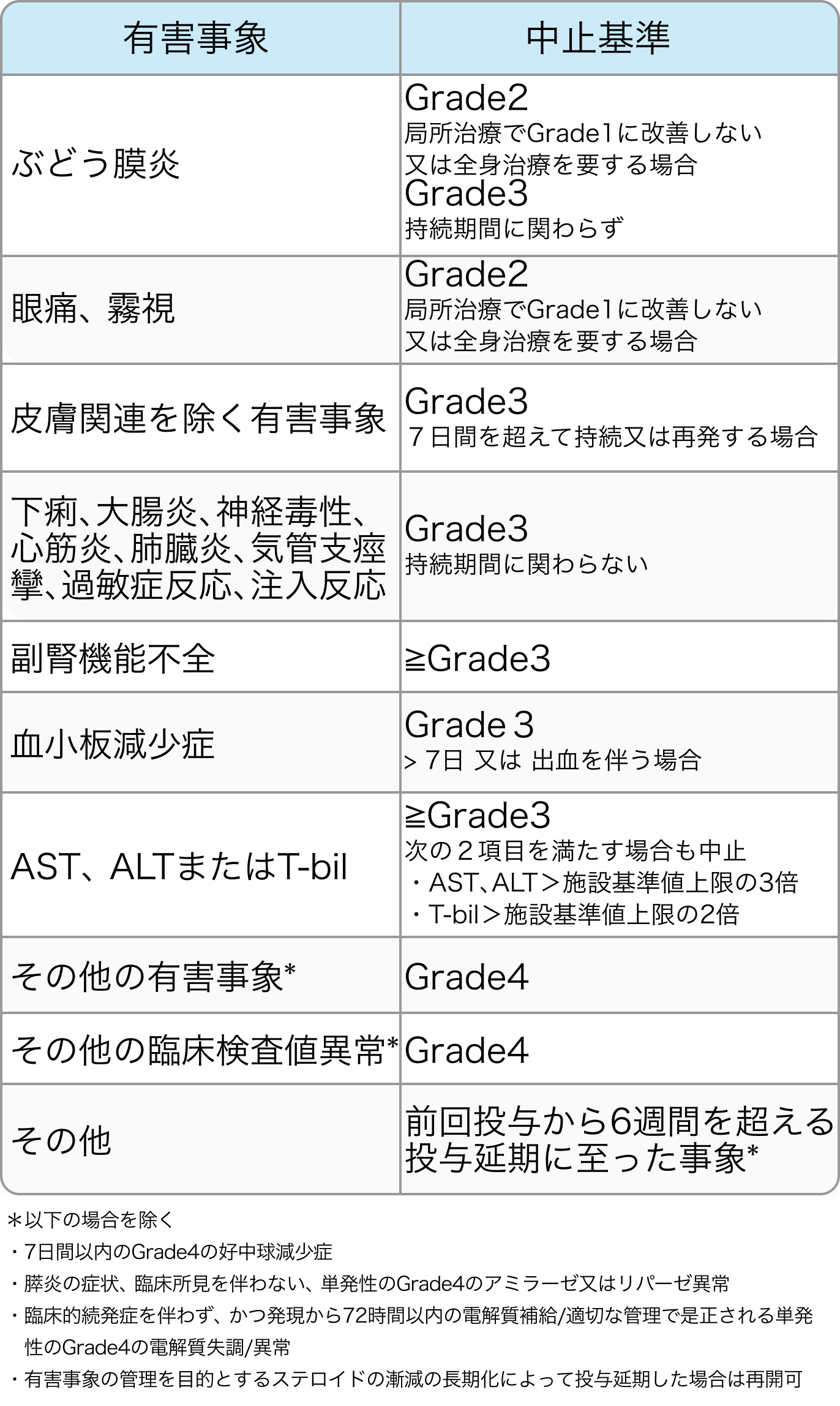
Lancet. 2021 Jul 3;398(10294):27-40⁶⁾より作図
FOLFOXの基準
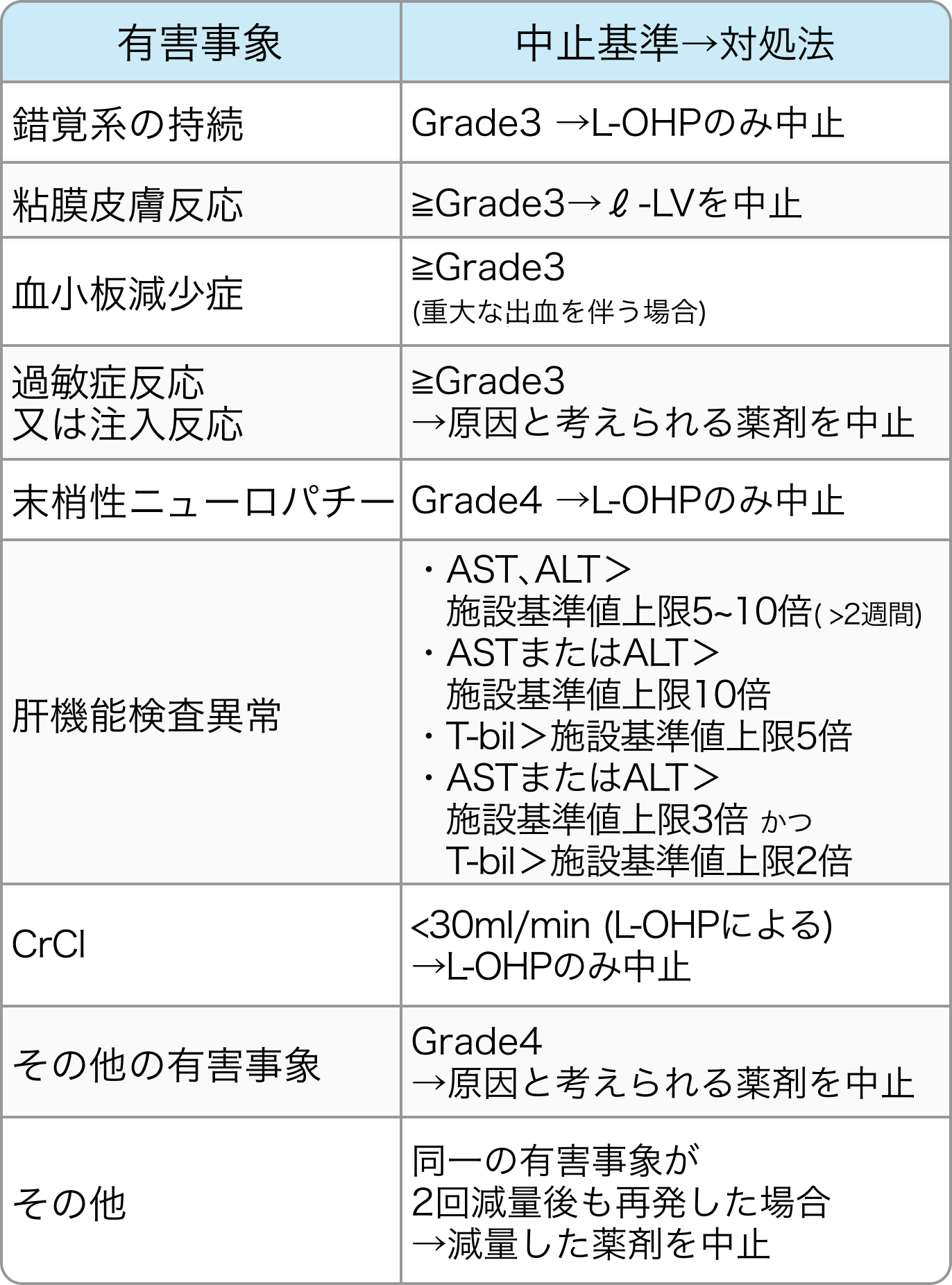
Lancet. 2021 Jul 3;398(10294):27-40⁶⁾より作図
主な有害事象
CheckMate 649試験⁶⁾
主な有害事象 (カッコ内はGrade3~4)
- 悪心 41.3% (2.6%)
- 下痢 32.4% (4.5%)
- 嘔吐 24.9% (2.2%)
- 好中球数減少 20.2% (10.6%)
- 血小板数減少 19.9% (2.6%)
- 白血球数減少 14.3% (2.9%)
- 貧血 26.0% (6.0%)
- 好中球減少症 24.4% (15.1%)
- 血小板減少症 20.1% (2.4%)
- 疲労 25.8% (3.8%)
- 食欲減退 20.1% (1.8%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 末梢性ニューロパチー 28.3% (4.0%)
- 末梢性感覚ニューロパチー 17.5% (2.0%)
- 手掌・足底発赤知覚不全症候群 12.0% (1.4%)
Lancet. 2021 Jul 3;398(10294):27-40⁶⁾より引用
特徴と注意点
HER2陰性胃癌1次治療の選択肢
ガイドラインでは、 HER2陰性胃癌1次治療において 「推奨される化学療法レジメン」である。
胃癌は治療開始時にすでに体重減少を伴っていることが多く、 狭窄・腹膜播種など催吐リスクが高い。 経口フッ化ピリジン内服が困難でFOLFOXを選択した場合は特に、 CINV予防として3剤併用 (NK1拮抗薬 + 5HT3拮抗薬+ステロイド) ないしは4剤併用 (NK1拮抗薬 + 5HT3拮抗薬 + ステロイド + オランザピン) を考慮する。
CIPNによる治療制限と管理
オキサリプラチンによるCIPNにより、 2次治療のPTX投与が困難になる時がある。治療効果が十分と考えられ、 CIPN Grade2となった場合は、 オキサリプラチンの中止を考慮する。 上記を考慮しオキサリプラチンについては計画中止も治療選択肢と考えられる。 海外の実臨床や臨床試験アームから考えるに、 8-12コースでの投与終了も選択肢となる。
肝・腎機能低下患者へのFOLFOXの適用
肝・腎機能低下で投与制限を受ける経口フッ化ピリミジンより使用しやすい。 FOLFOXは高度腹膜播種を有する胃癌でも使用可能であり、 同対象に対するWJOG10517G試験の結果から腹水制御も期待される。 現在では同対象に対するWJOG16322G試験が進行中である。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
関連する臨床試験
CheckMate 649試験⁶⁾
切除不能進行・再発胃/食道胃接合部/食道腺癌の1次治療における標準化学療法 (FOLFOX/CAPOX) に対するNivolumab+化学療法および、 Nivolumab+Ipilimumab併用療法の優越性を検証した無作為化オープンラベル比較第III相試験。 アジア (主に中国) 、 欧州、 オーストラリア、 北米、 南米の29ヵ国が参加して検証した。
Lancet. 2021 Jul 3;398(10294):27-40.
出典
- 協和キリン株式会社. 5-FU®電子添文 (2024年6月改訂 第4版) [最終閲覧 : 2024/7/12]
- ヤクルト本社. エルプラット®電子添文 (2024年4月改訂 第4版) [最終閲覧 : 2024/7/12]
- ファイザー・ファーマ株式会社. アイソボリン®電子添文 (2023年3月改訂 第1版) [最終閲覧 : 2024/7/12]
- 小野薬品工業株式会社. オプジーボ®電子添文 (2024年2月改訂第20版) [最終閲覧 : 2024/7/12]
- 小野薬品工業株式会社. オプジーボ®適正使用ガイド (2024年2月作成) [最終閲覧 : 2024/7/12]
- First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial. Lancet. 2021 Jul 3;398(10294):27-40. PMID: 34102137
最終更新日 : 2024年8月21日
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
FOLFOX + Nivo
Nivo:Nivolumab(オプジーボ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 240mg/body 点滴 | 1~ | Day1 |
L-OHP:Oxaliplatin(エルプラット®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 85mg/m² 点滴 | 1~ | Day1 |
l-LV:levofolinate(アイソボリン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg/m² 点滴 | 1~ | Day1 |
5-FU: Fluorouracil(フルオロウラシル®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 400mg/m² 急速静注 | 1~ | Day1 |
| 2,400mg/m² 持続静注 | 1~ | Day1~3 |
その他
| 1コース14日間 |
| オキサリプラチン+レボホリナート+フルオロウラシルをFOLFOX療法と呼ぶ。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*小野薬品工業株式会社の外部サイトへ遷移します
用法用量
CheckMate 649試験⁶⁾のプロトコル

Lancet. 2021 Jul 3;398(10294):27-40⁶⁾より作図
前投薬
5-HT3受容体拮抗薬+デキサメタゾンday1-3
CINVリスク因子保有症例はNK1受容体拮抗薬の併用を考慮
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
投与開始基準
CheckMate 649試験⁶⁾のプロトコル
FOLFOX + Nivoの開始基準

Lancet. 2021 Jul 3;398(10294):27-40⁶⁾より作図
Nivoの投与延期・再開基準

Lancet. 2021 Jul 3;398(10294):27-40⁶⁾より作図
減量基準
CheckMate 649試験⁶⁾のプロトコル
FOLFOX基準

Lancet. 2021 Jul 3;398(10294):27-40⁶⁾より作図
初回基準量と減量レベル

Lancet. 2021 Jul 3;398(10294):27-40⁶⁾より作図
中止基準
CheckMate 649試験⁶⁾のプロトコル
Nivoの基準

Lancet. 2021 Jul 3;398(10294):27-40⁶⁾より作図
FOLFOXの基準

Lancet. 2021 Jul 3;398(10294):27-40⁶⁾より作図
主な有害事象
CheckMate 649試験⁶⁾
主な有害事象 (カッコ内はGrade3~4)
- 悪心 41.3% (2.6%)
- 下痢 32.4% (4.5%)
- 嘔吐 24.9% (2.2%)
- 好中球数減少 20.2% (10.6%)
- 血小板数減少 19.9% (2.6%)
- 白血球数減少 14.3% (2.9%)
- 貧血 26.0% (6.0%)
- 好中球減少症 24.4% (15.1%)
- 血小板減少症 20.1% (2.4%)
- 疲労 25.8% (3.8%)
- 食欲減退 20.1% (1.8%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 末梢性ニューロパチー 28.3% (4.0%)
- 末梢性感覚ニューロパチー 17.5% (2.0%)
- 手掌・足底発赤知覚不全症候群 12.0% (1.4%)
Lancet. 2021 Jul 3;398(10294):27-40⁶⁾より引用
特徴と注意点
HER2陰性胃癌1次治療の選択肢
ガイドラインでは、 HER2陰性胃癌1次治療において 「推奨される化学療法レジメン」である。
胃癌は治療開始時にすでに体重減少を伴っていることが多く、 狭窄・腹膜播種など催吐リスクが高い。 経口フッ化ピリジン内服が困難でFOLFOXを選択した場合は特に、 CINV予防として3剤併用 (NK1拮抗薬 + 5HT3拮抗薬+ステロイド) ないしは4剤併用 (NK1拮抗薬 + 5HT3拮抗薬 + ステロイド + オランザピン) を考慮する。
CIPNによる治療制限と管理
オキサリプラチンによるCIPNにより、 2次治療のPTX投与が困難になる時がある。治療効果が十分と考えられ、 CIPN Grade2となった場合は、 オキサリプラチンの中止を考慮する。 上記を考慮しオキサリプラチンについては計画中止も治療選択肢と考えられる。 海外の実臨床や臨床試験アームから考えるに、 8-12コースでの投与終了も選択肢となる。
肝・腎機能低下患者へのFOLFOXの適用
肝・腎機能低下で投与制限を受ける経口フッ化ピリミジンより使用しやすい。 FOLFOXは高度腹膜播種を有する胃癌でも使用可能であり、 同対象に対するWJOG10517G試験の結果から腹水制御も期待される。 現在では同対象に対するWJOG16322G試験が進行中である。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
関連する臨床試験
CheckMate 649試験⁶⁾
切除不能進行・再発胃/食道胃接合部/食道腺癌の1次治療における標準化学療法 (FOLFOX/CAPOX) に対するNivolumab+化学療法および、 Nivolumab+Ipilimumab併用療法の優越性を検証した無作為化オープンラベル比較第III相試験。 アジア (主に中国) 、 欧州、 オーストラリア、 北米、 南米の29ヵ国が参加して検証した。
Lancet. 2021 Jul 3;398(10294):27-40.
出典
- 協和キリン株式会社. 5-FU®電子添文 (2024年6月改訂 第4版) [最終閲覧 : 2024/7/12]
- ヤクルト本社. エルプラット®電子添文 (2024年4月改訂 第4版) [最終閲覧 : 2024/7/12]
- ファイザー・ファーマ株式会社. アイソボリン®電子添文 (2023年3月改訂 第1版) [最終閲覧 : 2024/7/12]
- 小野薬品工業株式会社. オプジーボ®電子添文 (2024年2月改訂第20版) [最終閲覧 : 2024/7/12]
- 小野薬品工業株式会社. オプジーボ®適正使用ガイド (2024年2月作成) [最終閲覧 : 2024/7/12]
- First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial. Lancet. 2021 Jul 3;398(10294):27-40. PMID: 34102137
最終更新日 : 2024年8月21日
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。

