治療スケジュール
概要
監修医師
Valemetostat:バレメトスタット(エザルミア®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg 1日1回 経口 (空腹時) | 1~ | Day 1~ |
その他
| 強いCYP3A阻害剤やP糖蛋白阻害剤との併用時は用量調節を行う (概要欄参照) |
| 副作用発現時は、 休薬、 減量又は中止 (概要欄参照) |
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*「第一三共株式会社」 の外部サイトへ遷移します.
主な有害事象
VALENTINE-PTCL01試験²⁾より引用.
骨髄抑制
- 血小板減少症 (49.6%、 ≧Grade3 23.3%)
- 貧血 (35.3%、 ≧Grade3 18.8%)
- 好中球減少 (26.3%、 ≧Grade3 17.3%)
主な有害事象
- 下痢 (29.3%、 ≧Grade3 3.8%)
- 味覚障害 (28.6%、 ≧Grade3 0%)
- COVID-19 (21.1%、 ≧Grade3 3%)
- 吐気 (17.3%、 ≧Grade3 0.8%)
- 咳嗽 (15%、 ≧Grade3 0%)
- 発熱 (15%、 ≧Grade3 0%)
- 食欲減退 (14.3%、 ≧Grade3 1.5%)
- 倦怠感 (14.3%、 ≧Grade3 1.5%)
- 無力症 (12.8%、 ≧Grade3 3%)
- 末梢浮腫 (12%、 ≧Grade3 0.8%)
- 搔痒 (12%、 ≧Grade3 0%)
- 脱毛症 (10.5%、 ≧Grade3 0%)
- AST上昇 (10.5%、 ≧Grade3 0.8%)
特徴と注意点
- 本剤はエピジェネティクス*領域の低分子医薬品で、 EZH1及び2を選択的に阻害する.
*DNA配列の変化を伴わない遺伝子発現変化を誘導する分子メカニズム
- EZH1及びEZH2は、 多くの血液がんで発現しているヒストンメチル化酵素 (H3K27トリメチル化酵素)であり、 がん抑制遺伝子の不活性化に関係.
- 末梢性T細胞リンパ腫 (PTCL) は多剤併用化学療法が一般的であるが、再発難治例に対して、本剤は選択肢の一つとなりうる.
- 食後投与はCmax及びAUC低下の報告があるため、 空腹時に投与 (食事の1時間前から食後2時間までの間の服用は避ける).
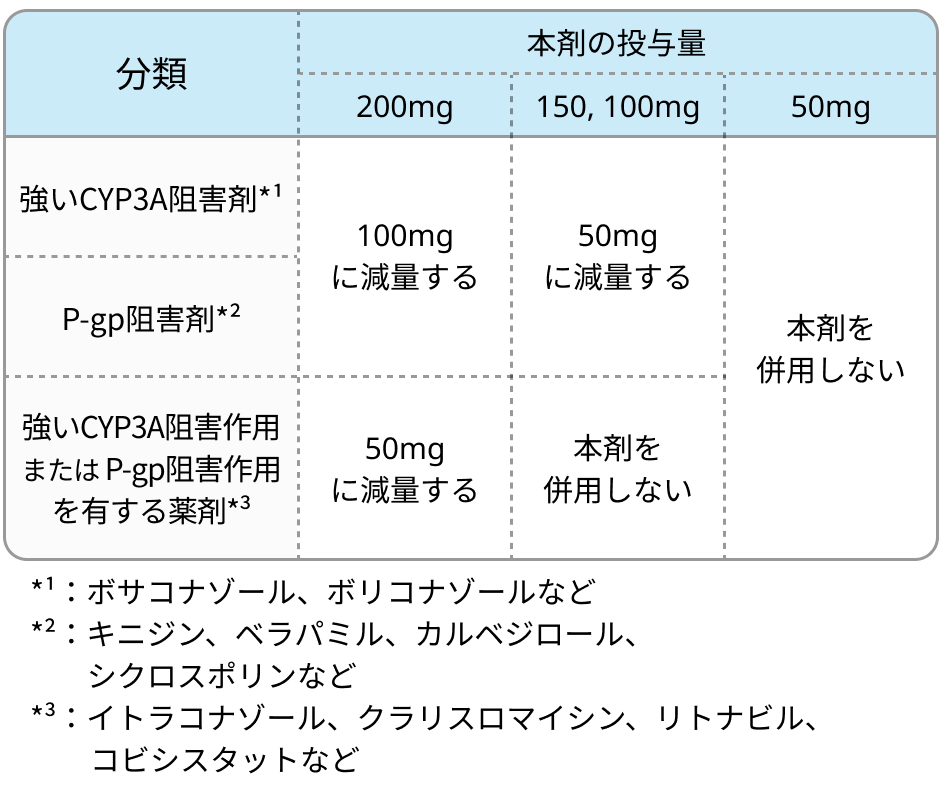
- 本剤の血中濃度上昇リスクとなるため、 強いCYP3A阻害薬やP糖蛋白 (P-gp) 阻害薬との併用に注意.
- 動物実験において、 胚・胎児毒性 (着床後胚損失率の高値) 及び催奇形性の報告あり、 最終投与後一定期間は適切な避妊を行うよう指導.
CYP3A阻害剤やP-gp阻害剤と併用時の用量調節
感染対策
- ニューモシスチス・イロベチイ:ST合剤及び同等の効能/効果を有する薬剤による予防投与を推奨.
- その他の感染症 (HBV、 CMV、 VZV、 結核):U202試験¹⁾では規定なし. 担当医の判断で検討.
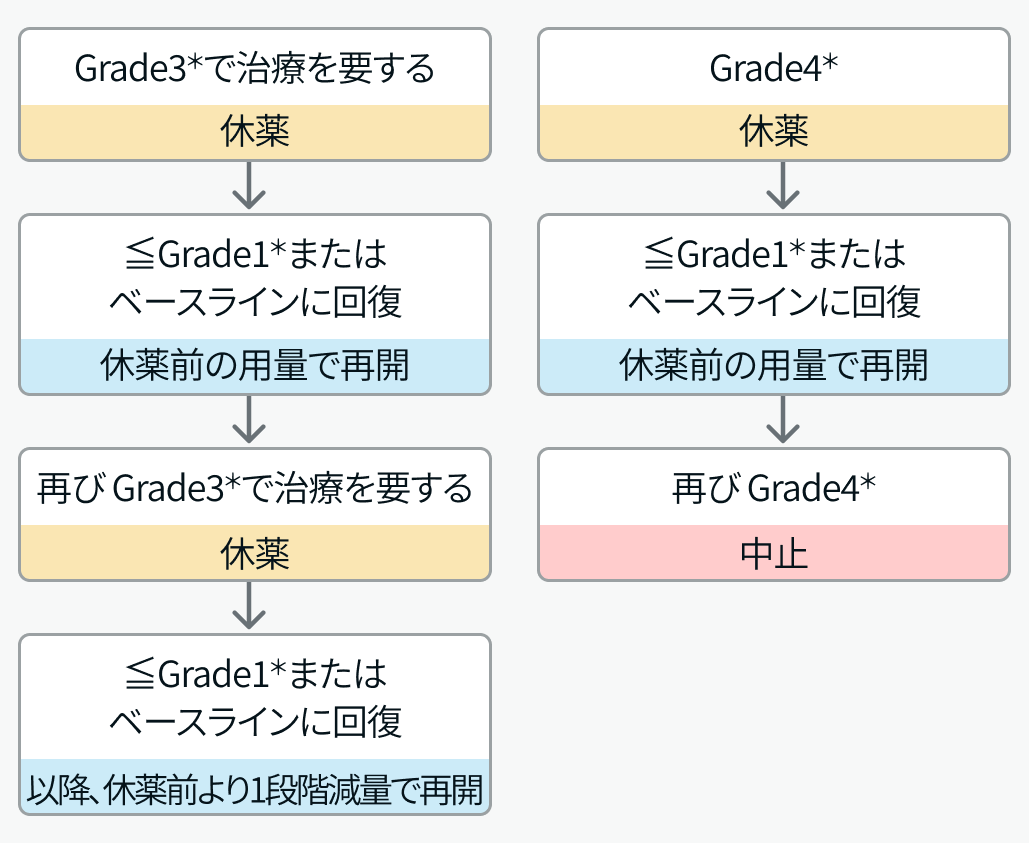
副作用と対策
いずれもGradeはNCI-CTCAEに準じる。
エザルミア 適正使用ガイドをもとに編集部作図。
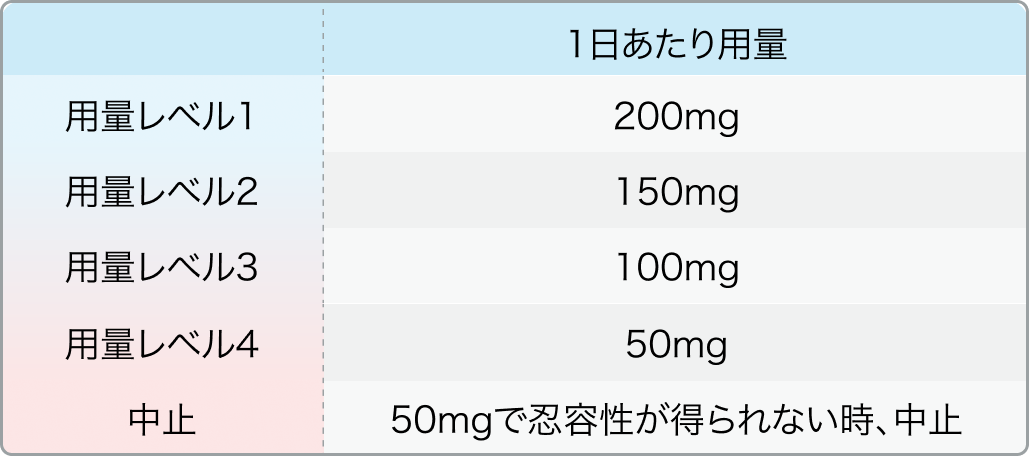
▼用量レベル
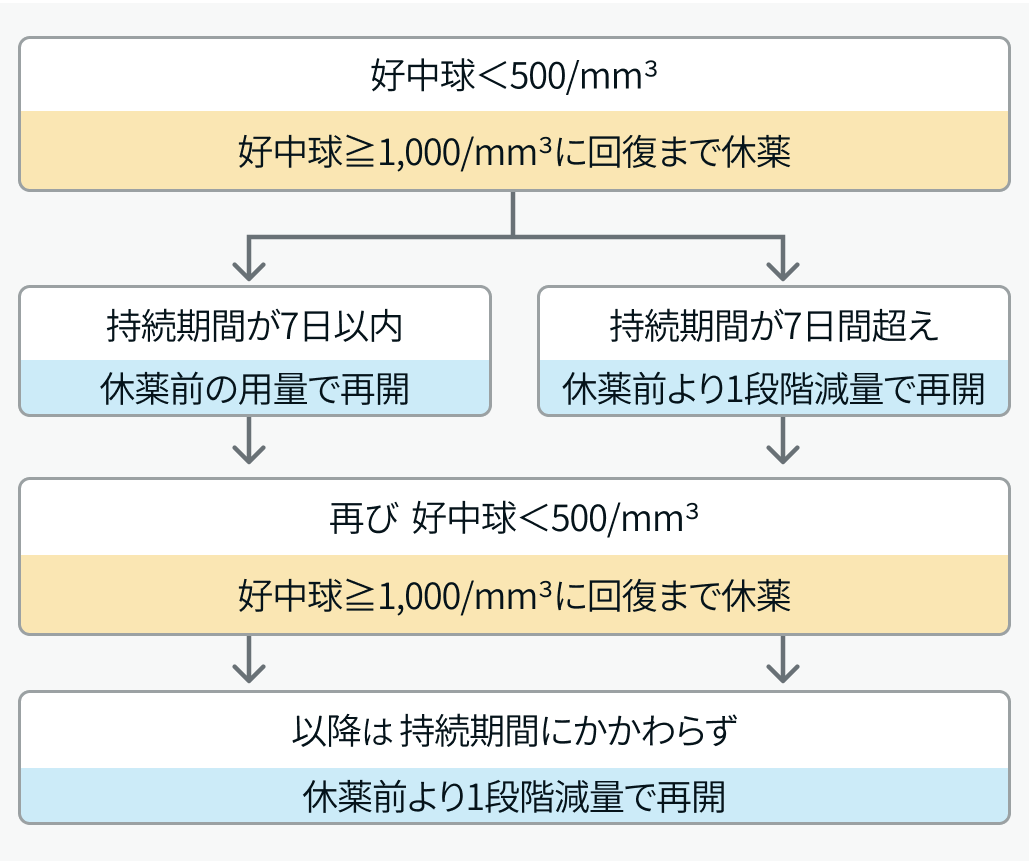
▼好中球数減少
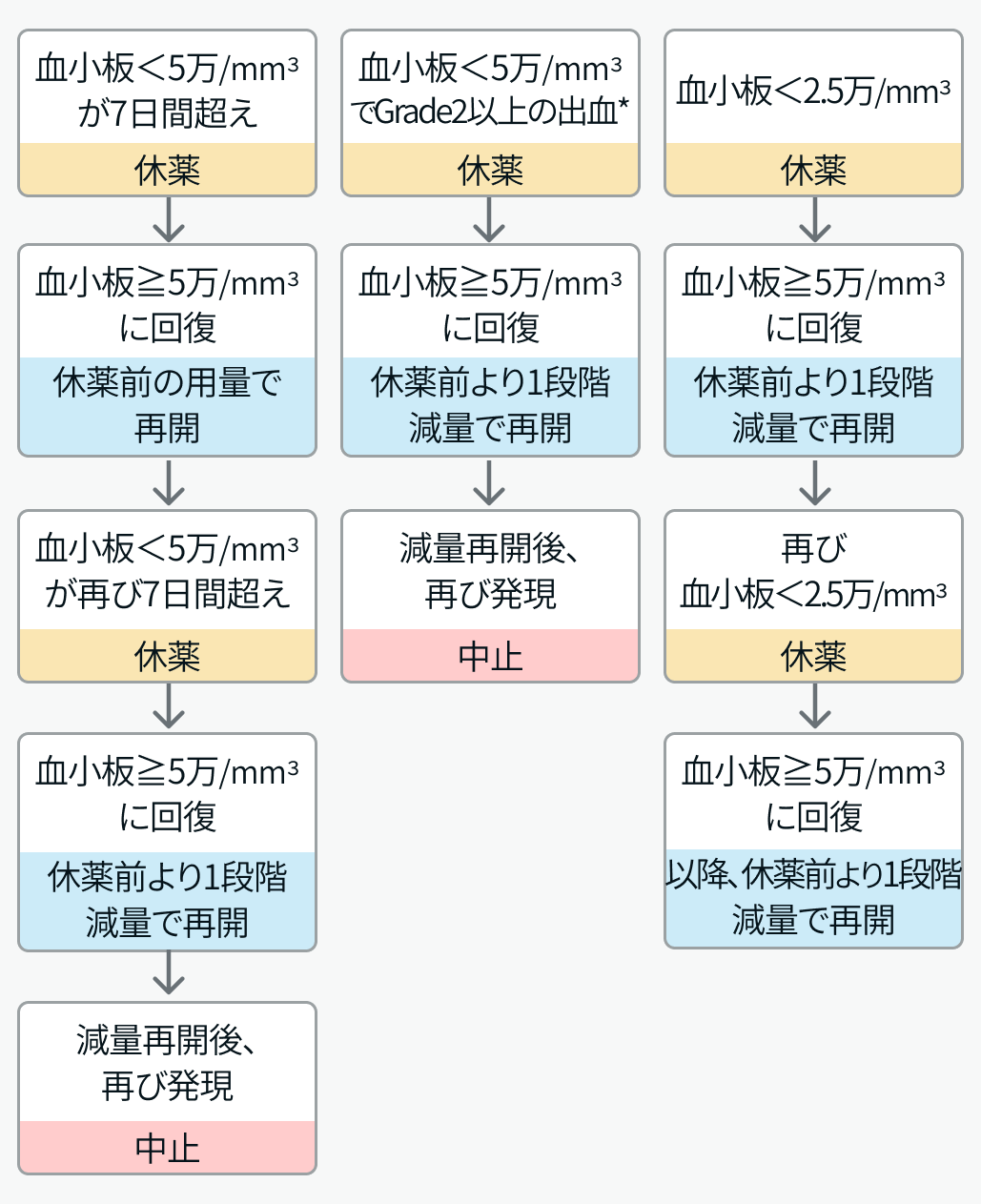
▼血小板減少
▼貧血

▼非血液毒性
関連する臨床試験の結果
VALENTINE-PTCL01試験²⁾
本試験は成人T細胞白血病リンパ腫コホートも含むがPTCLコホートのみ記載.
概要
- 国際共同第2相試験
- 対象:18歳以上の再発又は難治性のPTCL患者133例
- 方法:疾患が進行するか、 許容できない毒性が現れるまでバレメトスタット1日200mgを連日投与.
- 主要評価項目:ORR (CR+PR)
- 副次評価項目: DOR、 薬物動態、 安全性
ORR:全奏効率 CR:完全奏効 PR:部分奏功 DOR:奏効期間
結果
- 有効性評価対象患者は119例.
- ORR:44% (95%CI 35-53). 内訳:CR 14%、 PR 29%.
- DOR中央値:11.9ヵ月 (95%CI 7.8-NE).
- 奏効までの期間中央値:8.1週 (IQR 7.9-8.3).
- PFS中央値:5.5ヵ月 (95%CI 3.5-8.3).
- 推定OS中央値:17.0ヵ月 (95%CI 13.5-NE).
- 安全性解析対象133例のうち、 96.2%がGradeを問わず1つ以上の治療上緊急の有害事象を発現し、 57.9%がGrade3以上を経験した.
- Grade3以上の有害事象:血小板減少 23%、 貧血 19%、 好中球減少症 17%、 下痢 4%、
- 重篤な治療関連有害事象:7%.
- 血液毒性以外の主な有害事象 (全Grade):下痢 30%、 味覚不全 29%.
- 有害事象による投与変更:中断 50%、 減量 16%、 中止 10%.
- サブタイプ毎のORR:AITL 54.8%、 PTCL-NOS 31.7%、 ALCL 33.3%、 PTCL-TFH 50.0% (詳細はSupplementary appendixのp13参照).
結論
- バレメトスタットは、 再発又は難治性のPTCL患者において、 管理可能な安全性プロファイルとともに、 持続的な奏効を示した.
参考文献
最終更新:2024年12月16日
執筆担当:牛久愛和総合病院薬剤センタ- 秋場孝則
監修医師:東海大学血液腫瘍内科 扇屋大輔
Valemetostat
バレメトスタット(エザルミア®)
2024年12月16日更新
Valemetostat:バレメトスタット(エザルミア®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg 1日1回 経口 (空腹時) | 1~ | Day 1~ |
その他
| 強いCYP3A阻害剤やP糖蛋白阻害剤との併用時は用量調節を行う (概要欄参照) |
| 副作用発現時は、 休薬、 減量又は中止 (概要欄参照) |
概要
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*「第一三共株式会社」 の外部サイトへ遷移します.
主な有害事象
VALENTINE-PTCL01試験²⁾より引用.
骨髄抑制
- 血小板減少症 (49.6%、 ≧Grade3 23.3%)
- 貧血 (35.3%、 ≧Grade3 18.8%)
- 好中球減少 (26.3%、 ≧Grade3 17.3%)
主な有害事象
- 下痢 (29.3%、 ≧Grade3 3.8%)
- 味覚障害 (28.6%、 ≧Grade3 0%)
- COVID-19 (21.1%、 ≧Grade3 3%)
- 吐気 (17.3%、 ≧Grade3 0.8%)
- 咳嗽 (15%、 ≧Grade3 0%)
- 発熱 (15%、 ≧Grade3 0%)
- 食欲減退 (14.3%、 ≧Grade3 1.5%)
- 倦怠感 (14.3%、 ≧Grade3 1.5%)
- 無力症 (12.8%、 ≧Grade3 3%)
- 末梢浮腫 (12%、 ≧Grade3 0.8%)
- 搔痒 (12%、 ≧Grade3 0%)
- 脱毛症 (10.5%、 ≧Grade3 0%)
- AST上昇 (10.5%、 ≧Grade3 0.8%)
特徴と注意点
- 本剤はエピジェネティクス*領域の低分子医薬品で、 EZH1及び2を選択的に阻害する.
*DNA配列の変化を伴わない遺伝子発現変化を誘導する分子メカニズム
- EZH1及びEZH2は、 多くの血液がんで発現しているヒストンメチル化酵素 (H3K27トリメチル化酵素)であり、 がん抑制遺伝子の不活性化に関係.
- 末梢性T細胞リンパ腫 (PTCL) は多剤併用化学療法が一般的であるが、再発難治例に対して、本剤は選択肢の一つとなりうる.
- 食後投与はCmax及びAUC低下の報告があるため、 空腹時に投与 (食事の1時間前から食後2時間までの間の服用は避ける).
- 本剤の血中濃度上昇リスクとなるため、 強いCYP3A阻害薬やP糖蛋白 (P-gp) 阻害薬との併用に注意.
- 動物実験において、 胚・胎児毒性 (着床後胚損失率の高値) 及び催奇形性の報告あり、 最終投与後一定期間は適切な避妊を行うよう指導.
CYP3A阻害剤やP-gp阻害剤と併用時の用量調節

感染対策
- ニューモシスチス・イロベチイ:ST合剤及び同等の効能/効果を有する薬剤による予防投与を推奨.
- その他の感染症 (HBV、 CMV、 VZV、 結核):U202試験¹⁾では規定なし. 担当医の判断で検討.
副作用と対策
いずれもGradeはNCI-CTCAEに準じる。
エザルミア 適正使用ガイドをもとに編集部作図。
▼用量レベル

▼好中球数減少

▼血小板減少

▼貧血

▼非血液毒性

関連する臨床試験の結果
VALENTINE-PTCL01試験²⁾
本試験は成人T細胞白血病リンパ腫コホートも含むがPTCLコホートのみ記載.
概要
- 国際共同第2相試験
- 対象:18歳以上の再発又は難治性のPTCL患者133例
- 方法:疾患が進行するか、 許容できない毒性が現れるまでバレメトスタット1日200mgを連日投与.
- 主要評価項目:ORR (CR+PR)
- 副次評価項目: DOR、 薬物動態、 安全性
ORR:全奏効率 CR:完全奏効 PR:部分奏功 DOR:奏効期間
結果
- 有効性評価対象患者は119例.
- ORR:44% (95%CI 35-53). 内訳:CR 14%、 PR 29%.
- DOR中央値:11.9ヵ月 (95%CI 7.8-NE).
- 奏効までの期間中央値:8.1週 (IQR 7.9-8.3).
- PFS中央値:5.5ヵ月 (95%CI 3.5-8.3).
- 推定OS中央値:17.0ヵ月 (95%CI 13.5-NE).
- 安全性解析対象133例のうち、 96.2%がGradeを問わず1つ以上の治療上緊急の有害事象を発現し、 57.9%がGrade3以上を経験した.
- Grade3以上の有害事象:血小板減少 23%、 貧血 19%、 好中球減少症 17%、 下痢 4%、
- 重篤な治療関連有害事象:7%.
- 血液毒性以外の主な有害事象 (全Grade):下痢 30%、 味覚不全 29%.
- 有害事象による投与変更:中断 50%、 減量 16%、 中止 10%.
- サブタイプ毎のORR:AITL 54.8%、 PTCL-NOS 31.7%、 ALCL 33.3%、 PTCL-TFH 50.0% (詳細はSupplementary appendixのp13参照).
結論
- バレメトスタットは、 再発又は難治性のPTCL患者において、 管理可能な安全性プロファイルとともに、 持続的な奏効を示した.
参考文献
最終更新:2024年12月16日
執筆担当:牛久愛和総合病院薬剤センタ- 秋場孝則
監修医師:東海大学血液腫瘍内科 扇屋大輔
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(血液)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
