治療スケジュール
概要
監修医師
BOR:ボルテゾミブ(ベルケイド®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1mg/m² 皮下注 | 1~ | Day1、 4、 8、 11 |
Thalidomide:サリドマイド(サレド®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg/body 経口 | 1~ | Day4~7 (2コース以降はDay1~4) |
DEX:デキサメタゾン(レナデックス®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 40mg/body 経口 | 1~ | Day4~7 (2コース以降はDay1~4) |
CDDP:シスプラチン(ランダ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 10mg/m² 24hr持続静注 | 1~ | Day4~7 (2コース以降はDay1~4) |
ADR:アドリアマイシン(アドリアシン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 10mg/m² 24hr持続静注 | 1~ | Day4~7 (2コース以降はDay1~4) |
CPA:シクロホスファミド(エンドキサン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 400mg/m² 24hr持続静注 | 1~ | Day4~7 (2コース以降はDay1~4) |
ETP:エトポシド(ラステット®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 40mg/m² 24hr持続静注 | 1~ | Day4~7 (2コース以降はDay1~4) |
前投薬
| CDDP、 ADR、 CPA、 ETP投与日は5-HT3受容体拮抗薬を使用. |
| NK1受容体拮抗薬の使用を考慮. |
その他
| 1コースは21日間. |
| DEXの投与量40mg/bodyは、 エステル化物としての量を用いる. |
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*適正使用ガイドは「ヤンセンファーマ株式会社」 の外部サイトへ遷移します.
*安全管理手順は「藤本製薬株式会社」 の外部サイトへ遷移します.
主な有害事象
Cancer. 2015 Oct 15;121(20):3622-30.¹⁾より引用
詳細な有害事象について記載なし
骨髄抑制
- 貧血
- 好中球減少
- 血小板減少
主な有害事象
- 発熱性好中球減少 (50%)
その他
- 血栓塞栓症 (9%)
特徴と注意点
- VTD-PACEは、 進行又は再発難治性多発性骨髄腫に対するサルベージ療法の一つ.
感染対策
- 帯状疱疹の予防として、 抗ヘルペスウイルス薬の投与を考慮.
- ST合剤の予防内服を考慮.
- HBV再活性化リスクを考慮し、 適切なスクリーニング検査とモニタリングを行う.
各薬剤の副作用と対策
- ボルテゾミブは急性肺障害の国内報告があり、 適正使用ガイドを遵守する.
- ボルテゾミブによる末梢神経障害が発現した場合は、 減量又は中止を検討.
- サリドマイドの使用にあたり、 サリドマイド製剤安全管理手順 (TERMS®) を遵守する.
- サリドマイドには血栓・塞栓症リスクがあるため、 血小板が5 万/μL 以上であれば抗血栓薬の予防投与を考慮.
- デキサメタゾンによる各種合併症 (特にコントロール困難な糖尿病や出血性消化性潰瘍) に注意.
- アドリアマイシンには累積心毒性があるため、 累積上限量は500mg/m².
- シクロホスファミドは出血性膀胱炎のリスクがあるため、 水分摂取を励行し排尿を促す.
関連する臨床試験の結果
Br J Haematol. 2007 Jul;138(2):176-85.²⁾
概要
- 新たに骨髄腫と診断された患者303名に対する第2相試験.
- 年齢中央値59歳 (64歳以上は28%).
- 導入、 強化療法:移植前後にVTD-PACEを各2サイクル投与.
- 3年間の維持療法:初年度はVTD、 残りの年はTDを月1回投与.
- EFS、 OS、 毒性を評価.
EFS:無イベント生存率 OS:全生存率
結果
- 追跡期間中央値20ヵ月.
- 2年推定EFS:84%
- 2年推定OS:86%
- 遺伝子アレイデータが利用可能な275人のサブグループのうち、 GEPで定義された高リスク (14%、 70遺伝子モデル) は、 EFSとOSが劣っていた.
- Grade2以上の有害事象として、 血栓塞栓症が27%、 末梢神経障害が12%に認められた.
- ボルテゾミブと多剤併用化学療法は安全に併用でき、 80%以上の患者にほぼ完全な寛解状態と2年間の生存率をもたらすことが実証された.
ボルテゾミブの減量基準
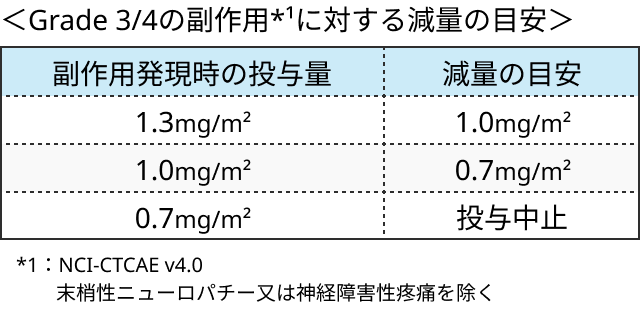
参考文献
最終更新:2023年5月7日
執筆:牛久愛和総合病院薬剤センタ- 秋場孝則
監修医師:東海大学血液腫瘍内科 扇屋大輔
VTD-PACE
ボルテゾミブ、 サリドマイド、 デキサメタゾン、 シスプラチン、 アドリアマイシン、 シクロホスファミド、 エトポシド
2023年05月07日更新
BOR:ボルテゾミブ(ベルケイド®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1mg/m² 皮下注 | 1~ | Day1、 4、 8、 11 |
Thalidomide:サリドマイド(サレド®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg/body 経口 | 1~ | Day4~7 (2コース以降はDay1~4) |
DEX:デキサメタゾン(レナデックス®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 40mg/body 経口 | 1~ | Day4~7 (2コース以降はDay1~4) |
CDDP:シスプラチン(ランダ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 10mg/m² 24hr持続静注 | 1~ | Day4~7 (2コース以降はDay1~4) |
ADR:アドリアマイシン(アドリアシン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 10mg/m² 24hr持続静注 | 1~ | Day4~7 (2コース以降はDay1~4) |
CPA:シクロホスファミド(エンドキサン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 400mg/m² 24hr持続静注 | 1~ | Day4~7 (2コース以降はDay1~4) |
ETP:エトポシド(ラステット®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 40mg/m² 24hr持続静注 | 1~ | Day4~7 (2コース以降はDay1~4) |
前投薬
| CDDP、 ADR、 CPA、 ETP投与日は5-HT3受容体拮抗薬を使用. |
| NK1受容体拮抗薬の使用を考慮. |
その他
| 1コースは21日間. |
| DEXの投与量40mg/bodyは、 エステル化物としての量を用いる. |
概要
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*適正使用ガイドは「ヤンセンファーマ株式会社」 の外部サイトへ遷移します.
*安全管理手順は「藤本製薬株式会社」 の外部サイトへ遷移します.
主な有害事象
Cancer. 2015 Oct 15;121(20):3622-30.¹⁾より引用
詳細な有害事象について記載なし
骨髄抑制
- 貧血
- 好中球減少
- 血小板減少
主な有害事象
- 発熱性好中球減少 (50%)
その他
- 血栓塞栓症 (9%)
特徴と注意点
- VTD-PACEは、 進行又は再発難治性多発性骨髄腫に対するサルベージ療法の一つ.
感染対策
- 帯状疱疹の予防として、 抗ヘルペスウイルス薬の投与を考慮.
- ST合剤の予防内服を考慮.
- HBV再活性化リスクを考慮し、 適切なスクリーニング検査とモニタリングを行う.
各薬剤の副作用と対策
- ボルテゾミブは急性肺障害の国内報告があり、 適正使用ガイドを遵守する.
- ボルテゾミブによる末梢神経障害が発現した場合は、 減量又は中止を検討.
- サリドマイドの使用にあたり、 サリドマイド製剤安全管理手順 (TERMS®) を遵守する.
- サリドマイドには血栓・塞栓症リスクがあるため、 血小板が5 万/μL 以上であれば抗血栓薬の予防投与を考慮.
- デキサメタゾンによる各種合併症 (特にコントロール困難な糖尿病や出血性消化性潰瘍) に注意.
- アドリアマイシンには累積心毒性があるため、 累積上限量は500mg/m².
- シクロホスファミドは出血性膀胱炎のリスクがあるため、 水分摂取を励行し排尿を促す.
関連する臨床試験の結果
Br J Haematol. 2007 Jul;138(2):176-85.²⁾
概要
- 新たに骨髄腫と診断された患者303名に対する第2相試験.
- 年齢中央値59歳 (64歳以上は28%).
- 導入、 強化療法:移植前後にVTD-PACEを各2サイクル投与.
- 3年間の維持療法:初年度はVTD、 残りの年はTDを月1回投与.
- EFS、 OS、 毒性を評価.
EFS:無イベント生存率 OS:全生存率
結果
- 追跡期間中央値20ヵ月.
- 2年推定EFS:84%
- 2年推定OS:86%
- 遺伝子アレイデータが利用可能な275人のサブグループのうち、 GEPで定義された高リスク (14%、 70遺伝子モデル) は、 EFSとOSが劣っていた.
- Grade2以上の有害事象として、 血栓塞栓症が27%、 末梢神経障害が12%に認められた.
- ボルテゾミブと多剤併用化学療法は安全に併用でき、 80%以上の患者にほぼ完全な寛解状態と2年間の生存率をもたらすことが実証された.
ボルテゾミブの減量基準

参考文献
最終更新:2023年5月7日
執筆:牛久愛和総合病院薬剤センタ- 秋場孝則
監修医師:東海大学血液腫瘍内科 扇屋大輔
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(血液)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。