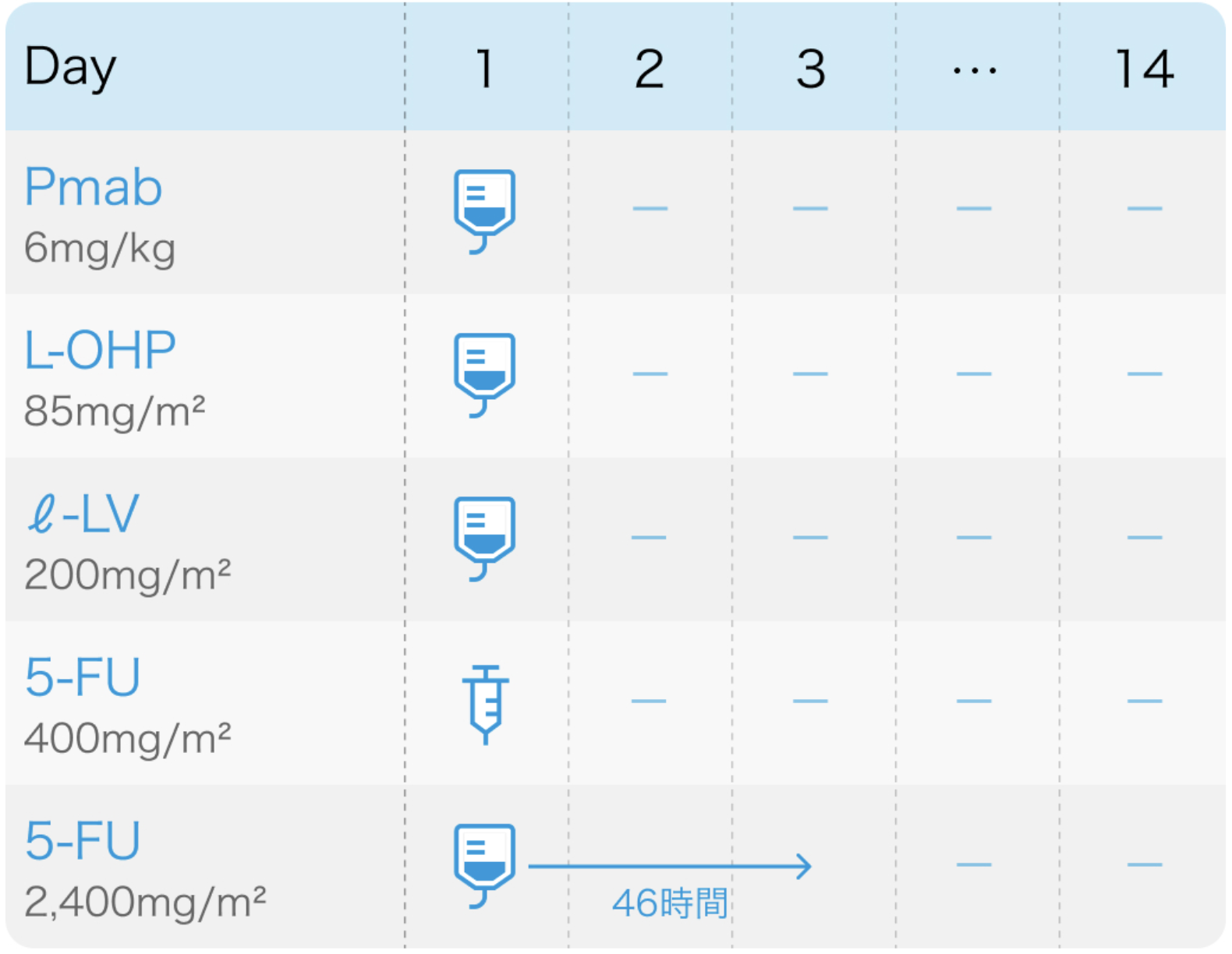
Pmab:パニツムマブ(ベクティビックス®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 6mg/kg 点滴 | 1~ | Day1 |
L-OHP:オキサリプラチン(エルプラット®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 85mg/m² 点滴 | 1~ | Day1 |
l-LV:レボホリナートカルシウム(アイソボリン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg/m² 点滴 | 1~ | Day1 |
5-FU:フルオロウラシル(フルオロウラシル®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 400mg/m² 急速静注 | 1~ | Day1 |
| 2400mg/m² 持続静注 | 1~ | Day1~3 |
その他
| 1コース14日間。 |
| L-OHP+I−LV+5-FUをFOLFOX療法と呼ぶ。 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
- エルプラット® (添付文書)
- アイソボリン® (添付文書)
- フルオロウラシル (添付文書)
*武田薬品工業の外部サイトへ遷移します
用法用量 (1コース2週間)
前投薬
制吐薬の基本は5-HT3拮抗薬+デキサメタゾン
オキサリプラチンがMECに該当するため
アプレピタント併用も選択肢
またはホスアプレピタント・ホスネツピタント
若年や女性など悪心・嘔吐リスクの患者には積極使用を検討
抗ヒスタミン薬 (パニツムマブの前投薬)
特徴と注意点
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
抗がん剤による末梢神経障害 (CIPN)
実臨床では、 末梢神経障害 (CIPN) の評価に、 CTCAEよりも症状の期間と程度を加味したDebiopharm社神経症状-感覚性毒性基準 (DEB-NTC) を用いる。 コンバージョンが明らかに困難と思われ、 延命を目的とするような症例では、 QOL低下を考慮して、 OPTIMOX1³⁾に準じたオキサリプラチン計画中止も積極的に検討する。
*CIPN : chemotherapy-induced peripheral neuropathies **DEB-NTC : Debiopharm Neurotoxicity Criteria of Debiopharm
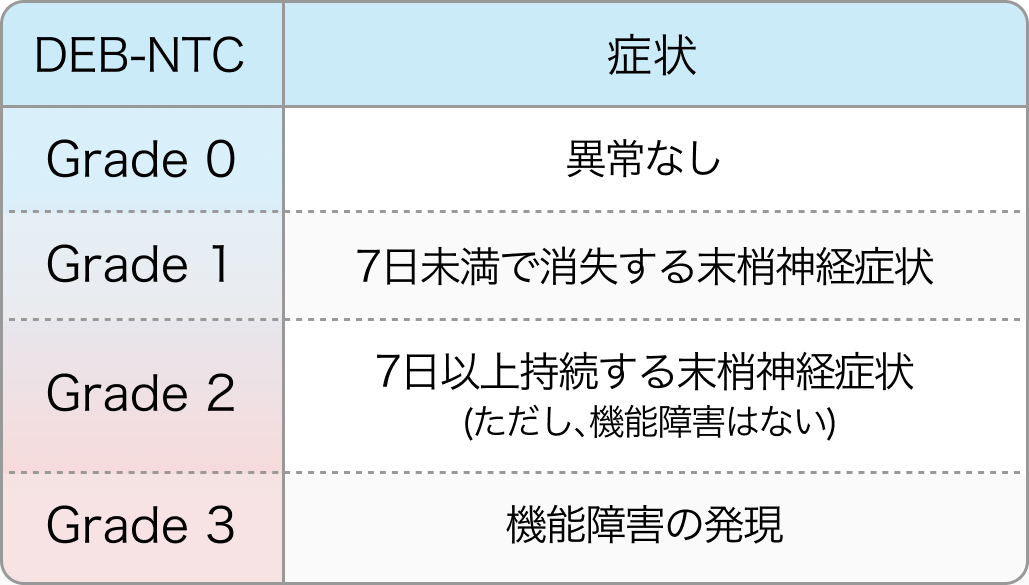
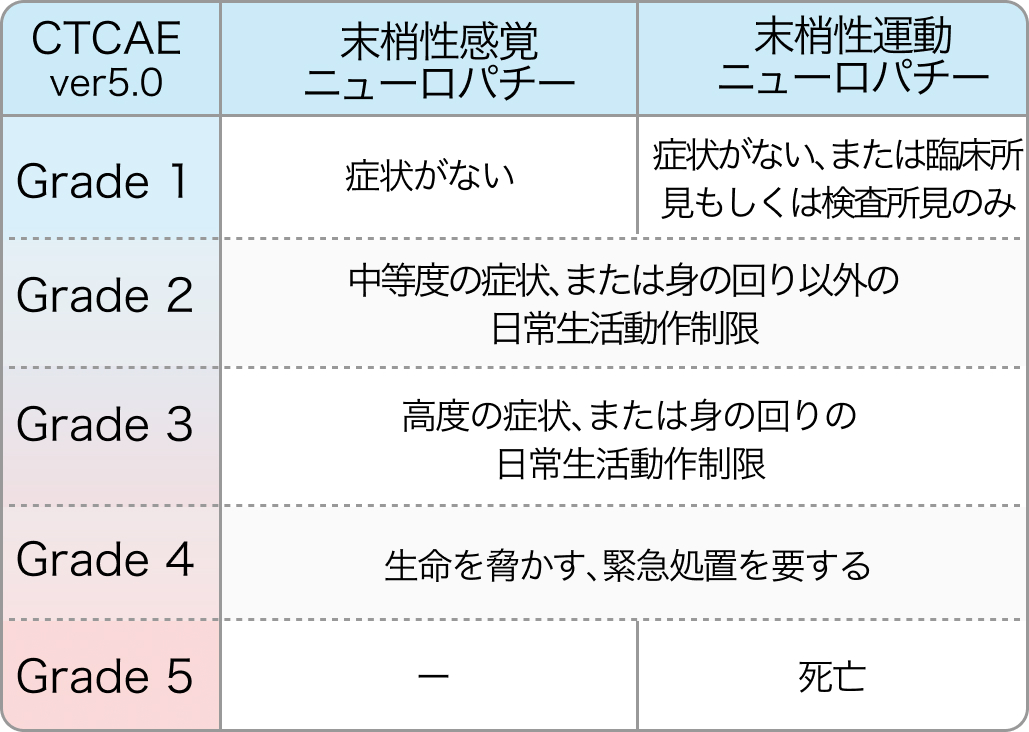
減量・休薬・中止のポイント
好中球数の投与開始基準は一般的に1500/μL以上だが、 複数回数投与によりその患者の毒性プロファイルがある程度予想できる場合には、 好中球数1200/μL前後でも投与可能とする医師はいる。
早期腫瘍縮小が得られ、 かつ抗EGFR抗体による毒性が患者にとって強いと感じられる時には抗EGFR抗体の一時休薬や終了も選択肢となりうる。
皮膚障害の対策
抗EGFR抗体による皮膚障害に対してJ-STEPP試験に準じた予防策も考慮する。 特にJ-STEPP試験に準じた予防策を行わないときは、 治療開始早期は抗EGFR抗体による皮膚障害のケアに注力する。
J-STEPP試験 : Panitumumabを含む治療投与前日から8週間、 保湿剤と日焼け止め (SPF25、 PFA4~8)、 0.5%ヒドロコルチゾンクリ‐ムを1日2回局所に塗布、 ミノサイクリン100㎎/日を1日1回内服
低Mg血症の出現に注意
治療期間が長くなる1次治療では抗EGFR抗体による低Mg血症の出現に注意する。
上手に使うためのワンポイント
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
治療選択肢について
左側RAS/BRAF野生型・MSS・HER2陰性における第一選択肢。 右側で腫瘍縮小が必要と考えられる対象においても治療選択肢となりうる。
悪心リスクが高い患者への対応
若年・女性などには、 初回投与時から選択的NK1受容体拮抗型制吐剤を前投薬として用いることを検討する。
高齢者への対応
JCOG1018試験では、 75歳以上もしくは、 70-74歳かつPS2の高齢患者では、 1次治療PFSにおけるオキサリプラチンの上乗せ効果は乏しいことが報告されている。 患者の身体及び腫瘍状況を考慮して治療方針を決定する必要がある。 FL+Pmabも治療選択肢となりうる。
投与開始基準
FOLFOX+Pmabの開始基準
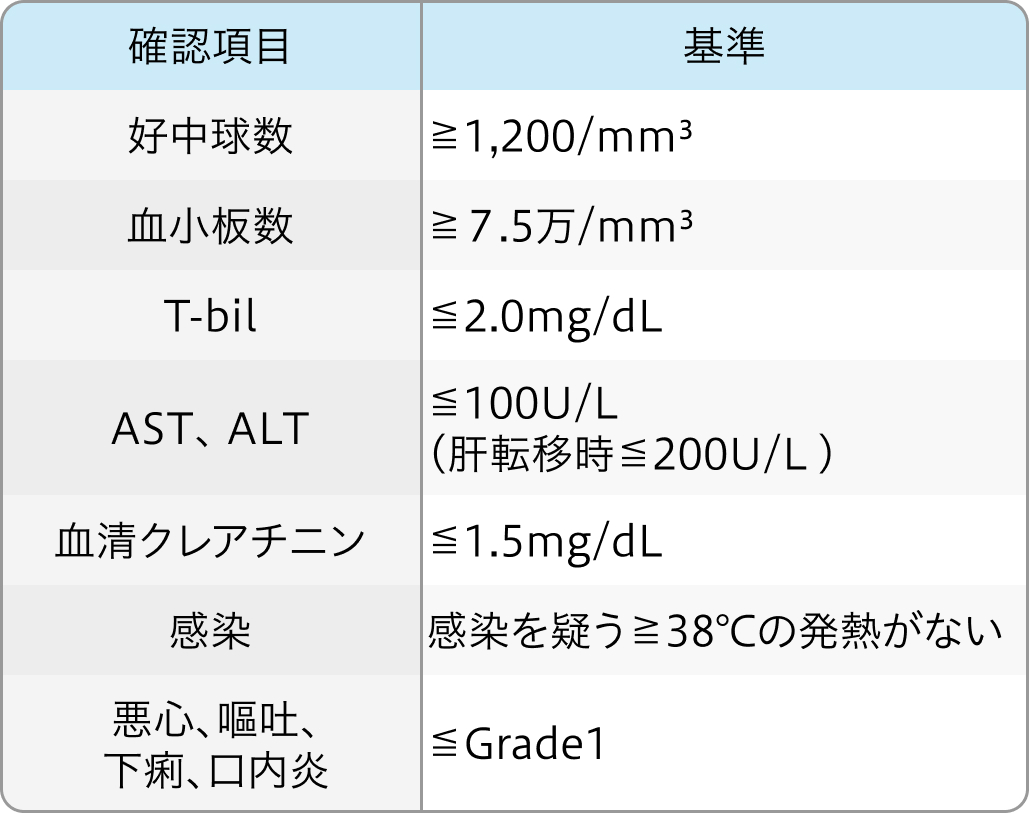
Pmabの開始基準

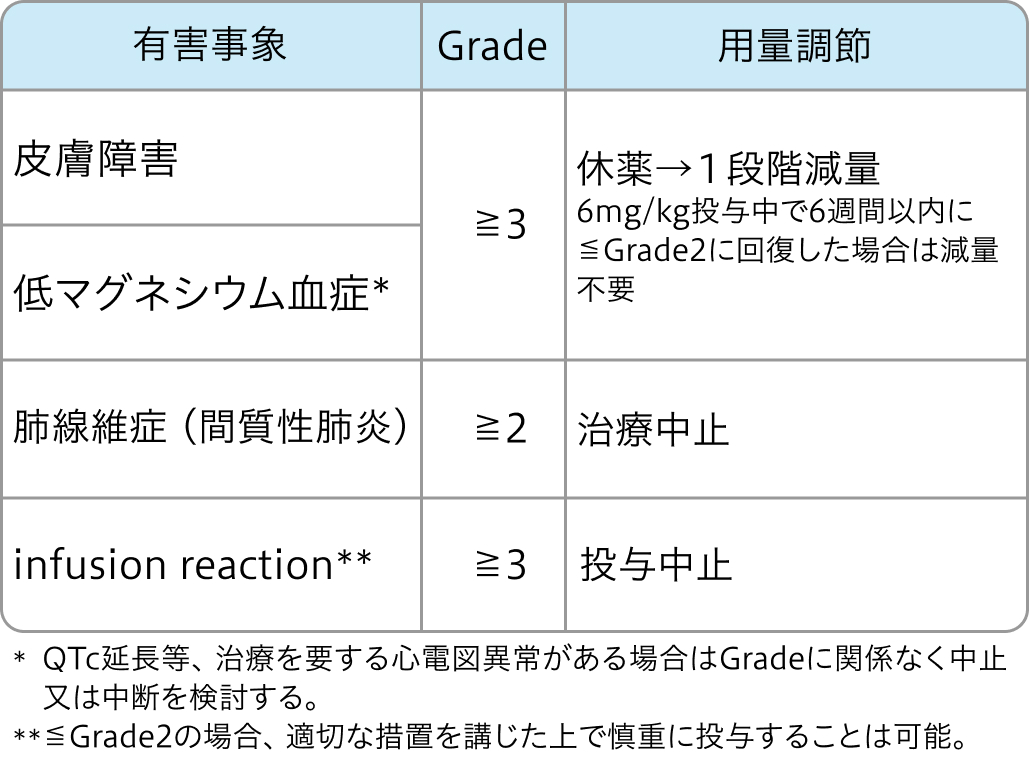
減量・休薬・中止基準
FOLFOX減量・休薬・中止基準

Pmabの減量・休薬・中止基準
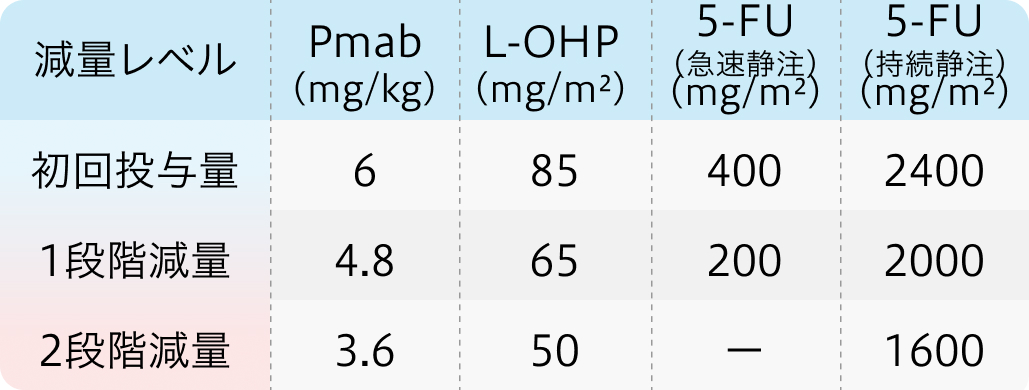
初回基準量と減量レベル
関連する臨床試験①|PRIME試験¹⁾
転移性大腸癌患者の1次治療において、 FOLFOX4療法 (フルオロウラシル+レボホリナート+オキサリプラチン) +パニツムマブ (Pmab) の効果を、 FOLFOX4療法単独を対照に検証した第III相無作為化比較試験PRIMEの結果より、 KRAS遺伝子野生型の患者に限り、 無増悪生存期間 (PFS) を延長する可能性が示された。
PFS中央値
KRAS遺伝子野生型
- FOLFOX4+Pmab群 : 9.6ヵ月
(95%CI 9.2-11.1ヵ月)
- FOLFOX4群 : 8.0ヵ月
(95%CI 7.5-9.3ヵ月)
HR 0.80 (95%CI 0.66-0.97)、 p=0.02
KRAS遺伝子変異型
- FOLFOX4+Pmab群 : 7.3ヵ月
(95%CI 6.3-8.0ヵ月)
- FOLFOX4群 : 8.8ヵ月
(95%CI 7.7-9.4ヵ月)
HR 1.29 (95%CI 1.04-1.62)、 p=0.02
OS中央値
KRAS遺伝子野生型
- FOLFOX4+Pmab群 : 23.9ヵ月
(95%CI 20.3-28.3ヵ月)
- FOLFOX4群 : 19.7ヵ月
(95%CI 17.6-22.6ヵ月)
HR 0.83 (95%CI 0.67-1.02)、 p=0.072
最終解析では、 OSの延長が報告された
HR 0.83 (95%CI 0.70-0.98)、 p=0.03
KRAS遺伝子変異型
- FOLFOX4+Pmab群 : 15.5ヵ月
(95%CI 13.1-17.6ヵ月)
- FOLFOX4群 : 19.3ヵ月
(95%CI 16.5-21.8ヵ月)
HR 1.24 (95%CI 0.98-1.57)、 p=0.068
ORR
KRAS遺伝子野生型
- FOLFOX4+Pmab群 : 55%
- FOLFOX4群 : 48%
KRAS遺伝子変異型
- FOLFOX4+Pmab群 : 40%
- FOLFOX4群 : 40%
関連する臨床試験②|PEAK試験²⁾
KRAS遺伝子exon 2に変異のない野生型で転移性の大腸癌患者の1次治療において、 FOLFOX (フルオロウラシル、 レボホリナート、 オキサリプラチン) +パニツムマブ (Pmab) の効果を、 FOLFOX+ベバシズマブ (Bmab) を対照に検証した第II相試験PEAKの結果より、 全生存期間 (OS) の有意な延長が示された。
PFS中央値
- FOLFOX+Pmab群 : 10.9ヵ月
(95%CI 9.4-13.0ヵ月)
- FOLFOX+Bmab群 : 10.1ヵ月
(95%CI 9.0-12.6ヵ月)
HR 0.87 (95%CI 0.65-1.17)、 p=0.353
全RAS野生型集団
- FOLFOX+Pmab群 : 13.0ヵ月
(95%CI 10.9-15.1ヵ月)
- FOLFOX+Bmab群 : 9.5ヵ月
(95%CI 9.0-12.7ヵ月)
HR 0.65 (95%CI 0.44-0.96)、 p=0.029
OS中央値
- FOLFOX+Pmab群 : 34.2ヵ月
(95%CI 26.6ヵ月-NR)
- FOLFOX+Bmab群 : 24.3ヵ月
(95%CI 21.0-29.2ヵ月)
HR 0.62 (95%CI 0.44-0.89)、 p=0.009
全RAS野生型集団
- FOLFOX+Pmab群 : 41.3ヵ月
(95%CI 28.8-41.3ヵ月)
- FOLFOX+Bmab群 : 28.9ヵ月
(95%CI 23.9-31.3ヵ月)
HR 0.63 (95%CI 0.39-1.02)、 p=0.058
ORR
- FOLFOX+Pmab群 : 57.8%
(95%CI 49.2-66.0%)
- FOLFOX+Bmab群 : 53.5%
(95%CI 45.0-61.9%)
全RAS野生型集団
- FOLFOX+Pmab群 : 63.6%
(95%CI 52.7-73.6%)
- FOLFOX+Bmab群 : 60.5%
(95%CI 49.0-71.2%)
関連する臨床試験③|PARADIGM試験
RAS遺伝子野生型で原発巣が左側の転移性大腸癌患者に対する1次治療の第1選択において、 FOLFOX (フルオロウラシル+レボホリナート+オキサリプラチン) +パニツムマブ (Pmab)の効果を、 FOLFOX+Bmab (フルオロウラシル、 レボホリナート、 オキサリプラチン、 ベバシズマブ) を対照に検証した第Ⅲ相試験PARADIGMの結果より、FOLFOX+Bmabに比べて全生存期間 (OS) を延長する可能性が示された。
OS中央値
左側
- FOLFOX+Pmab群 : 37.9ヵ月
- FOLFOX+Bmab群 : 34.3ヵ月
HR 0.82 (95.798%CI 0.68-0.99)、 p=0.03
全患者
- FOLFOX+Pmab群 : 36.2ヵ月
- FOLFOX+Bmab群 : 31.3ヵ月
HR 0.84 (95%CI 0.72-0.98)、 p=0.03
PFS中央値
左側
- FOLFOX+Pmab群 : 13.1ヵ月
- FOLFOX+Bmab群 : 11.9ヵ月
HR 1.00 (95%CI 0.83-1.20)
全患者
- FOLFOX+Pmab群 : 12.2ヵ月
- FOLFOX+Bmab群 : 11.4ヵ月
HR 1.05 (95%CI 0.90-1.24)
ORR
左側
- FOLFOX+Pmab群 : 80.2%
(95%CI 75.3-84.5%)
- FOLFOX+Bmab群 : 68.6%
(95%CI 62.9-74.0%)
全患者
- FOLFOX+Pmab群 : 74.9%
(95%CI 70.3-79.1%)
- FOLFOX+Bmab群 : 67.3%
(95%CI 62.4-71.9%)
奏効期間中央値
左側
- FOLFOX+Pmab群 : 13.1ヵ月
(95%CI 11.1-14.8ヵ月)
- FOLFOX+Bmab群 : 11.2ヵ月
(95%CI 9.6-13.1ヵ月)
HR 0.86 (95%CI 0.70-1.10)
全患者
- FOLFOX+Pmab群 : 11.9ヵ月
(95%CI 10.5-13.4ヵ月)
- FOLFOX+Bmab群 : 10.7ヵ月
(95%CI 9.5-12.2ヵ月)
HR 0.89 (95%CI 0.74-1.06)
治癒切除率
左側
- FOLFOX+Pmab群 : 18.3%
(95%CI 14.1-23.0%)
- FOLFOX+Bmab群 : 11.6%
(95%CI 8.2-15.9%)
全患者
- FOLFOX+Pmab群 : 16.5%
(95%CI 13.0-20.5%)
- FOLFOX+Bmab群 : 10.9%
(95%CI 8.1-14.4%)
参考文献
- Randomized, phase III trial of panitumumab with infusional fluorouracil, leucovorin, and oxaliplatin (FOLFOX4) versus FOLFOX4 alone as first-line treatment in patients with previously untreated metastatic colorectal cancer: the PRIME study. J Clin Oncol. 2010 Nov 1;28(31):4697-705. PMID: 20921465
- PEAK: a randomized, multicenter phase II study of panitumumab plus modified fluorouracil, leucovorin, and oxaliplatin (mFOLFOX6) or bevacizumab plus mFOLFOX6 in patients with previously untreated, unresectable, wild-type KRAS exon 2 metastatic colorectal cancer. J Clin Oncol. 2014 Jul 20;32(21):2240-7. PMID: 24687833
- OPTIMOX1: a randomized study of FOLFOX4 or FOLFOX7 with oxaliplatin in a stop-and-Go fashion in advanced colorectal cancer--a GERCOR study. J Clin Oncol. 2006 Jan 20;24(3):394-400. PMID: 16421419
- 武田薬品工業株式会社. RAS遺伝子野生型で化学療法未治療の切除不能進行再発大腸がんに対するパニツムマブと化学療法併用療法の有効性および安全性を評価したPARADIGM試験の結果について 2022年3月作成 [最終閲覧 2023/07/19]
*武田薬品工業株式会社の外部サイトへ遷移します
最終更新日 : 2024年7月17日
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
FOLFOX + Pmab
Pmab:パニツムマブ(ベクティビックス®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 6mg/kg 点滴 | 1~ | Day1 |
L-OHP:オキサリプラチン(エルプラット®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 85mg/m² 点滴 | 1~ | Day1 |
l-LV:レボホリナートカルシウム(アイソボリン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg/m² 点滴 | 1~ | Day1 |
5-FU:フルオロウラシル(フルオロウラシル®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 400mg/m² 急速静注 | 1~ | Day1 |
| 2400mg/m² 持続静注 | 1~ | Day1~3 |
その他
| 1コース14日間。 |
| L-OHP+I−LV+5-FUをFOLFOX療法と呼ぶ。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
- エルプラット® (添付文書)
- アイソボリン® (添付文書)
- フルオロウラシル (添付文書)
*武田薬品工業の外部サイトへ遷移します
用法用量 (1コース2週間)

前投薬
制吐薬の基本は5-HT3拮抗薬+デキサメタゾン
オキサリプラチンがMECに該当するため
アプレピタント併用も選択肢
またはホスアプレピタント・ホスネツピタント
若年や女性など悪心・嘔吐リスクの患者には積極使用を検討
抗ヒスタミン薬 (パニツムマブの前投薬)
特徴と注意点
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
抗がん剤による末梢神経障害 (CIPN)
実臨床では、 末梢神経障害 (CIPN) の評価に、 CTCAEよりも症状の期間と程度を加味したDebiopharm社神経症状-感覚性毒性基準 (DEB-NTC) を用いる。 コンバージョンが明らかに困難と思われ、 延命を目的とするような症例では、 QOL低下を考慮して、 OPTIMOX1³⁾に準じたオキサリプラチン計画中止も積極的に検討する。
*CIPN : chemotherapy-induced peripheral neuropathies **DEB-NTC : Debiopharm Neurotoxicity Criteria of Debiopharm


減量・休薬・中止のポイント
好中球数の投与開始基準は一般的に1500/μL以上だが、 複数回数投与によりその患者の毒性プロファイルがある程度予想できる場合には、 好中球数1200/μL前後でも投与可能とする医師はいる。
早期腫瘍縮小が得られ、 かつ抗EGFR抗体による毒性が患者にとって強いと感じられる時には抗EGFR抗体の一時休薬や終了も選択肢となりうる。
皮膚障害の対策
抗EGFR抗体による皮膚障害に対してJ-STEPP試験に準じた予防策も考慮する。 特にJ-STEPP試験に準じた予防策を行わないときは、 治療開始早期は抗EGFR抗体による皮膚障害のケアに注力する。
J-STEPP試験 : Panitumumabを含む治療投与前日から8週間、 保湿剤と日焼け止め (SPF25、 PFA4~8)、 0.5%ヒドロコルチゾンクリ‐ムを1日2回局所に塗布、 ミノサイクリン100㎎/日を1日1回内服
低Mg血症の出現に注意
治療期間が長くなる1次治療では抗EGFR抗体による低Mg血症の出現に注意する。
上手に使うためのワンポイント
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
治療選択肢について
左側RAS/BRAF野生型・MSS・HER2陰性における第一選択肢。 右側で腫瘍縮小が必要と考えられる対象においても治療選択肢となりうる。
悪心リスクが高い患者への対応
若年・女性などには、 初回投与時から選択的NK1受容体拮抗型制吐剤を前投薬として用いることを検討する。
高齢者への対応
JCOG1018試験では、 75歳以上もしくは、 70-74歳かつPS2の高齢患者では、 1次治療PFSにおけるオキサリプラチンの上乗せ効果は乏しいことが報告されている。 患者の身体及び腫瘍状況を考慮して治療方針を決定する必要がある。 FL+Pmabも治療選択肢となりうる。
投与開始基準
FOLFOX+Pmabの開始基準

Pmabの開始基準

減量・休薬・中止基準
FOLFOX減量・休薬・中止基準

Pmabの減量・休薬・中止基準

初回基準量と減量レベル

関連する臨床試験①|PRIME試験¹⁾
転移性大腸癌患者の1次治療において、 FOLFOX4療法 (フルオロウラシル+レボホリナート+オキサリプラチン) +パニツムマブ (Pmab) の効果を、 FOLFOX4療法単独を対照に検証した第III相無作為化比較試験PRIMEの結果より、 KRAS遺伝子野生型の患者に限り、 無増悪生存期間 (PFS) を延長する可能性が示された。
PFS中央値
KRAS遺伝子野生型
- FOLFOX4+Pmab群 : 9.6ヵ月
(95%CI 9.2-11.1ヵ月)
- FOLFOX4群 : 8.0ヵ月
(95%CI 7.5-9.3ヵ月)
HR 0.80 (95%CI 0.66-0.97)、 p=0.02
KRAS遺伝子変異型
- FOLFOX4+Pmab群 : 7.3ヵ月
(95%CI 6.3-8.0ヵ月)
- FOLFOX4群 : 8.8ヵ月
(95%CI 7.7-9.4ヵ月)
HR 1.29 (95%CI 1.04-1.62)、 p=0.02
OS中央値
KRAS遺伝子野生型
- FOLFOX4+Pmab群 : 23.9ヵ月
(95%CI 20.3-28.3ヵ月)
- FOLFOX4群 : 19.7ヵ月
(95%CI 17.6-22.6ヵ月)
HR 0.83 (95%CI 0.67-1.02)、 p=0.072
最終解析では、 OSの延長が報告された
HR 0.83 (95%CI 0.70-0.98)、 p=0.03
KRAS遺伝子変異型
- FOLFOX4+Pmab群 : 15.5ヵ月
(95%CI 13.1-17.6ヵ月)
- FOLFOX4群 : 19.3ヵ月
(95%CI 16.5-21.8ヵ月)
HR 1.24 (95%CI 0.98-1.57)、 p=0.068
ORR
KRAS遺伝子野生型
- FOLFOX4+Pmab群 : 55%
- FOLFOX4群 : 48%
KRAS遺伝子変異型
- FOLFOX4+Pmab群 : 40%
- FOLFOX4群 : 40%
関連する臨床試験②|PEAK試験²⁾
KRAS遺伝子exon 2に変異のない野生型で転移性の大腸癌患者の1次治療において、 FOLFOX (フルオロウラシル、 レボホリナート、 オキサリプラチン) +パニツムマブ (Pmab) の効果を、 FOLFOX+ベバシズマブ (Bmab) を対照に検証した第II相試験PEAKの結果より、 全生存期間 (OS) の有意な延長が示された。
PFS中央値
- FOLFOX+Pmab群 : 10.9ヵ月
(95%CI 9.4-13.0ヵ月)
- FOLFOX+Bmab群 : 10.1ヵ月
(95%CI 9.0-12.6ヵ月)
HR 0.87 (95%CI 0.65-1.17)、 p=0.353
全RAS野生型集団
- FOLFOX+Pmab群 : 13.0ヵ月
(95%CI 10.9-15.1ヵ月)
- FOLFOX+Bmab群 : 9.5ヵ月
(95%CI 9.0-12.7ヵ月)
HR 0.65 (95%CI 0.44-0.96)、 p=0.029
OS中央値
- FOLFOX+Pmab群 : 34.2ヵ月
(95%CI 26.6ヵ月-NR)
- FOLFOX+Bmab群 : 24.3ヵ月
(95%CI 21.0-29.2ヵ月)
HR 0.62 (95%CI 0.44-0.89)、 p=0.009
全RAS野生型集団
- FOLFOX+Pmab群 : 41.3ヵ月
(95%CI 28.8-41.3ヵ月)
- FOLFOX+Bmab群 : 28.9ヵ月
(95%CI 23.9-31.3ヵ月)
HR 0.63 (95%CI 0.39-1.02)、 p=0.058
ORR
- FOLFOX+Pmab群 : 57.8%
(95%CI 49.2-66.0%)
- FOLFOX+Bmab群 : 53.5%
(95%CI 45.0-61.9%)
全RAS野生型集団
- FOLFOX+Pmab群 : 63.6%
(95%CI 52.7-73.6%)
- FOLFOX+Bmab群 : 60.5%
(95%CI 49.0-71.2%)
関連する臨床試験③|PARADIGM試験
RAS遺伝子野生型で原発巣が左側の転移性大腸癌患者に対する1次治療の第1選択において、 FOLFOX (フルオロウラシル+レボホリナート+オキサリプラチン) +パニツムマブ (Pmab)の効果を、 FOLFOX+Bmab (フルオロウラシル、 レボホリナート、 オキサリプラチン、 ベバシズマブ) を対照に検証した第Ⅲ相試験PARADIGMの結果より、FOLFOX+Bmabに比べて全生存期間 (OS) を延長する可能性が示された。
OS中央値
左側
- FOLFOX+Pmab群 : 37.9ヵ月
- FOLFOX+Bmab群 : 34.3ヵ月
HR 0.82 (95.798%CI 0.68-0.99)、 p=0.03
全患者
- FOLFOX+Pmab群 : 36.2ヵ月
- FOLFOX+Bmab群 : 31.3ヵ月
HR 0.84 (95%CI 0.72-0.98)、 p=0.03
PFS中央値
左側
- FOLFOX+Pmab群 : 13.1ヵ月
- FOLFOX+Bmab群 : 11.9ヵ月
HR 1.00 (95%CI 0.83-1.20)
全患者
- FOLFOX+Pmab群 : 12.2ヵ月
- FOLFOX+Bmab群 : 11.4ヵ月
HR 1.05 (95%CI 0.90-1.24)
ORR
左側
- FOLFOX+Pmab群 : 80.2%
(95%CI 75.3-84.5%)
- FOLFOX+Bmab群 : 68.6%
(95%CI 62.9-74.0%)
全患者
- FOLFOX+Pmab群 : 74.9%
(95%CI 70.3-79.1%)
- FOLFOX+Bmab群 : 67.3%
(95%CI 62.4-71.9%)
奏効期間中央値
左側
- FOLFOX+Pmab群 : 13.1ヵ月
(95%CI 11.1-14.8ヵ月)
- FOLFOX+Bmab群 : 11.2ヵ月
(95%CI 9.6-13.1ヵ月)
HR 0.86 (95%CI 0.70-1.10)
全患者
- FOLFOX+Pmab群 : 11.9ヵ月
(95%CI 10.5-13.4ヵ月)
- FOLFOX+Bmab群 : 10.7ヵ月
(95%CI 9.5-12.2ヵ月)
HR 0.89 (95%CI 0.74-1.06)
治癒切除率
左側
- FOLFOX+Pmab群 : 18.3%
(95%CI 14.1-23.0%)
- FOLFOX+Bmab群 : 11.6%
(95%CI 8.2-15.9%)
全患者
- FOLFOX+Pmab群 : 16.5%
(95%CI 13.0-20.5%)
- FOLFOX+Bmab群 : 10.9%
(95%CI 8.1-14.4%)
参考文献
- Randomized, phase III trial of panitumumab with infusional fluorouracil, leucovorin, and oxaliplatin (FOLFOX4) versus FOLFOX4 alone as first-line treatment in patients with previously untreated metastatic colorectal cancer: the PRIME study. J Clin Oncol. 2010 Nov 1;28(31):4697-705. PMID: 20921465
- PEAK: a randomized, multicenter phase II study of panitumumab plus modified fluorouracil, leucovorin, and oxaliplatin (mFOLFOX6) or bevacizumab plus mFOLFOX6 in patients with previously untreated, unresectable, wild-type KRAS exon 2 metastatic colorectal cancer. J Clin Oncol. 2014 Jul 20;32(21):2240-7. PMID: 24687833
- OPTIMOX1: a randomized study of FOLFOX4 or FOLFOX7 with oxaliplatin in a stop-and-Go fashion in advanced colorectal cancer--a GERCOR study. J Clin Oncol. 2006 Jan 20;24(3):394-400. PMID: 16421419
- 武田薬品工業株式会社. RAS遺伝子野生型で化学療法未治療の切除不能進行再発大腸がんに対するパニツムマブと化学療法併用療法の有効性および安全性を評価したPARADIGM試験の結果について 2022年3月作成 [最終閲覧 2023/07/19]
*武田薬品工業株式会社の外部サイトへ遷移します
最終更新日 : 2024年7月17日
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
