本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*小野薬品工業株式会社の外部サイトへ遷移します
用法用量
電子添文¹⁾の用法および用量
2週間間隔
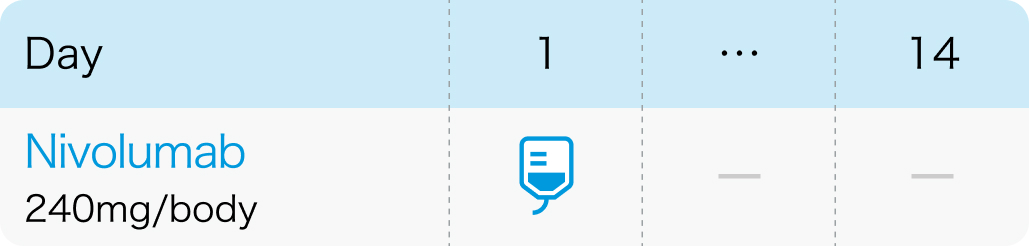
4週間間隔
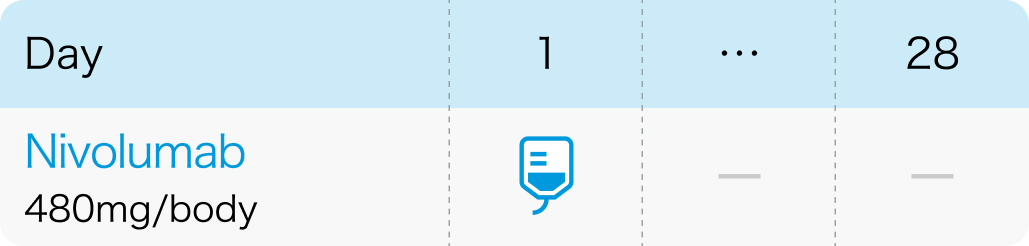
1回240mgを2週間間隔または1回480mgを4週間間隔で点滴静注¹⁾
他の抗悪性腫瘍剤との併用について、 有効性及び安全性は確立していない。
オプジーボ®電子添文 (2024年2月改訂第20版)¹⁾より作図
投与開始基準
NMSC-PD1試験³⁾のプロトコル
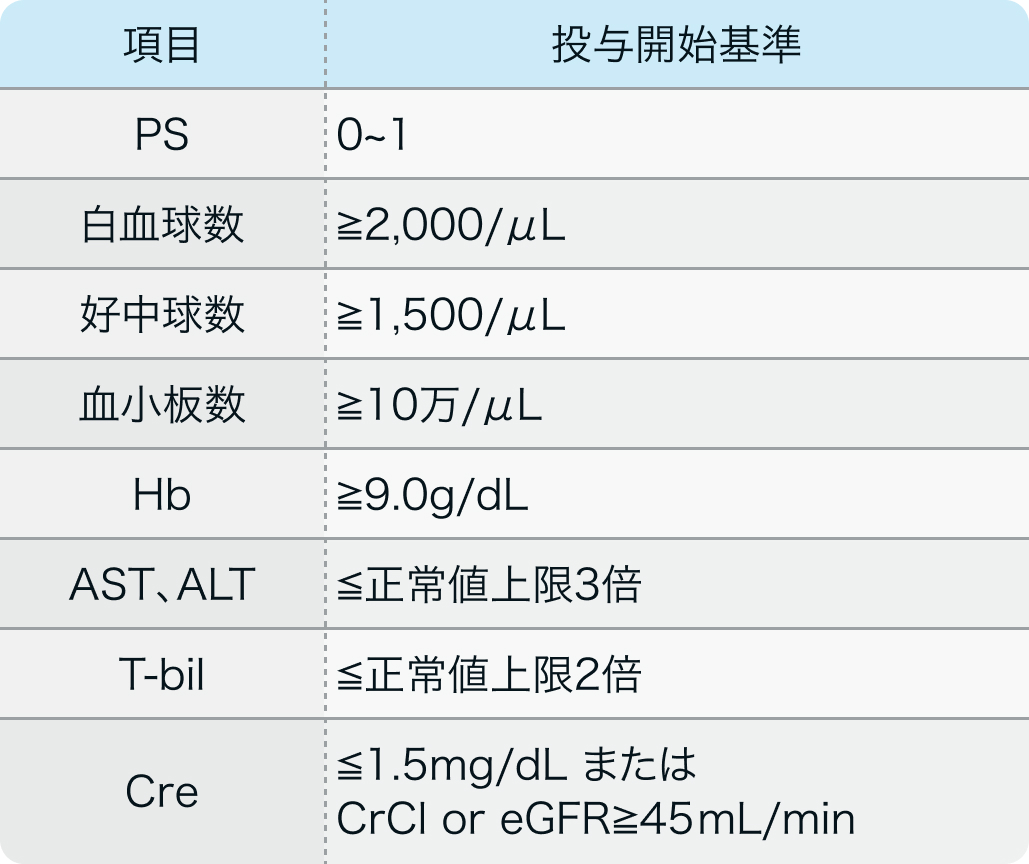
Medicine (Baltimore) . 2020 Oct 30;99(44):e22913³⁾より作図
中止基準
NMSC-PD1試験³⁾のプロトコル
以下の少なくとも1つが発生した患者でニボルマブの投与を中止
- ≧Grade3の間質性肺炎
- ≧Grade2の目の痛み、 かすみ目で、 治療してもGrade1に改善のない場合
- ≧Grade3の気管支痙攣、 下痢、 大腸炎、 神経毒性、 過敏反応、 注入反応、 ぶどう膜炎
- ≧Grade3の血小板減少症 (5日以上継続)
- 前回の治療サイクルの開始から10週間以上経過
- 研究者または医師が薬剤の投与を中止すると判断
Medicine (Baltimore) . 2020 Oct 30;99(44):e22913³⁾より引用
主な有害事象
KCTR-D014試験³⁾
主な有害事象 (カッコ内はGrade3~4)
- 貧血 6.5% (0%)
- 副腎機能不全 6.5% (0%)
- 甲状腺機能亢進症 12.9% (3.2%)
- 甲状腺機能低下症 9.7% (0%)
- 倦怠感 6.5% (0%)
- 発熱 9.7% (3.2%)
- 血中甲状腺刺激ホルモン減少 12.9% (0%)
- 間質性肺疾患 6.5% (3.2%)
- そう痒症 6.5% (0%)
厚生労働省:最適使用推進ガイドラインニボルマブ(遺伝子組換え)~上皮系皮膚悪性腫瘍~.令和6年2月⁴⁾より引用
エキスパートによるワンポイント
適応と禁忌事項
根治切除不能な局所進行または遠隔転移を有する有棘細胞癌に用いられる。 ニボルマブの成分に対し過敏症がある場合は禁忌、 間質性肺疾患の合併や既往がある、 肺に炎症性変化がみられる、 自己免疫疾患の合併がある、 臓器移植歴がある、 結核の感染または既往がある、 ECOGPSが3-4である場合の投与は推奨されていない。 また、 免疫関連有害事象が生じた際には多くの場合ステロイドの全身投与を要することから、 ステロイドの長期全身投与に耐えられない全身状態や合併症を有する場合の投与の可否は慎重に判断する必要がある。
投与方法と国内第II相試験³⁾の結果
通常、 成人にはニボルマブ (遺伝子組み換え) として、 1回240㎎を2週間間隔または1回480㎎を4週間間隔で30分以上かけて点滴静注する。
根治切除不能な進行・再発の上皮系皮膚悪性腫瘍を対象に、 ニボルマブの単独投与レジメン (1回480㎎を4週間間隔で30分以上かけて点滴静注する) を評価する国内第II相試験³⁾が行われた。 上皮系皮膚悪性腫瘍患者31名 (有棘細胞癌20名、 基底細胞癌2名、 乳房外パジェット病4名、 皮膚付属器癌5名 (エクリン汗孔癌3名、 汗腺癌1名、 皮膚粘液癌1名) ) が含まれ、 全体の奏効割合 (独立中央判定) は19.4%、 有棘細胞癌は20.0% (95%CI 0.68 : 5.7~43.7%) であった。
治療関連の有害事象と対処
上皮系皮膚悪性腫瘍を対象とした国内第II相試験³⁾では、 治療関連の有害事象は58.1%に生じた。 具体的には、 甲状腺機能障が11名 (35.5%)、 間質性肺疾患が2名 (6.5%)、 副腎機能障害が2名 (6.5%)、 横紋筋融解症/ミオパチーが1名 (3.2%)、 肝機能障害が1名 (3.2%)、 下垂体機能障害が1名 (3.2%)、 神経障害が1名 (3.2%)、 腎機能障害が1名 (3.2%)、 ぶどう膜炎が1名 (3.2%) に認められた。 その他、 重症筋無力症、 心筋炎、 大腸炎、 下痢、 1型糖尿病、 硬化性胆管炎、 脳炎、 髄膜炎、 重度の皮膚障害、 静脈血栓塞栓症、 infusion reaction、 血球貪食症候群、 胃炎、 心臓障害 (心房細動・徐脈・心室性期外収縮等) 等も生じうるため、 免疫関連有害事象が生じた場合に直ちに適切な処置ができる体制が整っている施設で実施される必要がある。
減量基準はなく、 ホルモン補充療法でコントロール可能な内分泌関連の免疫関連有害事象を除き、 Grade3以上またはGradeに関わらず致死的になり得る場合には中止する。
監修 : 国立がん研究センター中央病院 皮膚腫瘍科 医長 並川 健二郎先生
出典
- 小野薬品工業株式会社. オプジーボ®電子添文 (2024年2月改訂第20版) [最終閲覧 : 2024/03/07]
- 小野薬品工業株式会社. オプジーボ®適正使用ガイド (2024年2月作成) [最終閲覧 : 2024/03/07]
- Anti-PD-1 antibody therapy for epithelial skin malignancies: An investigator-initiated, open-label, single-arm, multicenter, phase II clinical trial (NMSC-PD1 Study). Medicine (Baltimore) . 2020 Oct 30;99(44):e22913. PMID: 33126349
- 厚生労働省:最適使用推進ガイドラインニボルマブ(遺伝子組換え)~上皮系皮膚悪性腫瘍~.令和6年2月
最終更新日 : 2024年7月25日
監修医師 : 国立がん研究センター中央病院 皮膚腫瘍科 医長 並川 健二郎先生
Nivolumab
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*小野薬品工業株式会社の外部サイトへ遷移します
用法用量
電子添文¹⁾の用法および用量
2週間間隔

4週間間隔

1回240mgを2週間間隔または1回480mgを4週間間隔で点滴静注¹⁾
他の抗悪性腫瘍剤との併用について、 有効性及び安全性は確立していない。
オプジーボ®電子添文 (2024年2月改訂第20版)¹⁾より作図
投与開始基準
NMSC-PD1試験³⁾のプロトコル

Medicine (Baltimore) . 2020 Oct 30;99(44):e22913³⁾より作図
中止基準
NMSC-PD1試験³⁾のプロトコル
以下の少なくとも1つが発生した患者でニボルマブの投与を中止
- ≧Grade3の間質性肺炎
- ≧Grade2の目の痛み、 かすみ目で、 治療してもGrade1に改善のない場合
- ≧Grade3の気管支痙攣、 下痢、 大腸炎、 神経毒性、 過敏反応、 注入反応、 ぶどう膜炎
- ≧Grade3の血小板減少症 (5日以上継続)
- 前回の治療サイクルの開始から10週間以上経過
- 研究者または医師が薬剤の投与を中止すると判断
Medicine (Baltimore) . 2020 Oct 30;99(44):e22913³⁾より引用
主な有害事象
KCTR-D014試験³⁾
主な有害事象 (カッコ内はGrade3~4)
- 貧血 6.5% (0%)
- 副腎機能不全 6.5% (0%)
- 甲状腺機能亢進症 12.9% (3.2%)
- 甲状腺機能低下症 9.7% (0%)
- 倦怠感 6.5% (0%)
- 発熱 9.7% (3.2%)
- 血中甲状腺刺激ホルモン減少 12.9% (0%)
- 間質性肺疾患 6.5% (3.2%)
- そう痒症 6.5% (0%)
厚生労働省:最適使用推進ガイドラインニボルマブ(遺伝子組換え)~上皮系皮膚悪性腫瘍~.令和6年2月⁴⁾より引用
エキスパートによるワンポイント
適応と禁忌事項
根治切除不能な局所進行または遠隔転移を有する有棘細胞癌に用いられる。 ニボルマブの成分に対し過敏症がある場合は禁忌、 間質性肺疾患の合併や既往がある、 肺に炎症性変化がみられる、 自己免疫疾患の合併がある、 臓器移植歴がある、 結核の感染または既往がある、 ECOGPSが3-4である場合の投与は推奨されていない。 また、 免疫関連有害事象が生じた際には多くの場合ステロイドの全身投与を要することから、 ステロイドの長期全身投与に耐えられない全身状態や合併症を有する場合の投与の可否は慎重に判断する必要がある。
投与方法と国内第II相試験³⁾の結果
通常、 成人にはニボルマブ (遺伝子組み換え) として、 1回240㎎を2週間間隔または1回480㎎を4週間間隔で30分以上かけて点滴静注する。
根治切除不能な進行・再発の上皮系皮膚悪性腫瘍を対象に、 ニボルマブの単独投与レジメン (1回480㎎を4週間間隔で30分以上かけて点滴静注する) を評価する国内第II相試験³⁾が行われた。 上皮系皮膚悪性腫瘍患者31名 (有棘細胞癌20名、 基底細胞癌2名、 乳房外パジェット病4名、 皮膚付属器癌5名 (エクリン汗孔癌3名、 汗腺癌1名、 皮膚粘液癌1名) ) が含まれ、 全体の奏効割合 (独立中央判定) は19.4%、 有棘細胞癌は20.0% (95%CI 0.68 : 5.7~43.7%) であった。
治療関連の有害事象と対処
上皮系皮膚悪性腫瘍を対象とした国内第II相試験³⁾では、 治療関連の有害事象は58.1%に生じた。 具体的には、 甲状腺機能障が11名 (35.5%)、 間質性肺疾患が2名 (6.5%)、 副腎機能障害が2名 (6.5%)、 横紋筋融解症/ミオパチーが1名 (3.2%)、 肝機能障害が1名 (3.2%)、 下垂体機能障害が1名 (3.2%)、 神経障害が1名 (3.2%)、 腎機能障害が1名 (3.2%)、 ぶどう膜炎が1名 (3.2%) に認められた。 その他、 重症筋無力症、 心筋炎、 大腸炎、 下痢、 1型糖尿病、 硬化性胆管炎、 脳炎、 髄膜炎、 重度の皮膚障害、 静脈血栓塞栓症、 infusion reaction、 血球貪食症候群、 胃炎、 心臓障害 (心房細動・徐脈・心室性期外収縮等) 等も生じうるため、 免疫関連有害事象が生じた場合に直ちに適切な処置ができる体制が整っている施設で実施される必要がある。
減量基準はなく、 ホルモン補充療法でコントロール可能な内分泌関連の免疫関連有害事象を除き、 Grade3以上またはGradeに関わらず致死的になり得る場合には中止する。
監修 : 国立がん研究センター中央病院 皮膚腫瘍科 医長 並川 健二郎先生
出典
- 小野薬品工業株式会社. オプジーボ®電子添文 (2024年2月改訂第20版) [最終閲覧 : 2024/03/07]
- 小野薬品工業株式会社. オプジーボ®適正使用ガイド (2024年2月作成) [最終閲覧 : 2024/03/07]
- Anti-PD-1 antibody therapy for epithelial skin malignancies: An investigator-initiated, open-label, single-arm, multicenter, phase II clinical trial (NMSC-PD1 Study). Medicine (Baltimore) . 2020 Oct 30;99(44):e22913. PMID: 33126349
- 厚生労働省:最適使用推進ガイドラインニボルマブ(遺伝子組換え)~上皮系皮膚悪性腫瘍~.令和6年2月
最終更新日 : 2024年7月25日
監修医師 : 国立がん研究センター中央病院 皮膚腫瘍科 医長 並川 健二郎先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。