本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
2025/4/8時点で、 S-1は有棘細胞癌に対して本邦適応外薬
薬剤情報
ティーエスワン® (添付文書¹⁾ / 適正使用ガイド²⁾*)
代謝拮抗薬 テガフール・ギメラシル・オテラシルカリウム配合剤 *大鵬薬品の医療関係者向けサイトへ遷移します
用法用量
遡及的コホート研究³⁾のプロトコル
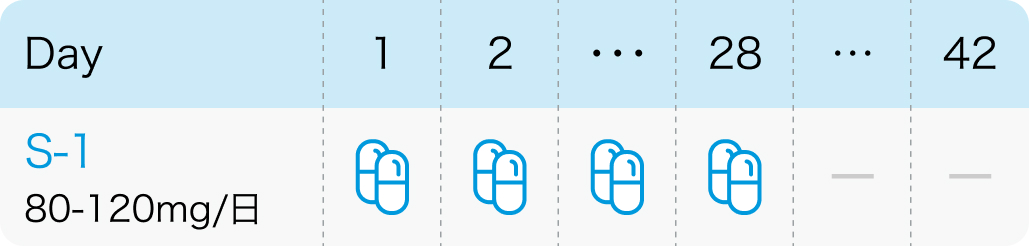
40~60mg/回 1日2回、 28日間連日経口投与し、 14日間休薬。これを1コースとして繰り返す。
J Dermatol. 2014 Jun;41(6):494-7³⁾より作図
用量は、 体表面積により以下の通り調整
<1.25m² : 80mg/日
1.25~ <1.50m² : 100mg/日
≧1.50m² : 120mg/日
J Dermatol. 2014 Jun;41(6):494-7³⁾より引用
投与開始基準
適正使用ガイド²⁾の基準
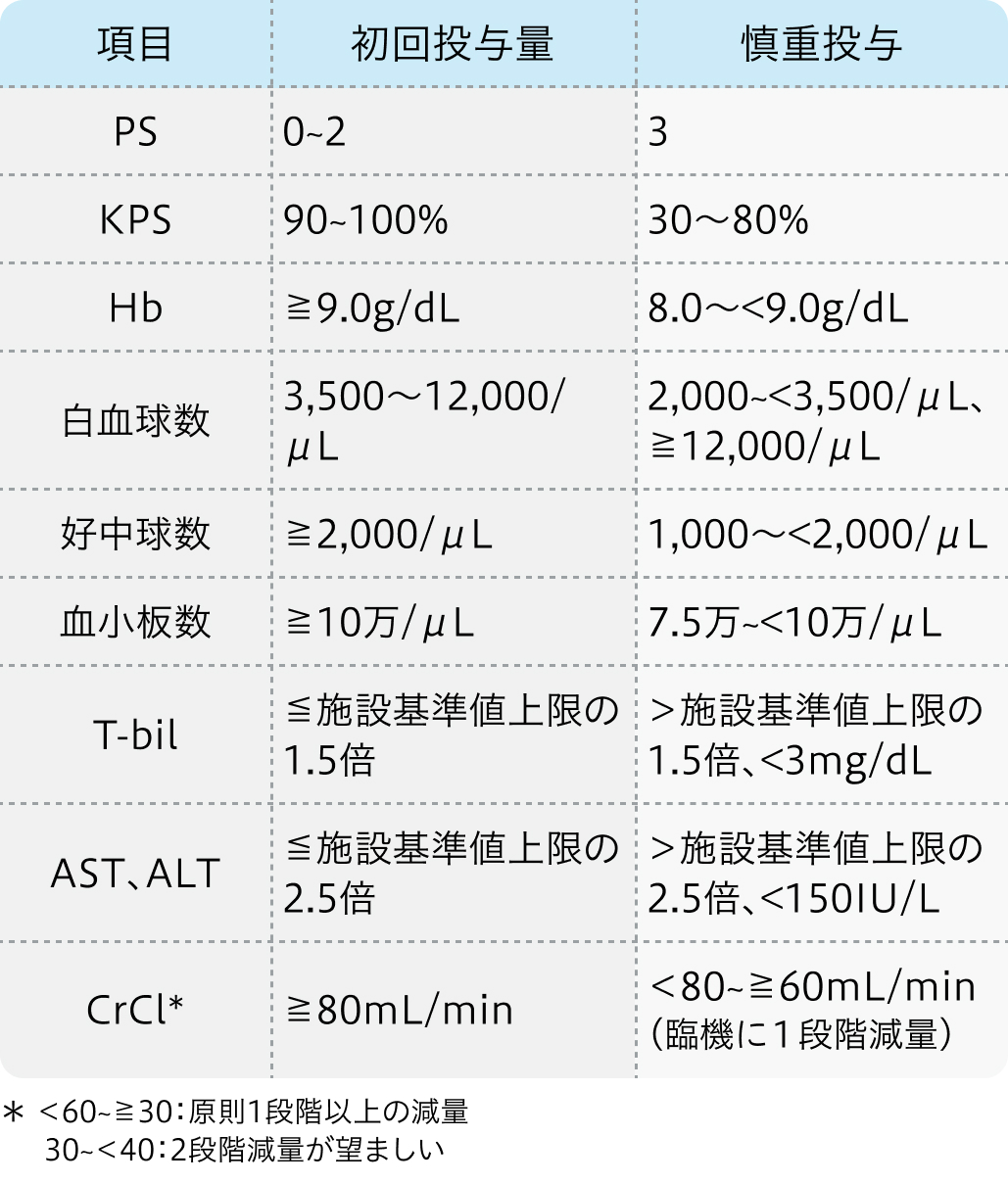
ティーエスワン®適正使用ガイド (2023年10月27日 更新)²⁾より引用
主な有害事象
遡及的コホート研究³⁾
主な有害事象 (Grade3~4)
- 好中球数減少 33.3% (33.3%)
- 貧血 100% (33.3%)
- 血小板数減少 66.7% (0%)
- 食欲不振 33.3% (0%)
- 羞明 16.7% (16.7%)
- 高血糖 16.7% (16.7%)
- 粘膜炎 33.3% (16.7%)
J Dermatol. 2014 Jun;41(6):494-7³⁾より引用
エキスパートによるワンポイント
免疫療法に不応・不適な場合の選択肢
根治切除不能な局所進行または遠隔転移を有する有棘細胞癌に用いられることがある。 2024年2月にニボルマブが上皮系皮膚悪性腫瘍に承認されてからは、 ニボルマブに不応または自己免疫疾患を合併し免疫抑制剤を服用中等の理由で免疫療法が適さない患者に用いられる。 進行期の有棘細胞癌に用いられる全身薬物療法の中で、 唯一の経口薬である。
⚠2024/8/5時点で、 S-1は有棘細胞癌に対して本邦適応外薬
投与スケジュール
有棘細胞癌では、 A法を用いる。 用法・用量は、 初回投与量 (1回量) を体表面積に合わせた基準量とし (体表面積1.25m²未満は40mg/回、 1.25以上1.5m²未満は50mg/回、 1.5m²以上は60mg/回)、 朝夕食後の1日2回、 28日間連日経口投与し、 その後14日間休薬する。 これを1コースとして、 臨床効果が得られなくなるか、 許容できない副作用が発生するまで投与を繰り返す¹⁾。
⚠2024/8/5時点で、 S-1は有棘細胞癌に対して本邦適応外薬
Grade4の血液毒性やGrade3以上の非血液毒性をきたした場合、 次コースからは適宜減量する。 空腹時に内服すると抗腫瘍効果が減弱する可能性があり、 食後投与が望ましい。
臨床試験と奏効割合
これまでに、 有棘細胞癌を対象にS-1療法が検証的な臨床試験で評価されたことはない。
Ogataらは、 有棘細胞癌に対する全身薬物療法の国内データを集計し、 S-1療法が投与された23例における奏効割合は30% (CR3例、 PR4例) であったと報告している ⁴⁾。
Izumiらは、 頭頚部領域に生じた局所進行有棘細胞癌14例に対してS-1療法を行い、 奏効割合は78% (CR9例、 PR2例) であったと報告している⁵⁾。
副作用とその対策
S-1は、 テガフール、 ギメラシル、 オテラシルカリウムの3成分を1 : 0.4 : 1の比で配合したフッ化ピリミジン系抗悪性腫瘍剤である。 テガフールはフルオロウラシル (5-FU) のプロドラッグで、 経口投与後に5-FUに変換される。 ギメラシルは5-FUを不活化する酵素を強く阻害することにより、 5-FUの腫瘍内での濃度を維持する。
オテラシルカリウムは消化管粘膜に分布し、 下痢などの消化器毒性を軽減する。 重篤な腎障害のある患者では、 ギメラシルの腎排泄が著しく低下し血中フルオロウラシル濃度が上昇して骨髄抑制等の副作用が強く出るため、 投与禁忌である。 テガフールは粘膜障害 (口内炎、 下痢、 消化管潰瘍など) を生じやすい。 ワルファリンの作用を増強するため、 ワルファリン内服中の患者では出血症状の出現に注意し、 採血時に凝固能 (PT-INR) も確認する。 肝障害にも注意が必要である。 古典的な手足症候群、 色素沈着などを生じることがある。
出典
- 大鵬薬品工業株式会社 . ティーエスワン®電子添文 (2025年1月改訂 第4版) [最終閲覧 : 2025/04/08]
- 大鵬薬品工業株式会社 . ティーエスワン®適正使用ガイド [最終閲覧 : 2025/04/08]
- Oral S-1 in advanced cutaneous squamous cell carcinoma. J Dermatol. 2014 Jun;41(6):494-7. PMID: 24814954
- Systemic treatment of patients with advanced cutaneous squamous cell carcinoma: response rates and outcomes of the regimes used. Eur J Cancer. 2020 Mar:127:108-117. PMID: 32004792
- Favorable efficacy of S-1 treatment for locoregionally advanced cutaneous squamous cell carcinoma in the head and neck region. J Dermatol. 2024 Feb;51(2):271-279. PMID: 38009848
最終更新日 : 2025年4月8日
監修医師 : 国立がん研究センター中央病院 皮膚腫瘍科 医長 並川 健二郎先生
S-1
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
2025/4/8時点で、 S-1は有棘細胞癌に対して本邦適応外薬
薬剤情報
ティーエスワン® (添付文書¹⁾ / 適正使用ガイド²⁾*)
代謝拮抗薬 テガフール・ギメラシル・オテラシルカリウム配合剤 *大鵬薬品の医療関係者向けサイトへ遷移します
用法用量
遡及的コホート研究³⁾のプロトコル

40~60mg/回 1日2回、 28日間連日経口投与し、 14日間休薬。これを1コースとして繰り返す。
J Dermatol. 2014 Jun;41(6):494-7³⁾より作図
用量は、 体表面積により以下の通り調整
<1.25m² : 80mg/日
1.25~ <1.50m² : 100mg/日
≧1.50m² : 120mg/日
J Dermatol. 2014 Jun;41(6):494-7³⁾より引用
投与開始基準
適正使用ガイド²⁾の基準

ティーエスワン®適正使用ガイド (2023年10月27日 更新)²⁾より引用
主な有害事象
遡及的コホート研究³⁾
主な有害事象 (Grade3~4)
- 好中球数減少 33.3% (33.3%)
- 貧血 100% (33.3%)
- 血小板数減少 66.7% (0%)
- 食欲不振 33.3% (0%)
- 羞明 16.7% (16.7%)
- 高血糖 16.7% (16.7%)
- 粘膜炎 33.3% (16.7%)
J Dermatol. 2014 Jun;41(6):494-7³⁾より引用
エキスパートによるワンポイント
免疫療法に不応・不適な場合の選択肢
根治切除不能な局所進行または遠隔転移を有する有棘細胞癌に用いられることがある。 2024年2月にニボルマブが上皮系皮膚悪性腫瘍に承認されてからは、 ニボルマブに不応または自己免疫疾患を合併し免疫抑制剤を服用中等の理由で免疫療法が適さない患者に用いられる。 進行期の有棘細胞癌に用いられる全身薬物療法の中で、 唯一の経口薬である。
⚠2024/8/5時点で、 S-1は有棘細胞癌に対して本邦適応外薬
投与スケジュール
有棘細胞癌では、 A法を用いる。 用法・用量は、 初回投与量 (1回量) を体表面積に合わせた基準量とし (体表面積1.25m²未満は40mg/回、 1.25以上1.5m²未満は50mg/回、 1.5m²以上は60mg/回)、 朝夕食後の1日2回、 28日間連日経口投与し、 その後14日間休薬する。 これを1コースとして、 臨床効果が得られなくなるか、 許容できない副作用が発生するまで投与を繰り返す¹⁾。
⚠2024/8/5時点で、 S-1は有棘細胞癌に対して本邦適応外薬
Grade4の血液毒性やGrade3以上の非血液毒性をきたした場合、 次コースからは適宜減量する。 空腹時に内服すると抗腫瘍効果が減弱する可能性があり、 食後投与が望ましい。
臨床試験と奏効割合
これまでに、 有棘細胞癌を対象にS-1療法が検証的な臨床試験で評価されたことはない。
Ogataらは、 有棘細胞癌に対する全身薬物療法の国内データを集計し、 S-1療法が投与された23例における奏効割合は30% (CR3例、 PR4例) であったと報告している ⁴⁾。
Izumiらは、 頭頚部領域に生じた局所進行有棘細胞癌14例に対してS-1療法を行い、 奏効割合は78% (CR9例、 PR2例) であったと報告している⁵⁾。
副作用とその対策
S-1は、 テガフール、 ギメラシル、 オテラシルカリウムの3成分を1 : 0.4 : 1の比で配合したフッ化ピリミジン系抗悪性腫瘍剤である。 テガフールはフルオロウラシル (5-FU) のプロドラッグで、 経口投与後に5-FUに変換される。 ギメラシルは5-FUを不活化する酵素を強く阻害することにより、 5-FUの腫瘍内での濃度を維持する。
オテラシルカリウムは消化管粘膜に分布し、 下痢などの消化器毒性を軽減する。 重篤な腎障害のある患者では、 ギメラシルの腎排泄が著しく低下し血中フルオロウラシル濃度が上昇して骨髄抑制等の副作用が強く出るため、 投与禁忌である。 テガフールは粘膜障害 (口内炎、 下痢、 消化管潰瘍など) を生じやすい。 ワルファリンの作用を増強するため、 ワルファリン内服中の患者では出血症状の出現に注意し、 採血時に凝固能 (PT-INR) も確認する。 肝障害にも注意が必要である。 古典的な手足症候群、 色素沈着などを生じることがある。
出典
- 大鵬薬品工業株式会社 . ティーエスワン®電子添文 (2025年1月改訂 第4版) [最終閲覧 : 2025/04/08]
- 大鵬薬品工業株式会社 . ティーエスワン®適正使用ガイド [最終閲覧 : 2025/04/08]
- Oral S-1 in advanced cutaneous squamous cell carcinoma. J Dermatol. 2014 Jun;41(6):494-7. PMID: 24814954
- Systemic treatment of patients with advanced cutaneous squamous cell carcinoma: response rates and outcomes of the regimes used. Eur J Cancer. 2020 Mar:127:108-117. PMID: 32004792
- Favorable efficacy of S-1 treatment for locoregionally advanced cutaneous squamous cell carcinoma in the head and neck region. J Dermatol. 2024 Feb;51(2):271-279. PMID: 38009848
最終更新日 : 2025年4月8日
監修医師 : 国立がん研究センター中央病院 皮膚腫瘍科 医長 並川 健二郎先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。