本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
PARP阻害薬 オラパリブ *MSD株式会社の外部サイトへ遷移
*中外製薬株式会社の外部サイトへ遷移します
投与スケジュール
PAOLA-1試験⁵⁾のプロトコル
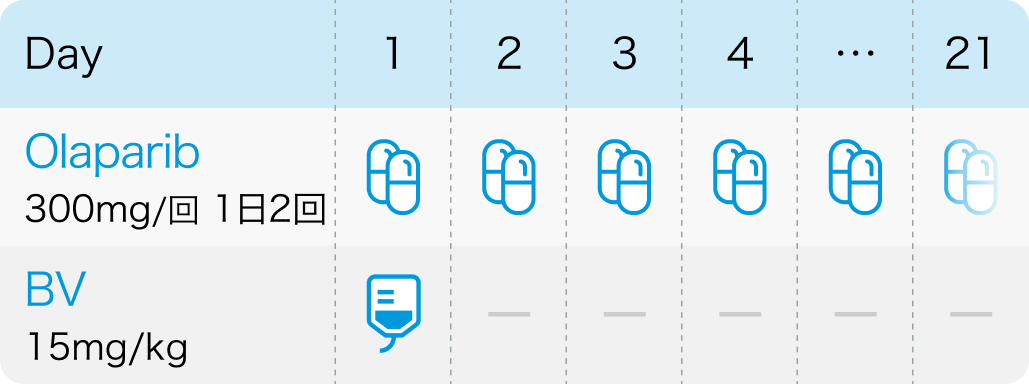
N Engl J Med. 2019 Dec 19;381(25):2416-2428⁵⁾より作図
電子添文の用法用量は以下のとおり
オラパリブ*は1回300mgを1日2回、 経口投与。 ベバシズマブは、 1回10mg/kgを2週間間隔または1回15mg/kgを3週間間隔で点滴静脈内注射する。
*100mg錠と150mg錠の生物学的同等性は示されていないため、 300mgを投与する際には100mg錠を使用しないこと
各プロトコル
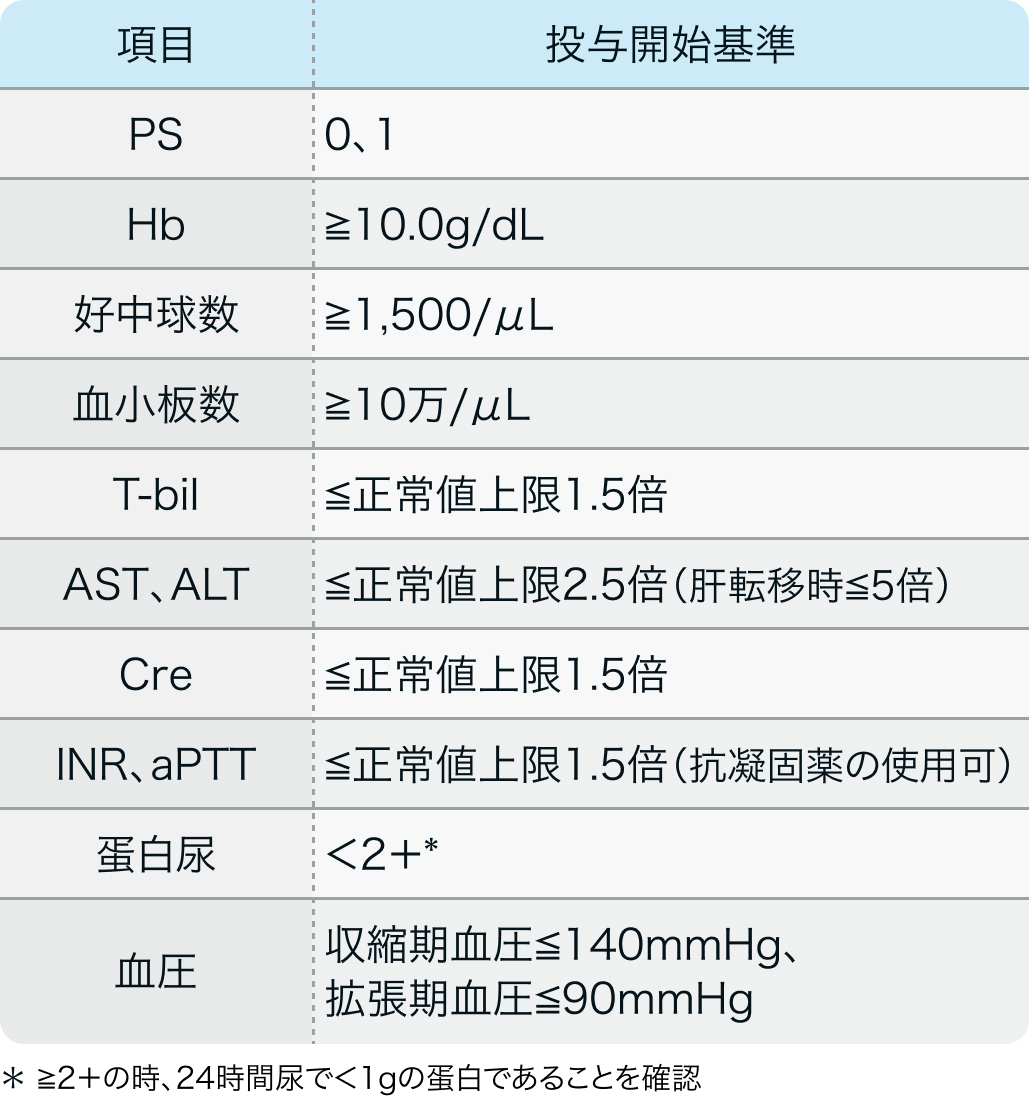
投与開始基準
PAOLA-1試験¹⁾のプロトコル例
卵巣癌、 原発性腹膜癌、 卵管癌と診断された18歳以上の以下に該当する患者
電子添文の記載
<白金系抗悪性腫瘍剤感受性の再発卵巣癌における維持療法> 再発時の白金系抗悪性腫瘍剤を含む化学療法で奏効が維持されている患者>
国際産婦人科連合 (FIGO) 進行期分類III期またはIV期の卵巣癌と診断され、 白金系抗悪性腫瘍剤を含む初回化学療法で奏効が維持されている患者。また、 承認された体外診断用医薬品または医療機器を用いた検査により、 BRCA遺伝子変異を有することが確認された患者
減量・休薬・中止基準
オラパリブ電子添文¹⁾の用法および用量

リムパーザ®電子添文 (2024年11月改訂 第6版)¹⁾より作図
KeyData|臨床試験結果
PAOLA-1試験⁵⁾
対象: 新たに悪性度の高い進行卵巣癌と診断され、 プラチナ製剤+タキサン系薬による化学療法にBVを追加した一次治療後に奏効が得られている患者806例
方法: Olaparib + BV群 vs placebo + BV群
【有効性】Olaparib + BV群
- mPFS 22.1ヵ月
【安全性】主な有害事象(カッコ内はGrade3~4)
- 倦怠感または無力症 52.9% (5.2%)
- 悪心 53.3% (2.4%)
- 貧血 40.9% (17.4%)
- リンパ球数減少 23.6% (7.1%)
- 嘔吐 21.9% (1.5%)
- 下痢 18.3% (2.2%)
- 好中球数減少 17.8% (6.0%)
- 白血球数減少 17.8% (1.9%)
- 便秘 9.9% (0%)
- 血小板数減少 7.9% (1.7%)
- 高血圧 45.8% (18.7%)
- 蛋白尿 5.8% (0.9%)
N Engl J Med. 2019 Dec 19;381(25):2416-2428⁵⁾より引用
エキスパートによるワンポイント
PAOLA-1試験の結果
初回化学療法後の維持療法としてのOlaparib + BVは、 Placebo + BVと比較した第Ⅲ相試験 (PAOLA-1試験) の結果、 プライマリーエンドポイントの無増悪生存期間 (PFS) を有意に延長させました⁵⁾。
その後報告された全生存期間 (OS) の結果は、 ITT群では、 有意差はありませんでした (HR=0.92, 95%CI 0.76-1.12, p=0.4118)⁶⁾。
サブグループ解析で、 HRD陽性群で、 OSが良好な結果でした (HR=0.62, 95%CI 0.45-0.85)⁶⁾。
したがって、 上皮性卵巣癌 (高異形度漿液性腺癌、 類内膜腺癌) でHRD陽性例に関しては、 維持療法のOlaparib + BVはベネフィットがありそう、 という解釈がなされると思います。
OlaparibとBVの併用効果
PAOLA-1試験⁵⁾は、 維持療法で、 両群ともに、 BVが入っていますので、 OlaparibとBVの併用をすることが、 相加効果や相乗効果を示すかどうかは明らかになっていません。
術後維持療法でOlaparib + BVの対象
PAOLA-1試験⁵⁾の選択基準では、 初回化学療法で、 BVを2サイクル以上併用した患者に限っていますので、 術後維持療法で、 Olaparib + BVを考慮する対象としては、 初回化学療法にBVを併用した患者さん、 HRD陽性患者さんに考慮すべきであろうと思われます。
監修 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
出典
- MSD株式会社. リムパーザ®電子添文 (2024年11月改訂第6版) [最終閲覧 : 2024/12/13]
- MSD株式会社. リムパーザ®適正使用ガイド 乳癌 (2024年3月作成) [最終閲覧 : 2024/12/13]
- 中外製薬株式会社. アバスチン®電子添文 (2024年3月改訂 第5版) [最終閲覧 : 2024/12/13]
- 中外製薬株式会社. アバスチン®適正使用ガイド (2024年5月作成) [最終閲覧 : 2024/12/13]
- Olaparib plus Bevacizumab as First-Line Maintenance in Ovarian Cancer. N Engl J Med. 2019 Dec 19;381(25):2416-2428. PMID: 31851799
- Olaparib plus bevacizumab first-line maintenance in ovarian cancer: final overall survival results from the PAOLA-1/ENGOT-ov25 trial. Ann Oncol. 2023 Aug;34(8):681-692. PMID: 37211045
最終更新日 : 2024年12月13日
監修医師 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
Olaparib + BV
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
PARP阻害薬 オラパリブ *MSD株式会社の外部サイトへ遷移
*中外製薬株式会社の外部サイトへ遷移します
投与スケジュール
PAOLA-1試験⁵⁾のプロトコル

N Engl J Med. 2019 Dec 19;381(25):2416-2428⁵⁾より作図
電子添文の用法用量は以下のとおり
オラパリブ*は1回300mgを1日2回、 経口投与。 ベバシズマブは、 1回10mg/kgを2週間間隔または1回15mg/kgを3週間間隔で点滴静脈内注射する。
*100mg錠と150mg錠の生物学的同等性は示されていないため、 300mgを投与する際には100mg錠を使用しないこと
各プロトコル
投与開始基準
PAOLA-1試験¹⁾のプロトコル例
卵巣癌、 原発性腹膜癌、 卵管癌と診断された18歳以上の以下に該当する患者

電子添文の記載
<白金系抗悪性腫瘍剤感受性の再発卵巣癌における維持療法> 再発時の白金系抗悪性腫瘍剤を含む化学療法で奏効が維持されている患者>
国際産婦人科連合 (FIGO) 進行期分類III期またはIV期の卵巣癌と診断され、 白金系抗悪性腫瘍剤を含む初回化学療法で奏効が維持されている患者。また、 承認された体外診断用医薬品または医療機器を用いた検査により、 BRCA遺伝子変異を有することが確認された患者
減量・休薬・中止基準
オラパリブ電子添文¹⁾の用法および用量

リムパーザ®電子添文 (2024年11月改訂 第6版)¹⁾より作図
KeyData|臨床試験結果
PAOLA-1試験⁵⁾
対象: 新たに悪性度の高い進行卵巣癌と診断され、 プラチナ製剤+タキサン系薬による化学療法にBVを追加した一次治療後に奏効が得られている患者806例
方法: Olaparib + BV群 vs placebo + BV群
【有効性】Olaparib + BV群
- mPFS 22.1ヵ月
【安全性】主な有害事象(カッコ内はGrade3~4)
- 倦怠感または無力症 52.9% (5.2%)
- 悪心 53.3% (2.4%)
- 貧血 40.9% (17.4%)
- リンパ球数減少 23.6% (7.1%)
- 嘔吐 21.9% (1.5%)
- 下痢 18.3% (2.2%)
- 好中球数減少 17.8% (6.0%)
- 白血球数減少 17.8% (1.9%)
- 便秘 9.9% (0%)
- 血小板数減少 7.9% (1.7%)
- 高血圧 45.8% (18.7%)
- 蛋白尿 5.8% (0.9%)
N Engl J Med. 2019 Dec 19;381(25):2416-2428⁵⁾より引用
エキスパートによるワンポイント
PAOLA-1試験の結果
初回化学療法後の維持療法としてのOlaparib + BVは、 Placebo + BVと比較した第Ⅲ相試験 (PAOLA-1試験) の結果、 プライマリーエンドポイントの無増悪生存期間 (PFS) を有意に延長させました⁵⁾。
その後報告された全生存期間 (OS) の結果は、 ITT群では、 有意差はありませんでした (HR=0.92, 95%CI 0.76-1.12, p=0.4118)⁶⁾。
サブグループ解析で、 HRD陽性群で、 OSが良好な結果でした (HR=0.62, 95%CI 0.45-0.85)⁶⁾。
したがって、 上皮性卵巣癌 (高異形度漿液性腺癌、 類内膜腺癌) でHRD陽性例に関しては、 維持療法のOlaparib + BVはベネフィットがありそう、 という解釈がなされると思います。
OlaparibとBVの併用効果
PAOLA-1試験⁵⁾は、 維持療法で、 両群ともに、 BVが入っていますので、 OlaparibとBVの併用をすることが、 相加効果や相乗効果を示すかどうかは明らかになっていません。
術後維持療法でOlaparib + BVの対象
PAOLA-1試験⁵⁾の選択基準では、 初回化学療法で、 BVを2サイクル以上併用した患者に限っていますので、 術後維持療法で、 Olaparib + BVを考慮する対象としては、 初回化学療法にBVを併用した患者さん、 HRD陽性患者さんに考慮すべきであろうと思われます。
監修 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
出典
- MSD株式会社. リムパーザ®電子添文 (2024年11月改訂第6版) [最終閲覧 : 2024/12/13]
- MSD株式会社. リムパーザ®適正使用ガイド 乳癌 (2024年3月作成) [最終閲覧 : 2024/12/13]
- 中外製薬株式会社. アバスチン®電子添文 (2024年3月改訂 第5版) [最終閲覧 : 2024/12/13]
- 中外製薬株式会社. アバスチン®適正使用ガイド (2024年5月作成) [最終閲覧 : 2024/12/13]
- Olaparib plus Bevacizumab as First-Line Maintenance in Ovarian Cancer. N Engl J Med. 2019 Dec 19;381(25):2416-2428. PMID: 31851799
- Olaparib plus bevacizumab first-line maintenance in ovarian cancer: final overall survival results from the PAOLA-1/ENGOT-ov25 trial. Ann Oncol. 2023 Aug;34(8):681-692. PMID: 37211045
最終更新日 : 2024年12月13日
監修医師 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。