本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*小野薬品工業株式会社の外部サイトへ遷移します
*小野薬品工業株式会社の外部サイトへ遷移します
用法用量
COLUMBUS試験⁴⁾、電子添文¹⁾³⁾のプロトコル
BRAF遺伝子変異を有する根治切除不能な悪性黒色腫
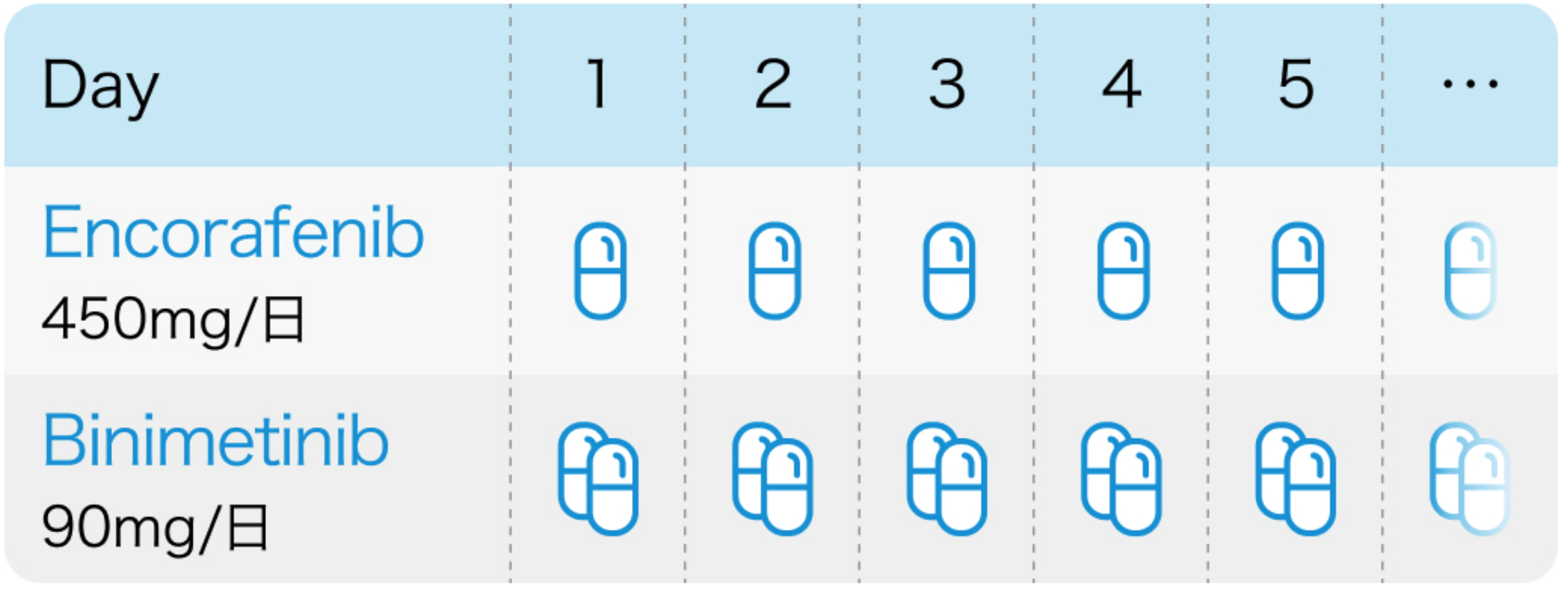
Lancet Oncol. 2018 May;19(5):603-615⁴⁾、 ビラフトビ®電子添文 (2024年5月改訂 第6版)¹⁾およびメクトビ®電子添文 (2024年5月改訂 第3版)³⁾より作図
減量・休薬・中止基準
エンコラフェニブ電子添文¹⁾の基準

ビラフトビ®電子添文 (2024年5月改訂第6版)¹⁾より作図
ビニメチニブ電子添文³⁾の基準
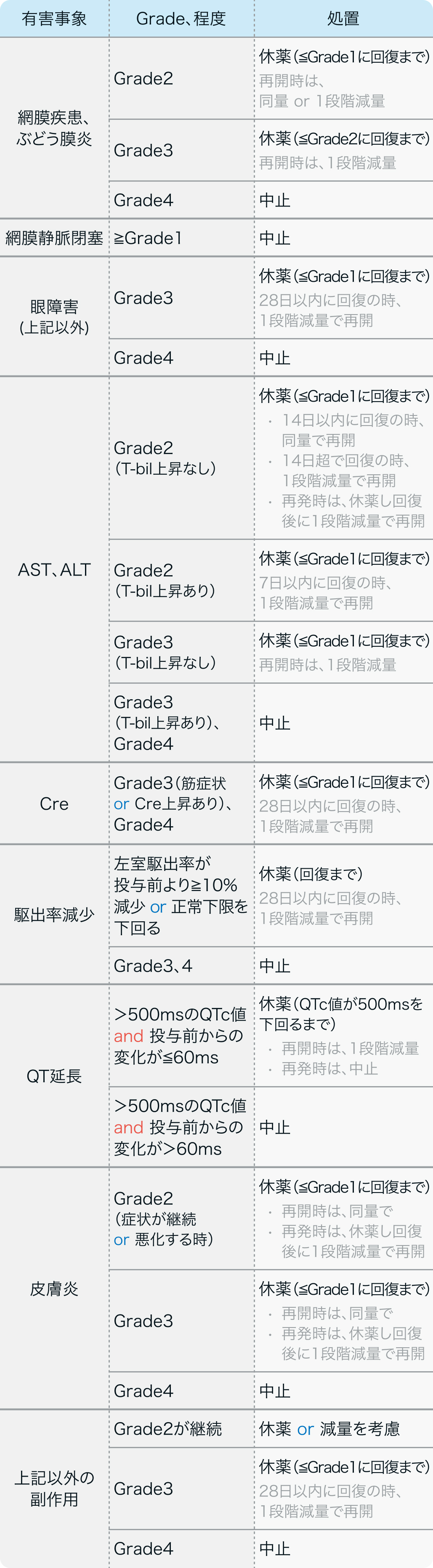
メクトビ®電子添文 (2024年5月改訂第3版)³⁾より作図
初回基準量と減量レベル
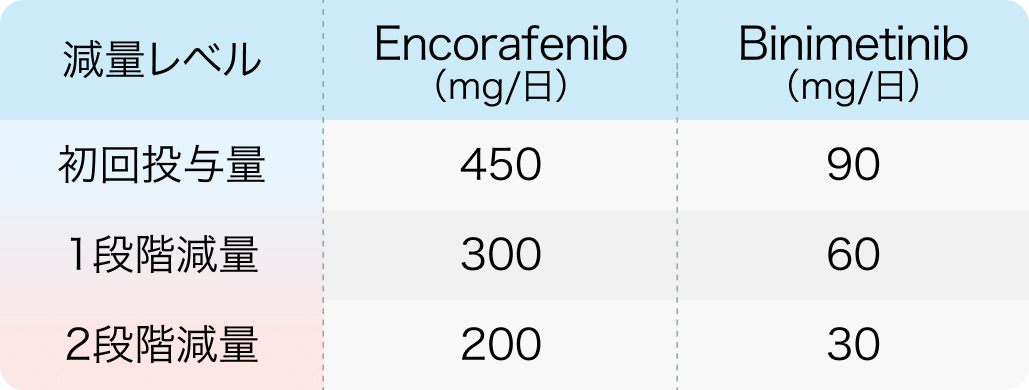
ビラフトビ®電子添文 (2024年5月改訂 第6版)¹⁾およびメクトビ®電子添文 (2024年5月改訂 第3版)³⁾より作図
主な有害事象
COLUMBUS試験⁴⁾
主な有害事象 (カッコ内はGrade3~4)
- 貧血 15.1% (4.2%)
- ALT上昇 10.9% (5.2%)
- 悪心 41.1% (1.6%)
- 下痢 36.5% (2.6%)
- 嘔吐 29.7% (1.6%)
- 倦怠感 28.6% (2.1%)
- 高CK血症 22.9% (6.8%)
- 便秘 21.9% (0%)
- 発熱 18.2% (3.6%)
- 脱毛症 13.5% (0%)
- 高血圧 10.9% (5.7%)
- 食欲減退 8.3% (0%)
- 手掌足底発赤知覚不全症候群 6.8% (0%)
Lancet Oncol. 2018 May;19(5):603-615⁴⁾より引用
エキスパートによるワンポイント
悪性黒色腫患者に対する適応と機序
BRAFV600遺伝子変異を有する根治切除不能な悪性黒色腫患者に用いられる。
💊 エンコラフェニブ
ヒト変異型BRAF (V600E) のキナーゼ活性化を阻害し、 BRAFV6000遺伝子変異を有するヒト悪性黒色腫細胞においてMEKおよびERKのリン酸化を阻害することで増殖抑制作用を発揮するBRAF阻害剤である。
エンコラフェニブ450mgを1日1回経口投与する。 なお、 患者の状態により適宜減量する。
エンコラフェニブ単独投与時の忍容性を検討した臨床試験では、 1日1回450mg投与はエンコラフェニブの最大体制用量を上回る可能性が示唆されている。
💊 ビニメチニブ
MEK1と2の活性化とキナーゼ活性を阻害しBRAF V600変異を有するヒト悪性黒色腫細胞およびヒトCRC細胞においてERKのリン酸化を阻害することで増殖抑制作用を発揮するMEK阻害剤である。
ビニメチニブ45mgを1日2回経口投与する。 なお、 患者の状態により適宜減量する。
これら2剤の併用療法によってBRAF、 MEKという2つの作用点を阻害することで強力に腫瘍増殖を阻害し、 薬剤耐性発現を遅らせると考えられている。 このような理由で通常は単剤ではなく2剤の併用療法が行われる。
エンコラフェニブを休薬または中止した場合にはビニメチニブを、 ビニメチニブを休薬または中止した場合にはエンコラフェニブの減量を、 それぞれ考慮するとともに、 患者の状態を慎重に観察し、 副作用の発現に十分注意すること。
COLUMBUS試験Part1⁴⁾⁵⁾の結果
切除不能もしくは転移性BRAF変異陽性悪性黒色腫患者に対して行われた多施設国際共同ランダム化非盲検第III相試験である。 本試験では、 COMBO 450群 (エンコラフェニブ450mg1日1回、 ビニメチニブとして45mg1日2回内服する群) は、 BRAF遺伝子変異陽性の進行期悪性黒色腫において、 エンコラフェニブ300mg1日1回内服群、 ベムラフェニブ960mg1日1回内服群と比較して主要評価項目である無増悪生存期間 (PFS) および全生存期間 (OS) を有意に延長し、 有意に高い奏効率 (ORR)、 奏効期間中央値 (mDOR) を示した。
COMBO450群 vs ベムラフェニブ単剤群
- mPFS:14.9ヵ月 vs 7.3ヵ月
- mOS :33.6ヵ月 vs 16.9ヵ月
- ORR :63% vs 40%
- mDOR:16.6ヵ月 vs 12.3ヵ月
眼障害などの副作用とその対策
COLUMBUS試験Part1での副作用の発現率は以下のとおりであった。
- COMBO 450群 :88.8%
- エンコラフェニブ群:99.5%
- ベムラフェニブ群 :96.8%
主な副作用は、 COMBO 450群で悪心30.7% (59例)、 下痢27.1% (52例)、 疲労25.0% (48例)、 血中CK (CPK) 増加21.4% (41例) であった。
左室駆出率低下は8%と報告されている。 また特殊な副作用として眼障害の発生率が全Gradeにおいて40.6%と報告されている。 その多くが漿液性網膜剥離であり、 投与開始後比較的早期におこる。 原則として自然治癒することが多いが患者の訴えがあれば眼科医受診が無難である。
監修 : 国立がん研究センター中央病院皮膚腫瘍科長 山崎直也先生
出典
- 小野薬品工業株式会社. ビラフトビ®電子添文 (2024年1月改訂第5版) [最終閲覧 : 2024/03/07]
- 小野薬品工業株式会社. ビラフトビ®、メクトビ®適正使用ガイド(2024年5月作成) [最終閲覧 2024/3/6]
- 小野薬品工業株式会社. メクトビ®電子添文 (2024年1月改訂第2版) [最終閲覧 : 2024/03/07]
- Encorafenib plus binimetinib versus vemurafenib or encorafenib in patients with BRAF-mutant melanoma (COLUMBUS): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol. 2018 May;19(5):603-615. PMID: 29573941
- Overall survival in patients with BRAF-mutant melanoma receiving encorafenib plus binimetinib versus vemurafenib or encorafenib (COLUMBUS): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol. 2018 Oct;19(10):1315-1327. PMID: 30219628
最終更新日 : 2024年7月29日
監修医師 : 国立がん研究センター中央病院皮膚腫瘍科長 山崎直也先生
Encorafenib + Binimetinib
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*小野薬品工業株式会社の外部サイトへ遷移します
*小野薬品工業株式会社の外部サイトへ遷移します
用法用量
COLUMBUS試験⁴⁾、電子添文¹⁾³⁾のプロトコル
BRAF遺伝子変異を有する根治切除不能な悪性黒色腫

Lancet Oncol. 2018 May;19(5):603-615⁴⁾、 ビラフトビ®電子添文 (2024年5月改訂 第6版)¹⁾およびメクトビ®電子添文 (2024年5月改訂 第3版)³⁾より作図
減量・休薬・中止基準
エンコラフェニブ電子添文¹⁾の基準

ビラフトビ®電子添文 (2024年5月改訂第6版)¹⁾より作図
ビニメチニブ電子添文³⁾の基準

メクトビ®電子添文 (2024年5月改訂第3版)³⁾より作図
初回基準量と減量レベル

ビラフトビ®電子添文 (2024年5月改訂 第6版)¹⁾およびメクトビ®電子添文 (2024年5月改訂 第3版)³⁾より作図
主な有害事象
COLUMBUS試験⁴⁾
主な有害事象 (カッコ内はGrade3~4)
- 貧血 15.1% (4.2%)
- ALT上昇 10.9% (5.2%)
- 悪心 41.1% (1.6%)
- 下痢 36.5% (2.6%)
- 嘔吐 29.7% (1.6%)
- 倦怠感 28.6% (2.1%)
- 高CK血症 22.9% (6.8%)
- 便秘 21.9% (0%)
- 発熱 18.2% (3.6%)
- 脱毛症 13.5% (0%)
- 高血圧 10.9% (5.7%)
- 食欲減退 8.3% (0%)
- 手掌足底発赤知覚不全症候群 6.8% (0%)
Lancet Oncol. 2018 May;19(5):603-615⁴⁾より引用
エキスパートによるワンポイント
悪性黒色腫患者に対する適応と機序
BRAFV600遺伝子変異を有する根治切除不能な悪性黒色腫患者に用いられる。
💊 エンコラフェニブ
ヒト変異型BRAF (V600E) のキナーゼ活性化を阻害し、 BRAFV6000遺伝子変異を有するヒト悪性黒色腫細胞においてMEKおよびERKのリン酸化を阻害することで増殖抑制作用を発揮するBRAF阻害剤である。
エンコラフェニブ450mgを1日1回経口投与する。 なお、 患者の状態により適宜減量する。
エンコラフェニブ単独投与時の忍容性を検討した臨床試験では、 1日1回450mg投与はエンコラフェニブの最大体制用量を上回る可能性が示唆されている。
💊 ビニメチニブ
MEK1と2の活性化とキナーゼ活性を阻害しBRAF V600変異を有するヒト悪性黒色腫細胞およびヒトCRC細胞においてERKのリン酸化を阻害することで増殖抑制作用を発揮するMEK阻害剤である。
ビニメチニブ45mgを1日2回経口投与する。 なお、 患者の状態により適宜減量する。
これら2剤の併用療法によってBRAF、 MEKという2つの作用点を阻害することで強力に腫瘍増殖を阻害し、 薬剤耐性発現を遅らせると考えられている。 このような理由で通常は単剤ではなく2剤の併用療法が行われる。
エンコラフェニブを休薬または中止した場合にはビニメチニブを、 ビニメチニブを休薬または中止した場合にはエンコラフェニブの減量を、 それぞれ考慮するとともに、 患者の状態を慎重に観察し、 副作用の発現に十分注意すること。
COLUMBUS試験Part1⁴⁾⁵⁾の結果
切除不能もしくは転移性BRAF変異陽性悪性黒色腫患者に対して行われた多施設国際共同ランダム化非盲検第III相試験である。 本試験では、 COMBO 450群 (エンコラフェニブ450mg1日1回、 ビニメチニブとして45mg1日2回内服する群) は、 BRAF遺伝子変異陽性の進行期悪性黒色腫において、 エンコラフェニブ300mg1日1回内服群、 ベムラフェニブ960mg1日1回内服群と比較して主要評価項目である無増悪生存期間 (PFS) および全生存期間 (OS) を有意に延長し、 有意に高い奏効率 (ORR)、 奏効期間中央値 (mDOR) を示した。
COMBO450群 vs ベムラフェニブ単剤群
- mPFS:14.9ヵ月 vs 7.3ヵ月
- mOS :33.6ヵ月 vs 16.9ヵ月
- ORR :63% vs 40%
- mDOR:16.6ヵ月 vs 12.3ヵ月
眼障害などの副作用とその対策
COLUMBUS試験Part1での副作用の発現率は以下のとおりであった。
- COMBO 450群 :88.8%
- エンコラフェニブ群:99.5%
- ベムラフェニブ群 :96.8%
主な副作用は、 COMBO 450群で悪心30.7% (59例)、 下痢27.1% (52例)、 疲労25.0% (48例)、 血中CK (CPK) 増加21.4% (41例) であった。
左室駆出率低下は8%と報告されている。 また特殊な副作用として眼障害の発生率が全Gradeにおいて40.6%と報告されている。 その多くが漿液性網膜剥離であり、 投与開始後比較的早期におこる。 原則として自然治癒することが多いが患者の訴えがあれば眼科医受診が無難である。
監修 : 国立がん研究センター中央病院皮膚腫瘍科長 山崎直也先生
出典
- 小野薬品工業株式会社. ビラフトビ®電子添文 (2024年1月改訂第5版) [最終閲覧 : 2024/03/07]
- 小野薬品工業株式会社. ビラフトビ®、メクトビ®適正使用ガイド(2024年5月作成) [最終閲覧 2024/3/6]
- 小野薬品工業株式会社. メクトビ®電子添文 (2024年1月改訂第2版) [最終閲覧 : 2024/03/07]
- Encorafenib plus binimetinib versus vemurafenib or encorafenib in patients with BRAF-mutant melanoma (COLUMBUS): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol. 2018 May;19(5):603-615. PMID: 29573941
- Overall survival in patients with BRAF-mutant melanoma receiving encorafenib plus binimetinib versus vemurafenib or encorafenib (COLUMBUS): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol. 2018 Oct;19(10):1315-1327. PMID: 30219628
最終更新日 : 2024年7月29日
監修医師 : 国立がん研究センター中央病院皮膚腫瘍科長 山崎直也先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。