Nivolumab:ニボルマブ(オプジーボ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 80mg/body 点滴 | 1~ | Day1, 22, 43, 64 |
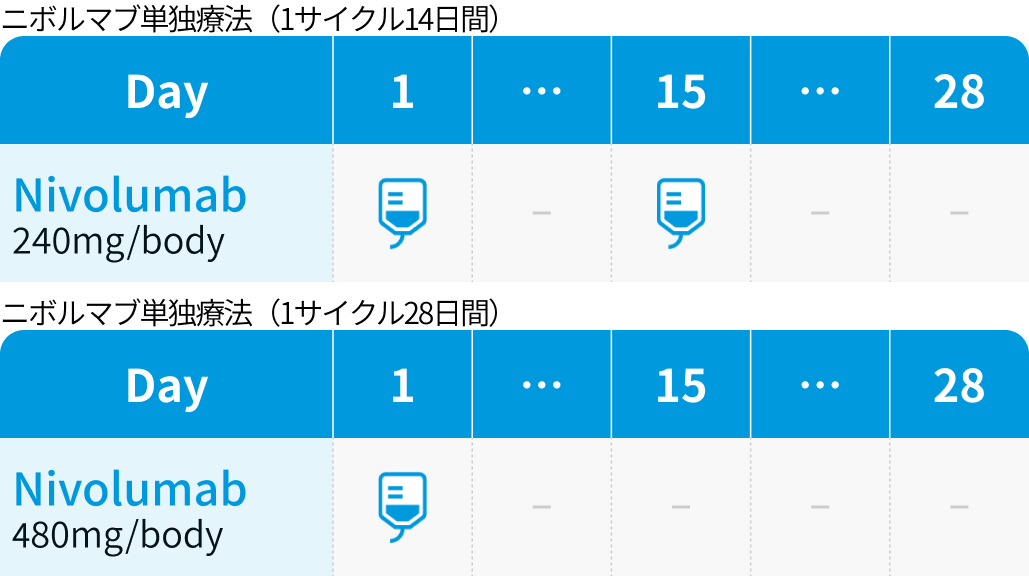
| 240mg/body 点滴 | 5~ (2週間間隔の場合) | Day1 |
| 480mg/body 点滴 | 5~ (4週間間隔の場合) | Day1 |
IPI:イピリムマブ(ヤーボイ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 3mg/kg 点滴 | 1~4 | Day1, 22, 43, 64 |
その他
| ニボルマブ・イピリムマブ併用療法として、 3週間間隔で4回点滴静注。 その後、 ニボルマブ単独療法として、 2週間間隔又は4週間間隔で点滴静注。 |
2025年6月24日、「切除不能な肝細胞癌」 への適応で新たに承認
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*小野薬品工業株式会社の外部サイトへ遷移します
*小野薬品工業株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】 併用: 3週間、 単独: 2又は4週間
【催吐性】 最小度
【FN発症】 未報告*
*CheckMate-9DW試験⁴⁾
ニボルマブ・イピリムマブ併用療法 4サイクル (21日/サイクル)
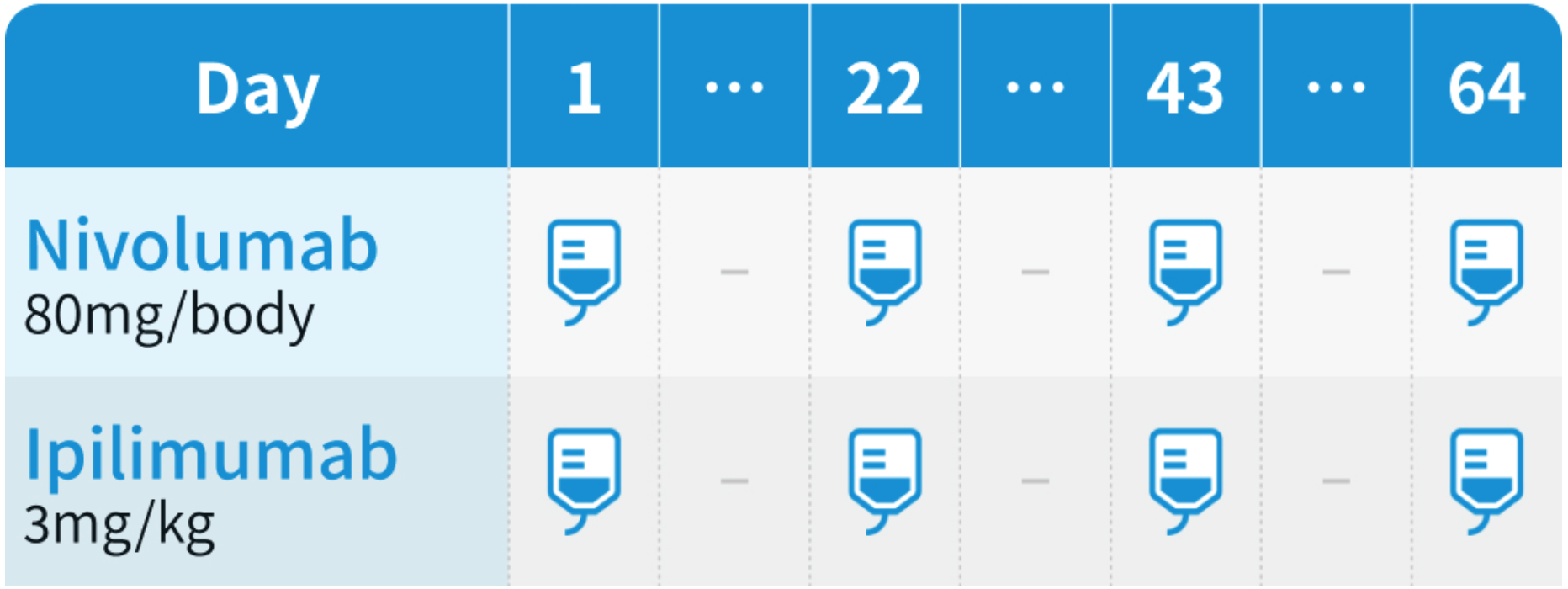
その後、ニボルマブ単独療法 (2週間隔または4週間隔)
ニボルマブ・イピリムマブ併用療法として、 ニボルマブ80mgおよびイピリムマブ3mg/kgを3週間間隔で4回点滴静注。 その後、 ニボルマブ単独療法として、 240mgを2週間間隔又は480mgを4週間間隔で点滴静注。
Key Data|臨床試験結果
📊 CheckMate 9DW試験
Lancet. 2025;405(10492):1851-1864.
未治療の切除不能な肝細胞癌患者668例を対象とした、 国際共同の非盲検無作為化第III相比較試験。 ニボルマブ+イピリムマブ群335例とレンバチニブ又はソラフェニブ群 (TKI群) 333例に、 1:1の比率で無作為に割り付け、 主要評価項目としてOSが設定された。
【有効性】 ニボルマブ+イピリムマブ群 (vs TKI群)
- OS中央値 : 23.7ヵ月 (vs. 20.6ヵ月)
- 24ヵ月時点のOS率 : 49% (vs 39%)
- 36ヵ月時点のOS率 : 38% (vs 24%)
OSのKaplan–Meier曲線では、 初期6ヵ月間にニボルマブ+イピリムマブ群で死亡数がやや多かったものの (HR 1.65)、 以降は同群で生存期間が延長する傾向が示され、 曲線の分離が持続した (HR 0.61)。
- 客観的奏効率 : 36% (13%)
- 完全奏効率 : 7% (vs 2%)
- 奏効期間中央値 : 30.4ヵ月 (vs 12.9ヵ月)
- PFS中央値 : 9.1ヵ月 (vs 9.2ヵ月)
【安全性】主な有害事象 : Grade1-2 (Grade≧3)
- そう痒症 27% (2%)
- 皮疹 17% (2%)
- ALT増加 14% (5%)
- AST増加 14% (6%)
- 下痢 13% (1%)
- 甲状腺機能低下症 12% (0%)
- 無力症 10% (<1%)
- 甲状腺機能亢進症 10% (<1%)
- 食欲減退 7% (<1%)
- リパーゼ増加 6% (5%)
- 疲労 8% (0%)
- 悪心 6% (0%)
- 血中ビリルビン増加 4% (<1%)
- 体重減少 2% (0%)
- 大腸炎 2% (2%)
- 手足症候群 2% (0%)
- 高血圧 2% (0%)
- 血小板数減少 1% (0%)
- 高トランスアミナーゼ血症 <1% (1%)
- 好中球減少症 <1% (<1%)
- 免疫介在性肝炎 <1% (2%)
- 自己免疫性肝炎 <1% (2%)
- 血小板減少症 <1% (<1%)
- 発声障害 <1% (0%)
- 肝不全 0% (1%)
- 蛋白尿 0% (0%)
各プロトコル
適格基準
CheckMate 9DW試験⁴⁾の主な適格基準
- 18歳以上
- ECOG PS 0–1
- Child-Pughスコア5又は6
- 局所療法又は外科的療法が不適格、 又はこれらの治療後に進行
- 過去に全身療法を受けていない
- 肝機能 : 総ビリルビン≦3mg/dL、 AST/ALT≦5×ULN
- 腎機能 : 血清クレアチニン≦1.5×ULN又はCrCl>40mL/min
有害事象発現時の減量・休薬・中止基準
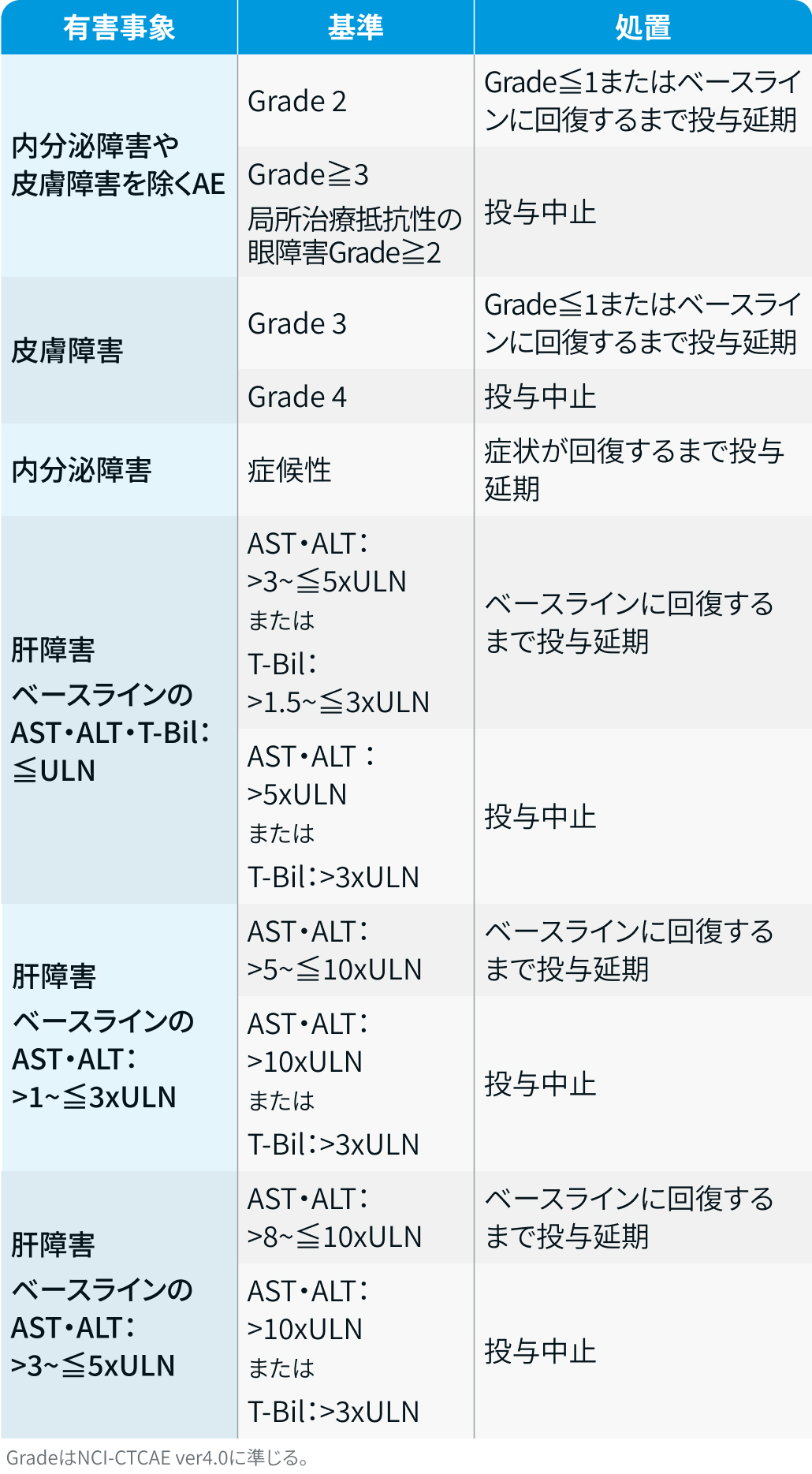
ヤーボイ®電子添文³⁾を基に編集部作成
レジメンの特徴と注意点
🧑⚕️NIVO+IPIはSTRIDEレジメン (デュルバルマブ+トレメリムマブ) と異なりCTLA-4抗体を継続併用するため、 奏効率・奏効持続は高い反面、 重度肝障害を含む免疫関連有害事象が増えます。 試験ではKM曲線の初期交差がみられ、 迅速な腫瘍縮小を要する症例ではアテゾリズマブ+ベバシズマブが適する場合もあります。 肝機能に余裕があり全身状態が良好な患者ではNIVO+IPIを選択肢としつつ、 患者背景を総合的に評価してレジメンを決定することが重要です。
神奈川県立がんセンター消化器内科部長 上野誠先生
作用機序の特徴
ニボルマブはPD-1に対する抗体で、 PD-L1/PD-L2との結合を阻害することでT細胞の活性化を促し、 腫瘍増殖を抑制すると考えられている。
イピリムマブはCTLA-4に対する抗体で、 B7分子との結合を阻害してT細胞の抑制的調節を解除し、 腫瘍特異的T細胞の活性化を促進する。 また、 Tregの機能低下および腫瘍内Treg数の減少により抗腫瘍免疫を強化する作用も示す。
レジメン適用時の注意事項¹⁾³⁾
経皮的エタノール注入療法、 ラジオ波焼灼療法、 マイクロ波凝固療法、 肝動脈塞栓療法/肝動脈化学塞栓療法、 放射線療法などの局所療法の適応となる肝細胞癌患者に対する本レジメンの有効性及び安全性は確立していない。
過度の免疫反応 : T細胞活性化作用により、 多様な疾患や病態があらわれることがある。 観察を十分に行い、 異常があれば鑑別診断を実施。 免疫反応による副作用が疑われる場合は、 副腎皮質ホルモン剤の投与等を考慮。
投与終了後の副作用 : 下痢、 大腸炎、 下垂体機能低下症等の重篤な副作用が投与終了から数ヵ月後に発現することがあり、 死亡例も報告されているため、 終了後も十分に観察し、 異常時は適切に対応。
肝機能障害 : 肝不全、 肝機能障害があらわれることがあるため、 定期的に肝機能検査を行い、 状態を確認。
内分泌障害 : 下垂体炎、 下垂体機能低下症、 甲状腺機能低下症、 副腎機能不全があらわれることがあるため、 TSH、 FT3、 FT4、 ACTH、 コルチゾール等を定期的に測定し、 必要に応じて画像検査を実施。
筋炎 : 筋力低下、 筋肉痛、 CK上昇等の兆候に注意し、 観察を十分に行う。
心筋炎 : 胸痛、 CK上昇、 心電図異常等を観察。
ぶどう膜炎 : 眼の異常を定期的に確認し、 異常があれば速やかな受診を指導。
間質性肺疾患 : 呼吸困難、 咳嗽、 発熱、 肺音異常 (捻髪音) などの症状や胸部X線所見を確認し、 必要に応じてCTや血清マーカーを実施。
神経・筋障害 : 重症筋無力症、 心筋炎、 筋炎、 横紋筋融解症があらわれることがあるため、 筋力低下、 眼瞼下垂、 呼吸困難、 嚥下障害、 CK上昇、 心電図異常、 ミオグロビン上昇を観察。
1型糖尿病 : 口渇、 悪心、 嘔吐、 血糖上昇に注意。
腎障害 : 定期的に腎機能検査を行い、 状態を観察。
Infusion reaction : 重度の反応に備え、 緊急対応可能な体制で投与を行い、 バイタルサイン等を観察。
- 妊娠の可能性がある女性には、 ニボルマブ投与中および最終投与後5ヵ月間、 イピリムマブ投与中および最終投与後3ヵ月間は避妊が必要であることを説明。
- ニボルマブは0.2又は0.22µmのインラインフィルターを使用し、 30分以上かけて点滴静注。
- イピリムマブは0.2~1.2µmのインラインフィルターを使用し、 30分かけて点滴静注。
RMP【重要な特定されたリスク】
オプジーボ®医薬品リスク管理計画書 (RMP)
- 間質性肺疾患
- 重症筋無力症、 心筋炎、 筋炎、 横紋筋融解症
- 大腸炎、 小腸炎、 重度の下痢
- 1型糖尿病
- 劇症肝炎、 肝不全、 肝機能障害、 肝炎、 硬化性胆管炎
- 内分泌障害 (甲状腺機能障害、 下垂体機能障害、 副腎障害)
- 神経障害
- 腎障害
- 脳炎、 髄膜炎、 脊髄炎
- 重度の皮膚障害
- 静脈血栓塞栓症
- Infusion reaction
- 重篤な血液障害
- 血球貪食症候群
- 結核
- 膵炎
- 重度の胃炎
- ぶどう膜炎
- 臓器移植歴 (造血幹細胞移植歴を含む) のある患者への使用
ヤーボイ®医薬品リスク管理計画書 (RMP)
- 下痢・大腸炎・消化管穿孔
- 肝障害
- 皮膚障害
- 下垂体炎・下垂体機能低下症・甲状腺機能低下症・副腎機能不全
- 末梢性ニューロパチー
- 腎障害
- 間質性肺疾患
- Infusion reaction
- 筋炎
- 心筋炎
- ぶどう膜炎
- 脳炎・髄膜炎・脊髄炎
- 臓器移植歴 (造血幹細胞移植歴を含む) のある患者における拒絶反応
出典
- 小野薬品工業株式会社, ブリストル・マイヤーズ スクイブ株式会社. オプジーボ®点滴静注20mg/100mg/120mg/240mg 電子添文. 2025年6月改訂 (第24版).
- 小野薬品工業株式会社, ブリストル・マイヤーズ スクイブ株式会社. 医薬品リスク管理計画 (RMP) オプジーボ®(ヤーボイ又は他の抗悪性腫瘍剤併用療法)・ヤーボイ 適正使用ガイド. 2025年6月作成
- 小野薬品工業株式会社, ブリストル・マイヤーズ スクイブ株式会社. ヤーボイ®点滴静注液20mg/50mg 添付文書. 2025年6月改訂 (第15版).
- Lancet. 2025;405(10492):1851-1864.
最終更新 : 2025年7月1日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : HOKUTO編集部監修医師
IPI + Nivo
Nivolumab:ニボルマブ(オプジーボ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 80mg/body 点滴 | 1~ | Day1, 22, 43, 64 |
| 240mg/body 点滴 | 5~ (2週間間隔の場合) | Day1 |
| 480mg/body 点滴 | 5~ (4週間間隔の場合) | Day1 |
IPI:イピリムマブ(ヤーボイ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 3mg/kg 点滴 | 1~4 | Day1, 22, 43, 64 |
その他
| ニボルマブ・イピリムマブ併用療法として、 3週間間隔で4回点滴静注。 その後、 ニボルマブ単独療法として、 2週間間隔又は4週間間隔で点滴静注。 |
概要
2025年6月24日、「切除不能な肝細胞癌」 への適応で新たに承認
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*小野薬品工業株式会社の外部サイトへ遷移します
*小野薬品工業株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】 併用: 3週間、 単独: 2又は4週間
【催吐性】 最小度
【FN発症】 未報告*
*CheckMate-9DW試験⁴⁾
ニボルマブ・イピリムマブ併用療法 4サイクル (21日/サイクル)

その後、ニボルマブ単独療法 (2週間隔または4週間隔)

ニボルマブ・イピリムマブ併用療法として、 ニボルマブ80mgおよびイピリムマブ3mg/kgを3週間間隔で4回点滴静注。 その後、 ニボルマブ単独療法として、 240mgを2週間間隔又は480mgを4週間間隔で点滴静注。
Key Data|臨床試験結果
📊 CheckMate 9DW試験
Lancet. 2025;405(10492):1851-1864.
未治療の切除不能な肝細胞癌患者668例を対象とした、 国際共同の非盲検無作為化第III相比較試験。 ニボルマブ+イピリムマブ群335例とレンバチニブ又はソラフェニブ群 (TKI群) 333例に、 1:1の比率で無作為に割り付け、 主要評価項目としてOSが設定された。
【有効性】 ニボルマブ+イピリムマブ群 (vs TKI群)
- OS中央値 : 23.7ヵ月 (vs. 20.6ヵ月)
- 24ヵ月時点のOS率 : 49% (vs 39%)
- 36ヵ月時点のOS率 : 38% (vs 24%)
OSのKaplan–Meier曲線では、 初期6ヵ月間にニボルマブ+イピリムマブ群で死亡数がやや多かったものの (HR 1.65)、 以降は同群で生存期間が延長する傾向が示され、 曲線の分離が持続した (HR 0.61)。
- 客観的奏効率 : 36% (13%)
- 完全奏効率 : 7% (vs 2%)
- 奏効期間中央値 : 30.4ヵ月 (vs 12.9ヵ月)
- PFS中央値 : 9.1ヵ月 (vs 9.2ヵ月)
【安全性】主な有害事象 : Grade1-2 (Grade≧3)
- そう痒症 27% (2%)
- 皮疹 17% (2%)
- ALT増加 14% (5%)
- AST増加 14% (6%)
- 下痢 13% (1%)
- 甲状腺機能低下症 12% (0%)
- 無力症 10% (<1%)
- 甲状腺機能亢進症 10% (<1%)
- 食欲減退 7% (<1%)
- リパーゼ増加 6% (5%)
- 疲労 8% (0%)
- 悪心 6% (0%)
- 血中ビリルビン増加 4% (<1%)
- 体重減少 2% (0%)
- 大腸炎 2% (2%)
- 手足症候群 2% (0%)
- 高血圧 2% (0%)
- 血小板数減少 1% (0%)
- 高トランスアミナーゼ血症 <1% (1%)
- 好中球減少症 <1% (<1%)
- 免疫介在性肝炎 <1% (2%)
- 自己免疫性肝炎 <1% (2%)
- 血小板減少症 <1% (<1%)
- 発声障害 <1% (0%)
- 肝不全 0% (1%)
- 蛋白尿 0% (0%)
各プロトコル
適格基準
CheckMate 9DW試験⁴⁾の主な適格基準
- 18歳以上
- ECOG PS 0–1
- Child-Pughスコア5又は6
- 局所療法又は外科的療法が不適格、 又はこれらの治療後に進行
- 過去に全身療法を受けていない
- 肝機能 : 総ビリルビン≦3mg/dL、 AST/ALT≦5×ULN
- 腎機能 : 血清クレアチニン≦1.5×ULN又はCrCl>40mL/min
有害事象発現時の減量・休薬・中止基準

ヤーボイ®電子添文³⁾を基に編集部作成
レジメンの特徴と注意点
🧑⚕️NIVO+IPIはSTRIDEレジメン (デュルバルマブ+トレメリムマブ) と異なりCTLA-4抗体を継続併用するため、 奏効率・奏効持続は高い反面、 重度肝障害を含む免疫関連有害事象が増えます。 試験ではKM曲線の初期交差がみられ、 迅速な腫瘍縮小を要する症例ではアテゾリズマブ+ベバシズマブが適する場合もあります。 肝機能に余裕があり全身状態が良好な患者ではNIVO+IPIを選択肢としつつ、 患者背景を総合的に評価してレジメンを決定することが重要です。
神奈川県立がんセンター消化器内科部長 上野誠先生
作用機序の特徴
ニボルマブはPD-1に対する抗体で、 PD-L1/PD-L2との結合を阻害することでT細胞の活性化を促し、 腫瘍増殖を抑制すると考えられている。
イピリムマブはCTLA-4に対する抗体で、 B7分子との結合を阻害してT細胞の抑制的調節を解除し、 腫瘍特異的T細胞の活性化を促進する。 また、 Tregの機能低下および腫瘍内Treg数の減少により抗腫瘍免疫を強化する作用も示す。
レジメン適用時の注意事項¹⁾³⁾
経皮的エタノール注入療法、 ラジオ波焼灼療法、 マイクロ波凝固療法、 肝動脈塞栓療法/肝動脈化学塞栓療法、 放射線療法などの局所療法の適応となる肝細胞癌患者に対する本レジメンの有効性及び安全性は確立していない。
過度の免疫反応 : T細胞活性化作用により、 多様な疾患や病態があらわれることがある。 観察を十分に行い、 異常があれば鑑別診断を実施。 免疫反応による副作用が疑われる場合は、 副腎皮質ホルモン剤の投与等を考慮。
投与終了後の副作用 : 下痢、 大腸炎、 下垂体機能低下症等の重篤な副作用が投与終了から数ヵ月後に発現することがあり、 死亡例も報告されているため、 終了後も十分に観察し、 異常時は適切に対応。
肝機能障害 : 肝不全、 肝機能障害があらわれることがあるため、 定期的に肝機能検査を行い、 状態を確認。
内分泌障害 : 下垂体炎、 下垂体機能低下症、 甲状腺機能低下症、 副腎機能不全があらわれることがあるため、 TSH、 FT3、 FT4、 ACTH、 コルチゾール等を定期的に測定し、 必要に応じて画像検査を実施。
筋炎 : 筋力低下、 筋肉痛、 CK上昇等の兆候に注意し、 観察を十分に行う。
心筋炎 : 胸痛、 CK上昇、 心電図異常等を観察。
ぶどう膜炎 : 眼の異常を定期的に確認し、 異常があれば速やかな受診を指導。
間質性肺疾患 : 呼吸困難、 咳嗽、 発熱、 肺音異常 (捻髪音) などの症状や胸部X線所見を確認し、 必要に応じてCTや血清マーカーを実施。
神経・筋障害 : 重症筋無力症、 心筋炎、 筋炎、 横紋筋融解症があらわれることがあるため、 筋力低下、 眼瞼下垂、 呼吸困難、 嚥下障害、 CK上昇、 心電図異常、 ミオグロビン上昇を観察。
1型糖尿病 : 口渇、 悪心、 嘔吐、 血糖上昇に注意。
腎障害 : 定期的に腎機能検査を行い、 状態を観察。
Infusion reaction : 重度の反応に備え、 緊急対応可能な体制で投与を行い、 バイタルサイン等を観察。
- 妊娠の可能性がある女性には、 ニボルマブ投与中および最終投与後5ヵ月間、 イピリムマブ投与中および最終投与後3ヵ月間は避妊が必要であることを説明。
- ニボルマブは0.2又は0.22µmのインラインフィルターを使用し、 30分以上かけて点滴静注。
- イピリムマブは0.2~1.2µmのインラインフィルターを使用し、 30分かけて点滴静注。
RMP【重要な特定されたリスク】
オプジーボ®医薬品リスク管理計画書 (RMP)
- 間質性肺疾患
- 重症筋無力症、 心筋炎、 筋炎、 横紋筋融解症
- 大腸炎、 小腸炎、 重度の下痢
- 1型糖尿病
- 劇症肝炎、 肝不全、 肝機能障害、 肝炎、 硬化性胆管炎
- 内分泌障害 (甲状腺機能障害、 下垂体機能障害、 副腎障害)
- 神経障害
- 腎障害
- 脳炎、 髄膜炎、 脊髄炎
- 重度の皮膚障害
- 静脈血栓塞栓症
- Infusion reaction
- 重篤な血液障害
- 血球貪食症候群
- 結核
- 膵炎
- 重度の胃炎
- ぶどう膜炎
- 臓器移植歴 (造血幹細胞移植歴を含む) のある患者への使用
ヤーボイ®医薬品リスク管理計画書 (RMP)
- 下痢・大腸炎・消化管穿孔
- 肝障害
- 皮膚障害
- 下垂体炎・下垂体機能低下症・甲状腺機能低下症・副腎機能不全
- 末梢性ニューロパチー
- 腎障害
- 間質性肺疾患
- Infusion reaction
- 筋炎
- 心筋炎
- ぶどう膜炎
- 脳炎・髄膜炎・脊髄炎
- 臓器移植歴 (造血幹細胞移植歴を含む) のある患者における拒絶反応
出典
- 小野薬品工業株式会社, ブリストル・マイヤーズ スクイブ株式会社. オプジーボ®点滴静注20mg/100mg/120mg/240mg 電子添文. 2025年6月改訂 (第24版).
- 小野薬品工業株式会社, ブリストル・マイヤーズ スクイブ株式会社. 医薬品リスク管理計画 (RMP) オプジーボ®(ヤーボイ又は他の抗悪性腫瘍剤併用療法)・ヤーボイ 適正使用ガイド. 2025年6月作成
- 小野薬品工業株式会社, ブリストル・マイヤーズ スクイブ株式会社. ヤーボイ®点滴静注液20mg/50mg 添付文書. 2025年6月改訂 (第15版).
- Lancet. 2025;405(10492):1851-1864.
最終更新 : 2025年7月1日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : HOKUTO編集部監修医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。

