本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ペプチド受容体放射性核種療法 (PRRT)
ルテチウムオキソドトレオチド (177Lu) 注射液
*ノバルティスファーマの外部サイトへ遷移します
投与スケジュール
電子添文¹⁾/適正使用ガイド²⁾
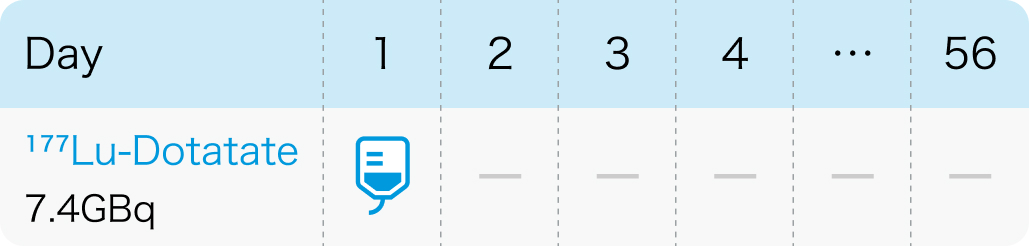
1回7.4GBqを30分かけて8週間間隔で最大4回まで点滴静注する
ルタテラ®電子添文 (2023年3月改訂第5版)、 適正使用ガイド(2023年3月改訂) より作図、 引用
特徴と注意点
ソマトスタチンアナログにキレート剤を介して放射性ルテチウム177 (¹⁷⁷Lu) で標識した放射性医薬品であり、 ソマトスタチン受容体と結合し、 腫瘍細胞内に取り込まれ¹⁷⁷Luから放出されるβ線がDNA損傷を惹起し、 細胞増殖抑制作用を発揮する。
本邦では、 原発部位に関わらずソマトスタチン受容体陽性の神経内分泌腫瘍に対して保険適用となっている。 事前にソマトスタチン受容体シンチグラフィーを行い、 腫瘍にソマトスタチン受容体が発現していることを確認することが必要である。
治療を行うためには放射線治療病室が必要であるため、 特定の医療機関でのみ実施できる。
頻度の高い副作用として、 悪心、 疲労、 血小板減少症などがある。 腎障害を予防するために、 リシン/アルギニン含有輸液を併用し治療を行う。
各プロトコル
減量・中止基準例

ルタテラ®電子添文 (2023年3月改訂第5版) より作図
KeyData|臨床試験結果
NETTER-1試験³⁾
ソマトスタチン受容体 (SSTR) 陽性の進行中腸神経内分泌腫瘍(NET)患者において、放射線同位体ルテチウムオキソドトレオチド (¹⁷⁷Lu) を標識した放射性医薬品-Dotatate (以下、 177Lu-Dotatate、 商品名ルタテラ)の効果を、 高用量徐放性オクトレオチドを対照に検証した第Ⅲ相ランダム化比較試験NETTER-1の結果より、 無増悪生存期間 (PFS) と奏効率 (ORR) を有意に改善させることが示された。
N Engl J Med. 2017;376(2):125-35.
PFS中央値
- ¹⁷⁷Lu-Dotatate群 : NR
- 対照群 : 8.4ヵ月 (95%CI 5.8-9.1)
HR 0.21 (95%CI 0.13-0.33)、 p<0.001
PFS率 (20ヵ月時)
- ¹⁷⁷Lu-Dotatate群 : 65.2% (95%CI 50.0-76.8)
- 対照群 : 10.8% (95%CI 3.5-23.0)
サブグループ解析
層別化因子や予後因子に関わらず、 対照群に対する優位性が一貫して認められた
ORR
- ¹⁷⁷Lu-Dotatate群 : 18%
- 対照群 : 3% p<0.001
OS中央値
- ¹⁷⁷Lu-Dotatate群: 48.0ヵ月 (95%CI 37.4-55.2)
- 対照群 : 36.3ヵ月 (95%CI 25.9-51.7)
HR 0.84 (95%CI 0.60-1.17)、 p=0.30
OS率(1年時、 2年時、 3年時、 4年時、 5年時)
- ¹⁷⁷Lu-Dotatate群 : 91.0、 76.0、 61.4、 49.5、 37.1%
- 対照群 : 79.7、 62.7、 50.1、 41.8、 35.4%
サブグループ解析
事前に規定されたサブグループにおいて、 ¹⁷⁷Lu-Dotatate群の対照群に対する優位性が概ね一貫して認められた。
追跡期間中央値は¹⁷⁷Lu-Dotatate群76.3ヵ月、 対照群76.5ヵ月
主な有害事象 (カッコ内はGrade3~4)
- 血小板数減少 25.2% (1.8%)
- リンパ球数減少 18.0% (9.0%)
- 貧血 14.4% (0%)
- 白血球数減少 9.9% (0.9%)
- 好中球数減少 5.4% (0.9%)
- 悪心 58.6% (3.6%)
- 嘔吐 46.8% (7.2%)
- 倦怠感 39.6% (1.8%)
- 下痢 28.8% (2.7%)
- 食欲減退 18.0% (0%)
- 脱毛症 10.8% (0%)
N Engl J Med. 2017 Jan 12;376(2):125-135.より引用
出典
- ノバルティスファーマ. ルタテラ®電子添文 (2023年3月改訂第5版) [最終閲覧 : 2025/1/4]
- ノバルティスファーマ. ルタテラ®適正使用ガイド (2023年3月改訂) [最終閲覧 : 2025/1/4]
- Phase 3 Trial of 177Lu-Dotatate for Midgut Neuroendocrine Tumors. N Engl J Med. 2017 Jan 12;376(2):125-135. PMID: 28076709
最終更新日 : 2025年1月4日
執筆医 : 香川大学医学部附属病院 腫瘍内科 講師 奥山浩之先生
監修医 : 神奈川県立がんセンター 消化器内科 上野 誠先生
¹⁷⁷Lu-Dotatate
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ペプチド受容体放射性核種療法 (PRRT)
ルテチウムオキソドトレオチド (177Lu) 注射液
*ノバルティスファーマの外部サイトへ遷移します
投与スケジュール
電子添文¹⁾/適正使用ガイド²⁾

1回7.4GBqを30分かけて8週間間隔で最大4回まで点滴静注する
ルタテラ®電子添文 (2023年3月改訂第5版)、 適正使用ガイド(2023年3月改訂) より作図、 引用
特徴と注意点
ソマトスタチンアナログにキレート剤を介して放射性ルテチウム177 (¹⁷⁷Lu) で標識した放射性医薬品であり、 ソマトスタチン受容体と結合し、 腫瘍細胞内に取り込まれ¹⁷⁷Luから放出されるβ線がDNA損傷を惹起し、 細胞増殖抑制作用を発揮する。
本邦では、 原発部位に関わらずソマトスタチン受容体陽性の神経内分泌腫瘍に対して保険適用となっている。 事前にソマトスタチン受容体シンチグラフィーを行い、 腫瘍にソマトスタチン受容体が発現していることを確認することが必要である。
治療を行うためには放射線治療病室が必要であるため、 特定の医療機関でのみ実施できる。
頻度の高い副作用として、 悪心、 疲労、 血小板減少症などがある。 腎障害を予防するために、 リシン/アルギニン含有輸液を併用し治療を行う。
各プロトコル
減量・中止基準例

ルタテラ®電子添文 (2023年3月改訂第5版) より作図
KeyData|臨床試験結果
NETTER-1試験³⁾
ソマトスタチン受容体 (SSTR) 陽性の進行中腸神経内分泌腫瘍(NET)患者において、放射線同位体ルテチウムオキソドトレオチド (¹⁷⁷Lu) を標識した放射性医薬品-Dotatate (以下、 177Lu-Dotatate、 商品名ルタテラ)の効果を、 高用量徐放性オクトレオチドを対照に検証した第Ⅲ相ランダム化比較試験NETTER-1の結果より、 無増悪生存期間 (PFS) と奏効率 (ORR) を有意に改善させることが示された。
N Engl J Med. 2017;376(2):125-35.
PFS中央値
- ¹⁷⁷Lu-Dotatate群 : NR
- 対照群 : 8.4ヵ月 (95%CI 5.8-9.1)
HR 0.21 (95%CI 0.13-0.33)、 p<0.001
PFS率 (20ヵ月時)
- ¹⁷⁷Lu-Dotatate群 : 65.2% (95%CI 50.0-76.8)
- 対照群 : 10.8% (95%CI 3.5-23.0)
サブグループ解析
層別化因子や予後因子に関わらず、 対照群に対する優位性が一貫して認められた
ORR
- ¹⁷⁷Lu-Dotatate群 : 18%
- 対照群 : 3% p<0.001
OS中央値
- ¹⁷⁷Lu-Dotatate群: 48.0ヵ月 (95%CI 37.4-55.2)
- 対照群 : 36.3ヵ月 (95%CI 25.9-51.7)
HR 0.84 (95%CI 0.60-1.17)、 p=0.30
OS率(1年時、 2年時、 3年時、 4年時、 5年時)
- ¹⁷⁷Lu-Dotatate群 : 91.0、 76.0、 61.4、 49.5、 37.1%
- 対照群 : 79.7、 62.7、 50.1、 41.8、 35.4%
サブグループ解析
事前に規定されたサブグループにおいて、 ¹⁷⁷Lu-Dotatate群の対照群に対する優位性が概ね一貫して認められた。
追跡期間中央値は¹⁷⁷Lu-Dotatate群76.3ヵ月、 対照群76.5ヵ月
主な有害事象 (カッコ内はGrade3~4)
- 血小板数減少 25.2% (1.8%)
- リンパ球数減少 18.0% (9.0%)
- 貧血 14.4% (0%)
- 白血球数減少 9.9% (0.9%)
- 好中球数減少 5.4% (0.9%)
- 悪心 58.6% (3.6%)
- 嘔吐 46.8% (7.2%)
- 倦怠感 39.6% (1.8%)
- 下痢 28.8% (2.7%)
- 食欲減退 18.0% (0%)
- 脱毛症 10.8% (0%)
N Engl J Med. 2017 Jan 12;376(2):125-135.より引用
出典
- ノバルティスファーマ. ルタテラ®電子添文 (2023年3月改訂第5版) [最終閲覧 : 2025/1/4]
- ノバルティスファーマ. ルタテラ®適正使用ガイド (2023年3月改訂) [最終閲覧 : 2025/1/4]
- Phase 3 Trial of 177Lu-Dotatate for Midgut Neuroendocrine Tumors. N Engl J Med. 2017 Jan 12;376(2):125-135. PMID: 28076709
最終更新日 : 2025年1月4日
執筆医 : 香川大学医学部附属病院 腫瘍内科 講師 奥山浩之先生
監修医 : 神奈川県立がんセンター 消化器内科 上野 誠先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。