本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
【催吐性】 軽度催吐性
*日本化薬株式会社の外部サイトへ遷移します
*中外製薬株式会社の外部サイトへ遷移します
>> Nogitecan単剤レジメン はこちら
用法用量
AURELIA試験⁵⁾のプロトコル
3週間間隔
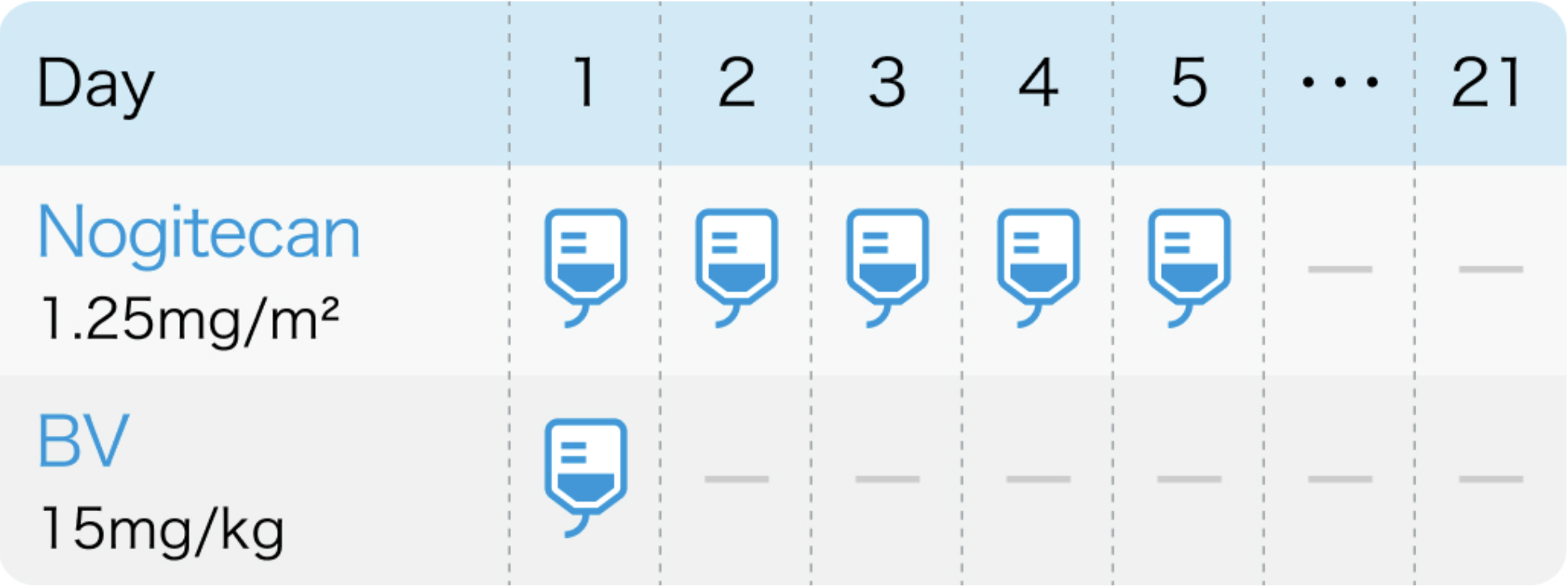
J Clin Oncol. 2014 May 1;32(13):1302-8⁵⁾より作図
4週間間隔

J Clin Oncol. 2014 May 1;32(13):1302-8⁵⁾より作図
※電子添文の効能又は効果、 用法及ぶ用量と異なる
電子添文の用法および用量
Nogitecan¹⁾ : がん化学療法後に増悪した卵巣癌については、 1日1回、 1.5mg/m²を5日間連日点滴静注し、 少なくとも16日間休薬する。 これを1コースとして、 投与を繰り返す。
BV³⁾ : 他の抗悪性腫瘍剤との併用において、 1回10mg/kgを2週間間隔または1回15mg/kgを3週間間隔で点滴静脈内注射する。
前投薬・投与スケジュール例
- DEX 6.6mg (day1~2)+生食 100ml
- DEX 3.3mg (day3~5)+生食 100ml
- Nogitecan 1.25mg/m² + 生食 100mL (day1~5、 30分)
- BV 15mg/kg 生理食塩水 100mL
日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生提供
投与開始基準
AURELIA試験⁵⁾のプロトコル
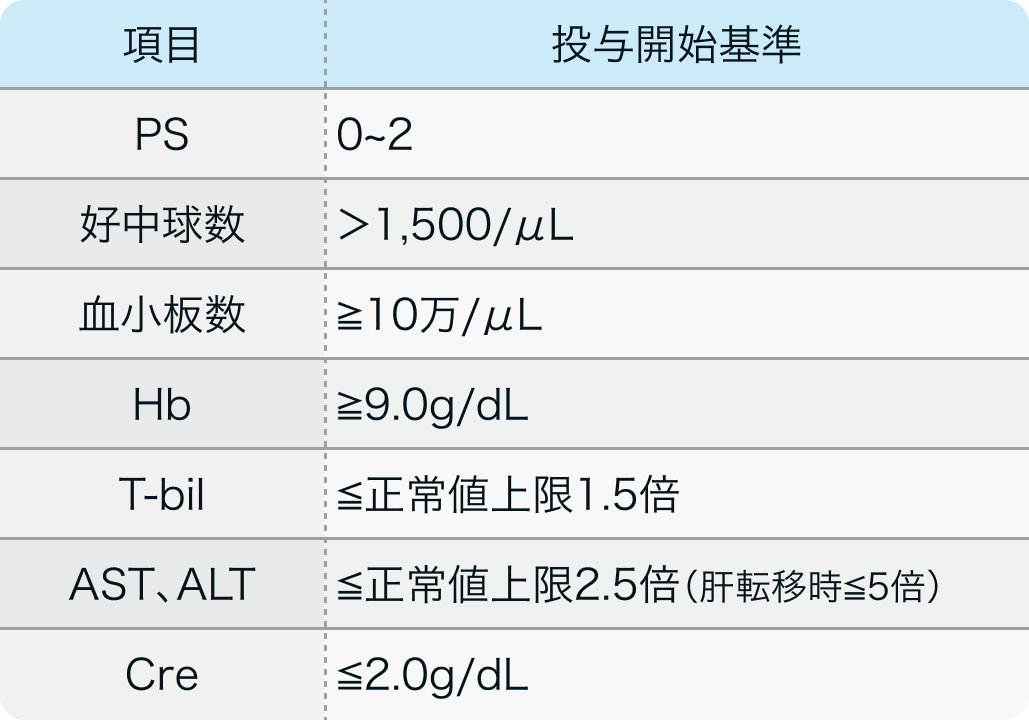
J Clin Oncol. 2014 May 1;32(13):1302-8⁵⁾より作図
電子添文の記載
Nogitecan¹⁾ : 白金製剤を含む化学療法施行後の症例を対象とし、 白金製剤に対する感受性を考慮して本剤以外の治療法を慎重に検討した上で、 投与開始する。
BV³⁾ : FIGO StageⅢ以上の卵巣癌患者に投与する。
減量・中止基準
AURELIA試験⁵⁾のプロトコル

J Clin Oncol. 2014 May 1;32(13):1302-8⁵⁾より作図
初回基準量と減量レベル
3週間間隔
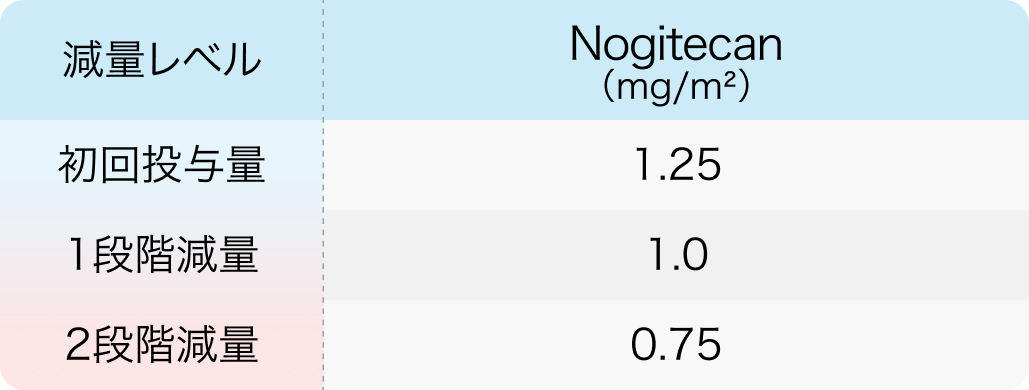
J Clin Oncol. 2014 May 1;32(13):1302-8⁵⁾より作図
4週間間隔
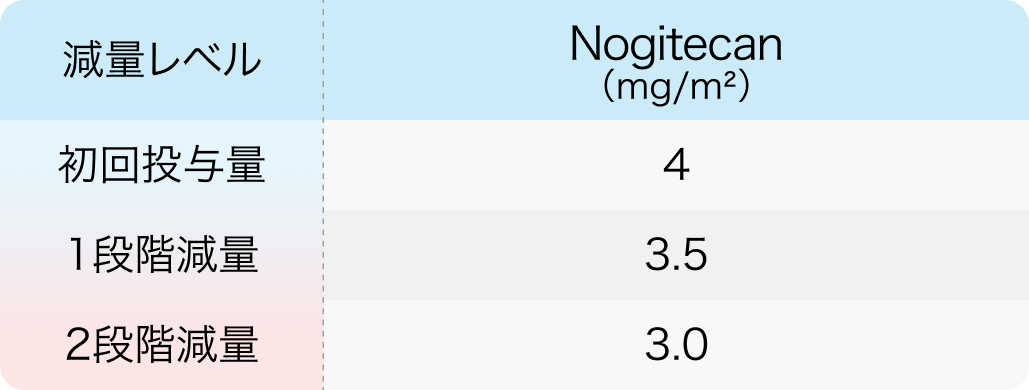
J Clin Oncol. 2014 May 1;32(13):1302-8⁵⁾より作図
※電子添文とは記載が異なる
KeyData|臨床試験結果
AURELIA試験⁵⁾
対象: プラチナ製剤抵抗性の再発卵巣癌患者361例
方法: 化学療法単独群 vs 化学療法 + BV群
【有効性】化学療法 + BV群
- ORR 27.3%
- mPFS 6.7ヵ月
- mOS 16.6ヵ月
【安全性】主な有害事象(≧Grade3)
- 消化管穿孔 1.7%
- 瘻孔/膿瘍 1.1%
- 出血 1.1%
- 血栓塞栓症 5.0%
- 可逆性後白質脳症症候群 0.6%
- うっ血性心不全 0.6%
- 高血圧 7.3%
- 蛋白尿 1.7%
J Clin Oncol. 2014 May 1;32(13):1302-8⁵⁾より引用
エキスパートによるワンポイント
AURELIA試験⁵⁾でのBVの追加効果の検証
プラチナ抵抗性再発卵巣癌に対して、 AURELIA試験⁴⁾は、 PLD、 weekly PTX、 topotecanのそれぞれ単剤投与と、 BVの追加効果を検証したランダム化比較試験です。 PFS (無増悪生存期間) がエンドポイントであり、 奏効率 (RR) は、 単剤投与群11.8%、 BV追加群27.3%であり、 PFS中央値は、 単剤投与群3.4ヵ月、 BV追加群6.7ヵ月 (HR=0.48, 95%CI 0.38-0.60、 p<0.001) で、 BV追加群が優っていました。 しかし、 OS (全生存期間) は、 単剤投与群13.3ヵ月、 BV追加群16.6ヵ月で有意差はありませんでした。
OSベネフィットは得られておりませんので、 BV追加は必ずしも標準治療とは言えません。 短期的効果を高めたい場合 (腫瘍による痛みなどの症状がある場合など) には、 オプションとしてBV追加を考慮してもよいと思います。
BV既治療への再投与のエビデンス不足
AURELIA試験⁵⁾は、 BVを初めて投与した患者のみを対象としており、 BV既治療例を対象としていませんので、 BV既治療例に対する、 プラチナ抵抗性再発卵巣癌へのBVの再投与 (Beyond Progression) に関しては、 有効性のエビデンスは証明されていません。
監修 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
出典
- 日本化薬株式会社. ハイカムチン®電子添文 (2023年5月改訂 第1版) [最終閲覧 : 2024/03/26]
- 日本化薬株式会社. ハイカムチン®適正使用ガイド (2023年9月作成) [最終閲覧 : 2024/03/26]
- 中外製薬株式会社. アバスチン®電子添文 (2024年3月改訂 第5版) [最終閲覧 : 2024/03/21]
- 中外製薬株式会社. アバスチン®適正使用ガイド (2022年6月作成) [最終閲覧 : 2024/03/21]
- Bevacizumab combined with chemotherapy for platinum-resistant recurrent ovarian cancer: The AURELIA open-label randomized phase III trial. J Clin Oncol. 2014 May 1;32(13):1302-8. PMID: 24637997
最終更新日 : 2024年8月3日
監修医師 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
Nogitecan + BV
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
【催吐性】 軽度催吐性
*日本化薬株式会社の外部サイトへ遷移します
*中外製薬株式会社の外部サイトへ遷移します
>> Nogitecan単剤レジメン はこちら
用法用量
AURELIA試験⁵⁾のプロトコル
3週間間隔

J Clin Oncol. 2014 May 1;32(13):1302-8⁵⁾より作図
4週間間隔

J Clin Oncol. 2014 May 1;32(13):1302-8⁵⁾より作図
※電子添文の効能又は効果、 用法及ぶ用量と異なる
電子添文の用法および用量
Nogitecan¹⁾ : がん化学療法後に増悪した卵巣癌については、 1日1回、 1.5mg/m²を5日間連日点滴静注し、 少なくとも16日間休薬する。 これを1コースとして、 投与を繰り返す。
BV³⁾ : 他の抗悪性腫瘍剤との併用において、 1回10mg/kgを2週間間隔または1回15mg/kgを3週間間隔で点滴静脈内注射する。
前投薬・投与スケジュール例
- DEX 6.6mg (day1~2)+生食 100ml
- DEX 3.3mg (day3~5)+生食 100ml
- Nogitecan 1.25mg/m² + 生食 100mL (day1~5、 30分)
- BV 15mg/kg 生理食塩水 100mL
日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生提供
投与開始基準
AURELIA試験⁵⁾のプロトコル

J Clin Oncol. 2014 May 1;32(13):1302-8⁵⁾より作図
電子添文の記載
Nogitecan¹⁾ : 白金製剤を含む化学療法施行後の症例を対象とし、 白金製剤に対する感受性を考慮して本剤以外の治療法を慎重に検討した上で、 投与開始する。
BV³⁾ : FIGO StageⅢ以上の卵巣癌患者に投与する。
減量・中止基準
AURELIA試験⁵⁾のプロトコル

J Clin Oncol. 2014 May 1;32(13):1302-8⁵⁾より作図
初回基準量と減量レベル
3週間間隔

J Clin Oncol. 2014 May 1;32(13):1302-8⁵⁾より作図
4週間間隔

J Clin Oncol. 2014 May 1;32(13):1302-8⁵⁾より作図
※電子添文とは記載が異なる
KeyData|臨床試験結果
AURELIA試験⁵⁾
対象: プラチナ製剤抵抗性の再発卵巣癌患者361例
方法: 化学療法単独群 vs 化学療法 + BV群
【有効性】化学療法 + BV群
- ORR 27.3%
- mPFS 6.7ヵ月
- mOS 16.6ヵ月
【安全性】主な有害事象(≧Grade3)
- 消化管穿孔 1.7%
- 瘻孔/膿瘍 1.1%
- 出血 1.1%
- 血栓塞栓症 5.0%
- 可逆性後白質脳症症候群 0.6%
- うっ血性心不全 0.6%
- 高血圧 7.3%
- 蛋白尿 1.7%
J Clin Oncol. 2014 May 1;32(13):1302-8⁵⁾より引用
エキスパートによるワンポイント
AURELIA試験⁵⁾でのBVの追加効果の検証
プラチナ抵抗性再発卵巣癌に対して、 AURELIA試験⁴⁾は、 PLD、 weekly PTX、 topotecanのそれぞれ単剤投与と、 BVの追加効果を検証したランダム化比較試験です。 PFS (無増悪生存期間) がエンドポイントであり、 奏効率 (RR) は、 単剤投与群11.8%、 BV追加群27.3%であり、 PFS中央値は、 単剤投与群3.4ヵ月、 BV追加群6.7ヵ月 (HR=0.48, 95%CI 0.38-0.60、 p<0.001) で、 BV追加群が優っていました。 しかし、 OS (全生存期間) は、 単剤投与群13.3ヵ月、 BV追加群16.6ヵ月で有意差はありませんでした。
OSベネフィットは得られておりませんので、 BV追加は必ずしも標準治療とは言えません。 短期的効果を高めたい場合 (腫瘍による痛みなどの症状がある場合など) には、 オプションとしてBV追加を考慮してもよいと思います。
BV既治療への再投与のエビデンス不足
AURELIA試験⁵⁾は、 BVを初めて投与した患者のみを対象としており、 BV既治療例を対象としていませんので、 BV既治療例に対する、 プラチナ抵抗性再発卵巣癌へのBVの再投与 (Beyond Progression) に関しては、 有効性のエビデンスは証明されていません。
監修 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
出典
- 日本化薬株式会社. ハイカムチン®電子添文 (2023年5月改訂 第1版) [最終閲覧 : 2024/03/26]
- 日本化薬株式会社. ハイカムチン®適正使用ガイド (2023年9月作成) [最終閲覧 : 2024/03/26]
- 中外製薬株式会社. アバスチン®電子添文 (2024年3月改訂 第5版) [最終閲覧 : 2024/03/21]
- 中外製薬株式会社. アバスチン®適正使用ガイド (2022年6月作成) [最終閲覧 : 2024/03/21]
- Bevacizumab combined with chemotherapy for platinum-resistant recurrent ovarian cancer: The AURELIA open-label randomized phase III trial. J Clin Oncol. 2014 May 1;32(13):1302-8. PMID: 24637997
最終更新日 : 2024年8月3日
監修医師 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。