Asciminib:アシミニブ(セムブリックス®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1回80mg 1日1回 空腹時 経口 | 1~ | Day 1~ |
その他
| 食事の1時間前から食後2時間までの間の服用は避ける. |
本コンテンツは特定の治療法を推奨するものではございません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
これまで慢性骨髄性白血病 (CML) 3次治療での使用となっていたが、 2025年5月19日、 未治療の患者に1次治療から使用できるようになった。
薬剤情報
ABLミリストイルポケット結合型(STAMP)阻害薬 アシミニブ
*ノバルティス ファーマ株式会社の外部サイトへ遷移します。
投与スケジュール
【1コース】連日内服投与
【催吐性】最小度
【FN発症】低リスク*
*適正使用ガイド (FN発症率0.5%) の記載を基に編集部が分類
セムブリックス®電子添文情報を基に編集部作成
通常、 成人にはアシミニブとして1回80mgを1日1回、 空腹時に経口投与する。 なお、 患者の状態により適宜減量する。
食事の影響を避けるため、 食事の1時間前から食後2時間までの間の服用は避けること。
Key Data|臨床試験結果
📊 ASC4FIRST試験³⁾
初発のPh陽性慢性期CML患者405例を対象とした、 無作為化非盲検の第III相比較試験。 患者は、 アシミニブ80mgを1日1回投与する群 (201例) と、 医師が選択したチロシンキナーゼ阻害薬 (イマチニブ、 ニロチニブ、 ダサチニブ、 ボスチニブのいずれか) を投与する群 (204例) に、 1:1の比率で無作為に割り付けられた。 主要評価項目は、 投与48週時点における分子遺伝学的大奏効 (MMR) 達成率であった。
【有効性】アシミニブ群
48週時点での治療効果 (vs 医師選択群)
- MMR達成率 : 67.7% (vs 49.0%、 p<0.001)
- MR⁴達成率 : 38.8% (vs 20.6%)
- MR⁴·⁵達成率 : 16.9% (vs 8.8%)
MMR達成率については、 全体で18.9%の上乗せ効果が認められた。 イマチニブとの比較では29.6%、 第2世代TKIとの比較では8.2%の上乗せ効果であった。
【安全性】主な有害事象 : 全Grade (≧Grade3)
- 血小板減少 28.0% (13.0%)
- 好中球減少 25.0% (10.0%)
- 白血球減少 19.0% (2.0%)
- コロナウイルス感染症2019 17.5% (0%)
- 下痢 15.5% (0%)
- 疲労 14.0% (0.5%)
- 頭痛 13.5% (0.5%)
- 筋肉痛 13.0% (0.5%)
- 発疹 13.0% (0%)
- 貧血 11.5% (1.5%)
- リパーゼ増加 11.5% (3.0%)
- 便秘 9.5% (0%)
- 悪心 9.0% (0%)
- ALT増加 7.0% (2.0%)
- 上気道感染 7.0% (0%)
- リンパ球減少 6.0% (2.5%)
- 血中ALP増加 5.5% (0%)
- 嘔吐 5.5% (0%)
- 血中ビリルビン増加 2.5% (0%)
- AST増加 2.0% (0.5%)
- 筋痙縮 2.0% (0%)
- 眼窩周囲浮腫 1.0% (0%)
各プロトコル
適格基準
ASC4FIRST試験³⁾の主な適格基準
- 18歳以上
- ECOG PS 0–1
- 血小板数 ≧100,000/μL
- 腎機能 : クレアチニンクリアランス ≧30 mL/min
- 肝機能 : 総ビリルビン<3 × ULN
- 血清リパーゼ ≦1.5 × ULN
減量・休薬・中止基準
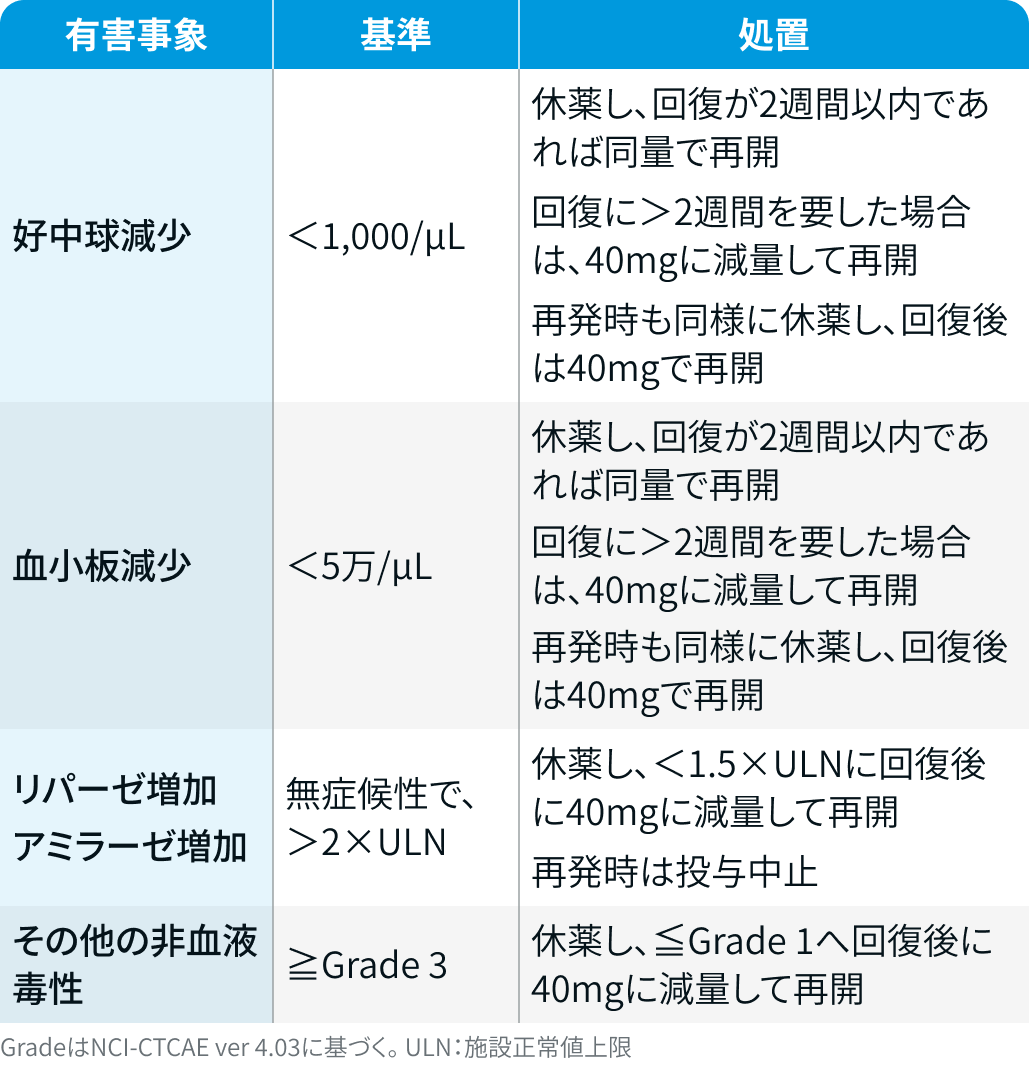
セムブリックス®電子添文情報を基に編集部作成
レジメンの特徴と注意点
🧑⚕️CMLの初回治療として、 セムブリックス®は既存のTKIよりも高い有効性と少ない副作用が証明されています。 空腹時に服用する必要はありますが、 1日2回ではなく1日1回80mgの投与であるため、 服薬アドヒアランスの面でも良好と考えられます。
東海大学医学部血液腫瘍内科 扇屋大輔先生
従来はASCEMBL試験⁴⁾を根拠に3次治療以降で使用されてきたが、 2025年5月19日、 ASC4FIRST試験の結果を踏まえ、 未治療患者に対しても1次治療から使用可能となった。
作用機序の特徴
アシミニブは、 ABL1キナーゼのミリストイルポケットに特異的に結合するSTAMP (Specifically Targeting the ABL Myristoyl Pocket) 阻害剤であり、 BCR::ABL1融合タンパク質の立体構造を変化させることでキナーゼ活性を阻害する。 その作用機序は、 従来のATP結合部位を標的とするチロシンキナーゼ阻害薬 (TKI) とは異なり、 既存TKIに耐性を示す一部の変異に対しても有効性が期待される。
レジメン適用時の注意事項
- 空腹時に投与し、 食事の1時間前から食後2時間までの服用は避ける
- 膵炎があらわれることがあるため、 投与開始前および投与中は定期的に血清リパーゼおよび血清アミラーゼを測定する
- QT間隔延長があらわれることがあるため、 投与開始前および投与中は、 必要に応じて心電図検査および電解質検査を行う
- B型肝炎ウイルスの再活性化があらわれることがあるため、 投与に先立って肝炎ウイルス感染の有無を確認する
- CYP2C9、 BCRP、 P-gpを阻害するため、 併用薬には注意が必要である (例 : ワルファリン、 フェニトイン、 ジゴキシン、 ダビガトランなど)
RMP【重要な特定されたリスク】
RMP : 医薬品リスク管理計画書
- 膵炎
- 骨髄抑制
- QT間隔延長
- 血管閉塞性事象
- 感染症
出典
- ノバルティスファーマ株式会社. セムブリックス錠20mg/セムブリックス錠40mg 電子添文 2025年5月改訂 (第6版) [最終確認: 2025/5/20]
- ノバルティスファーマ株式会社. セムブリックス錠20mg セムブリックス錠40mg 適正使用ガイド [最終確認: 2025/5/20]
- N Engl J Med. 2024;391(10):885-898.
- Blood. 2021;138(21):2031-2041.
最終更新 : 2025年5月20日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
Asciminib
Asciminib:アシミニブ(セムブリックス®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1回80mg 1日1回 空腹時 経口 | 1~ | Day 1~ |
その他
| 食事の1時間前から食後2時間までの間の服用は避ける. |
概要
本コンテンツは特定の治療法を推奨するものではございません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
これまで慢性骨髄性白血病 (CML) 3次治療での使用となっていたが、 2025年5月19日、 未治療の患者に1次治療から使用できるようになった。
薬剤情報
ABLミリストイルポケット結合型(STAMP)阻害薬 アシミニブ
*ノバルティス ファーマ株式会社の外部サイトへ遷移します。
投与スケジュール
【1コース】連日内服投与
【催吐性】最小度
【FN発症】低リスク*
*適正使用ガイド (FN発症率0.5%) の記載を基に編集部が分類

セムブリックス®電子添文情報を基に編集部作成
通常、 成人にはアシミニブとして1回80mgを1日1回、 空腹時に経口投与する。 なお、 患者の状態により適宜減量する。
食事の影響を避けるため、 食事の1時間前から食後2時間までの間の服用は避けること。
Key Data|臨床試験結果
📊 ASC4FIRST試験³⁾
初発のPh陽性慢性期CML患者405例を対象とした、 無作為化非盲検の第III相比較試験。 患者は、 アシミニブ80mgを1日1回投与する群 (201例) と、 医師が選択したチロシンキナーゼ阻害薬 (イマチニブ、 ニロチニブ、 ダサチニブ、 ボスチニブのいずれか) を投与する群 (204例) に、 1:1の比率で無作為に割り付けられた。 主要評価項目は、 投与48週時点における分子遺伝学的大奏効 (MMR) 達成率であった。
【有効性】アシミニブ群
48週時点での治療効果 (vs 医師選択群)
- MMR達成率 : 67.7% (vs 49.0%、 p<0.001)
- MR⁴達成率 : 38.8% (vs 20.6%)
- MR⁴·⁵達成率 : 16.9% (vs 8.8%)
MMR達成率については、 全体で18.9%の上乗せ効果が認められた。 イマチニブとの比較では29.6%、 第2世代TKIとの比較では8.2%の上乗せ効果であった。
【安全性】主な有害事象 : 全Grade (≧Grade3)
- 血小板減少 28.0% (13.0%)
- 好中球減少 25.0% (10.0%)
- 白血球減少 19.0% (2.0%)
- コロナウイルス感染症2019 17.5% (0%)
- 下痢 15.5% (0%)
- 疲労 14.0% (0.5%)
- 頭痛 13.5% (0.5%)
- 筋肉痛 13.0% (0.5%)
- 発疹 13.0% (0%)
- 貧血 11.5% (1.5%)
- リパーゼ増加 11.5% (3.0%)
- 便秘 9.5% (0%)
- 悪心 9.0% (0%)
- ALT増加 7.0% (2.0%)
- 上気道感染 7.0% (0%)
- リンパ球減少 6.0% (2.5%)
- 血中ALP増加 5.5% (0%)
- 嘔吐 5.5% (0%)
- 血中ビリルビン増加 2.5% (0%)
- AST増加 2.0% (0.5%)
- 筋痙縮 2.0% (0%)
- 眼窩周囲浮腫 1.0% (0%)
各プロトコル
適格基準
ASC4FIRST試験³⁾の主な適格基準
- 18歳以上
- ECOG PS 0–1
- 血小板数 ≧100,000/μL
- 腎機能 : クレアチニンクリアランス ≧30 mL/min
- 肝機能 : 総ビリルビン<3 × ULN
- 血清リパーゼ ≦1.5 × ULN
減量・休薬・中止基準

セムブリックス®電子添文情報を基に編集部作成
レジメンの特徴と注意点
🧑⚕️CMLの初回治療として、 セムブリックス®は既存のTKIよりも高い有効性と少ない副作用が証明されています。 空腹時に服用する必要はありますが、 1日2回ではなく1日1回80mgの投与であるため、 服薬アドヒアランスの面でも良好と考えられます。
東海大学医学部血液腫瘍内科 扇屋大輔先生
従来はASCEMBL試験⁴⁾を根拠に3次治療以降で使用されてきたが、 2025年5月19日、 ASC4FIRST試験の結果を踏まえ、 未治療患者に対しても1次治療から使用可能となった。
作用機序の特徴
アシミニブは、 ABL1キナーゼのミリストイルポケットに特異的に結合するSTAMP (Specifically Targeting the ABL Myristoyl Pocket) 阻害剤であり、 BCR::ABL1融合タンパク質の立体構造を変化させることでキナーゼ活性を阻害する。 その作用機序は、 従来のATP結合部位を標的とするチロシンキナーゼ阻害薬 (TKI) とは異なり、 既存TKIに耐性を示す一部の変異に対しても有効性が期待される。
レジメン適用時の注意事項
- 空腹時に投与し、 食事の1時間前から食後2時間までの服用は避ける
- 膵炎があらわれることがあるため、 投与開始前および投与中は定期的に血清リパーゼおよび血清アミラーゼを測定する
- QT間隔延長があらわれることがあるため、 投与開始前および投与中は、 必要に応じて心電図検査および電解質検査を行う
- B型肝炎ウイルスの再活性化があらわれることがあるため、 投与に先立って肝炎ウイルス感染の有無を確認する
- CYP2C9、 BCRP、 P-gpを阻害するため、 併用薬には注意が必要である (例 : ワルファリン、 フェニトイン、 ジゴキシン、 ダビガトランなど)
RMP【重要な特定されたリスク】
RMP : 医薬品リスク管理計画書
- 膵炎
- 骨髄抑制
- QT間隔延長
- 血管閉塞性事象
- 感染症
出典
- ノバルティスファーマ株式会社. セムブリックス錠20mg/セムブリックス錠40mg 電子添文 2025年5月改訂 (第6版) [最終確認: 2025/5/20]
- ノバルティスファーマ株式会社. セムブリックス錠20mg セムブリックス錠40mg 適正使用ガイド [最終確認: 2025/5/20]
- N Engl J Med. 2024;391(10):885-898.
- Blood. 2021;138(21):2031-2041.
最終更新 : 2025年5月20日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
