本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
BRAF阻害薬 ベムラフェニブ
*中外製薬株式会社の外部サイトへ遷移します
用法用量
JO28178、 BRIM-3試験、電子添文の用法用量
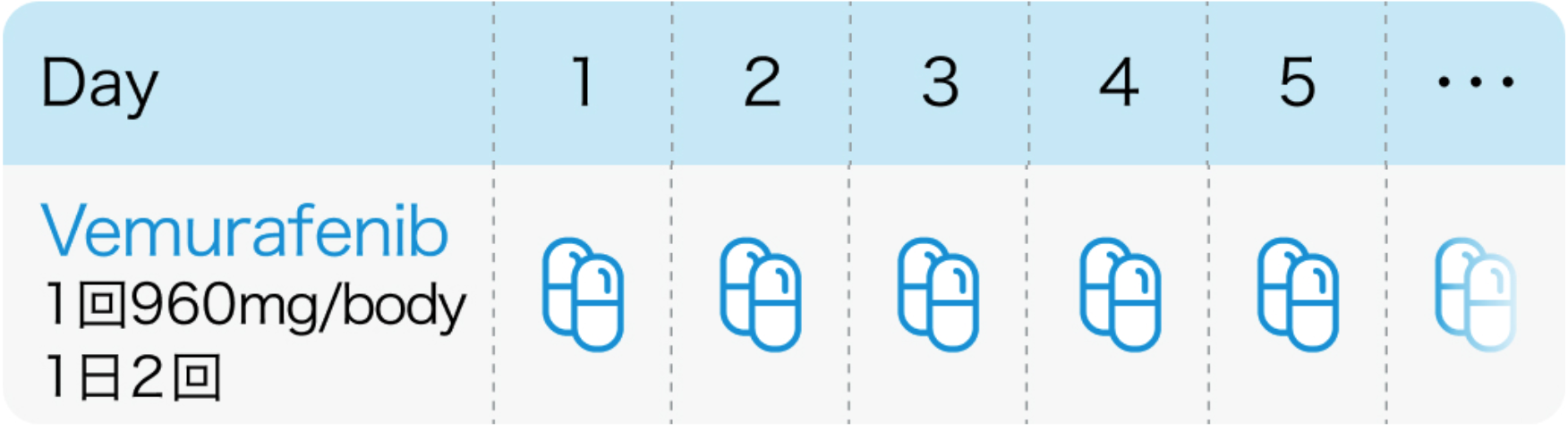
1回960mgを1日2回経口投与する。食後投与で、 Cmax及びAUCが増加の報告があり、 食事1時間前~食後2時間の服用は避けることが望ましい
ゼルボラフ®電子添文 (2022年12月改訂 第2版)、 適正使用ガイド (2022年7月作成)より作図
投与開始基準
BRIM-3試験¹⁾のプロトコル
化学療法歴のないBRAF V600変異を有する根治切除不能なIII、IV期の悪性黒色腫
投与開始基準の詳細はプロトコルを確認下さい
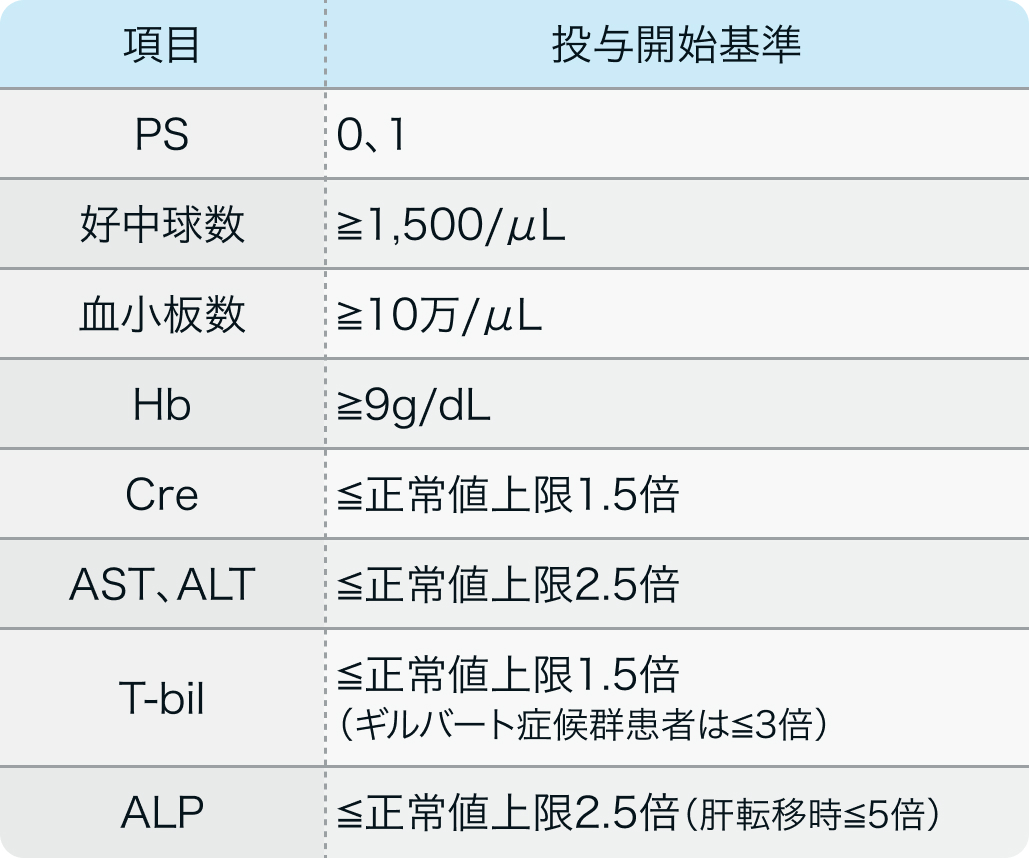
N Engl J Med. 2011 Jun 30;364(26):2507-16.より作図
減量・休薬・中止基準
電子添文¹⁾²⁾の減量・休薬・中止基準

ゼルボラフ®電子添文 (2022年12月改訂 第2版)、 適正使用ガイド (2022年7月作成) より作図
主な有害事象
NO25026試験¹⁾
主な有害事象 (カッコ内Grade3~4)
- 倦怠感 13.1% (1.8%)
- 悪心 8.6% (1.2%)
- 脱毛症 7.7% (0%)
- 下痢 5.4% (0.6%)
- 嘔吐 3.9% (1.2%)
N Engl J Med. 2011 Jun 30;364(26):2507-16.より引用
エキスパートによるワンポイント
BRAFV600遺伝子変異を有する悪性黒色腫患者の2次治療以降の選択肢に
BRAF遺伝子変異を有する根治切除不能な悪性黒色腫に対して投与する。 ただし、 単剤で利用することはほとんどなく、 奏効割合の高さ、 有害事象の減少などの理由から、 以下の併用療法が第一選択として利用される。
その他のBRAFV600遺伝子変異陽性悪性黒色腫患者の選択肢
投与にあたっては十分な経験を有する病理医又は検査施設における検査により、 BRAF遺伝子変異が確認された患者に投与すること。 検査にあたっては、 承認された体外診断用医薬品又は医療機器を用いること。
投与スケジュール
通常、 成人にはベムラフェニブとして1回960mgを1日2回経口投与する。 忍容不能なGrade2~3の副作用が発生した場合は休薬し、 Grade1以下まで回復後、 1回量を720mgに減量し再開する。
臨床試験の結果
国内第I/Ⅱ相試験 (JO28178試験)⁴⁾
BRAF V600変異を有する根治切除不能な悪性黒色腫患者11例を対象とし、 ベムラフェニブ1回960mgを1日2回空腹時 (投与前2時間、 投与後1時間絶食) に連日投与する第Ⅰ/Ⅱ相試験
有効性評価の対象となった8例における奏効割合は75.0% (95%CI 34.9-96.8) であった⁴⁾。
海外第Ⅲ相試験 (NO25026試験:BRIM3)³⁾
化学療法歴のないBRAF V600変異を有する根治切除不能なⅢ期/Ⅳ期の悪性黒色腫患者675例を対象とし、 ダカルバジン1000mg/m²を3週毎に投与する群とベムラフェニブ1回960mgを1日2回連日投与する群を比較した第Ⅲ相非盲検ランダム化比較試験
OS解析において、 ダカルバジン投与群に対するベムラフェニブ投与群のハザード比は0.37 (95%CI 0.26–0.55) であり、 Kaplan-Meier法で推定した中央値は、 ダカルバジン投与群7.75ヵ月 (95%CI 6.28–10.28)、 ベムラフェニブ投与群9.23ヵ月 (95%CI : 8.05–未到達) と、 統計学的に有意なOSの延長が確認された (非層別Log-rank検定 p<0.0001)。
PFS解析において、 ダカルバジン投与群に対するベムラフェニブ投与群のハザード比は0.26 (95%CI 0.20–0.33) であり、 Kaplan-Meier法で推定した中央値はダカルバジン投与群1.61ヵ月 (95%CI 1.58–1.74)、 ベムラフェニブ投与群5.32ヵ月 (95%CI 4.86–6.57) と、 統計学的に有意なPFSの延長が確認された (非層別Log-rank検定 p<0.0001)。 奏効割合はダカルバジン投与群5%、 ベムラフェニブ投与群48%であった。
有害事象とその対策
国内第I/Ⅱ相試験において安全性評価対象例11例中11例 (100%) に副作用が認められた。 主な副作用は、 関節痛10例 (90.9%)、 発疹 (湿疹、 丘疹等) 10例 (90.9%)、 筋骨格痛7例 (63.6%)、 脱毛症7例 (63.6%)、 疲労6例 (54.5%) 等であった⁴⁾。
また、 海外第Ⅲ相試験の結果から主な副作用として発疹 (湿疹、 丘疹等) 178例 (52.8%)、 関節痛162例 (48.1%)、 光線過敏症157例 (46.6%)、 脱毛症153例 (45.4%)、 疲労146例 (43.3%) 等がみられた³⁾。
さらに、 注意すべき副作用としてQT間隔延長と皮膚悪性腫瘍 (有棘細胞がん) の二次発がんがあげられる。 頻度は少ないが十分な観察が求められる。
出典
- 中外製薬株式会社. ゼルボラフ®電子添文 (2022年12月改訂 第2版) [最終閲覧 : 2024/8/25]
- 中外製薬株式会社. ゼルボラフ®適正使用ガイド (2022年7月作成) [最終閲覧 : 2024/8/25]
- Improved survival with vemurafenib in melanoma with BRAF V600E mutation. N Engl J Med. 2011 Jun 30;364(26):2507-16. PMID: 21639808
- Phase I/II study of vemurafenib in patients with unresectable or recurrent melanoma with BRAF(V) (600) mutations. J Dermatol. 2015 Jul;42(7):661-6. PMID: 25884515
その他情報は随時更新予定です
最終更新日 : 2024年8月25日
監修医師 : 国立がん研究センター中央病院皮膚腫瘍科長 山崎直也先生
Vemurafenib
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
BRAF阻害薬 ベムラフェニブ
*中外製薬株式会社の外部サイトへ遷移します
用法用量
JO28178、 BRIM-3試験、電子添文の用法用量

1回960mgを1日2回経口投与する。食後投与で、 Cmax及びAUCが増加の報告があり、 食事1時間前~食後2時間の服用は避けることが望ましい
ゼルボラフ®電子添文 (2022年12月改訂 第2版)、 適正使用ガイド (2022年7月作成)より作図
投与開始基準
BRIM-3試験¹⁾のプロトコル
化学療法歴のないBRAF V600変異を有する根治切除不能なIII、IV期の悪性黒色腫
投与開始基準の詳細はプロトコルを確認下さい

N Engl J Med. 2011 Jun 30;364(26):2507-16.より作図
減量・休薬・中止基準
電子添文¹⁾²⁾の減量・休薬・中止基準

ゼルボラフ®電子添文 (2022年12月改訂 第2版)、 適正使用ガイド (2022年7月作成) より作図
主な有害事象
NO25026試験¹⁾
主な有害事象 (カッコ内Grade3~4)
- 倦怠感 13.1% (1.8%)
- 悪心 8.6% (1.2%)
- 脱毛症 7.7% (0%)
- 下痢 5.4% (0.6%)
- 嘔吐 3.9% (1.2%)
N Engl J Med. 2011 Jun 30;364(26):2507-16.より引用
エキスパートによるワンポイント
BRAFV600遺伝子変異を有する悪性黒色腫患者の2次治療以降の選択肢に
BRAF遺伝子変異を有する根治切除不能な悪性黒色腫に対して投与する。 ただし、 単剤で利用することはほとんどなく、 奏効割合の高さ、 有害事象の減少などの理由から、 以下の併用療法が第一選択として利用される。
その他のBRAFV600遺伝子変異陽性悪性黒色腫患者の選択肢
投与にあたっては十分な経験を有する病理医又は検査施設における検査により、 BRAF遺伝子変異が確認された患者に投与すること。 検査にあたっては、 承認された体外診断用医薬品又は医療機器を用いること。
投与スケジュール
通常、 成人にはベムラフェニブとして1回960mgを1日2回経口投与する。 忍容不能なGrade2~3の副作用が発生した場合は休薬し、 Grade1以下まで回復後、 1回量を720mgに減量し再開する。
臨床試験の結果
国内第I/Ⅱ相試験 (JO28178試験)⁴⁾
BRAF V600変異を有する根治切除不能な悪性黒色腫患者11例を対象とし、 ベムラフェニブ1回960mgを1日2回空腹時 (投与前2時間、 投与後1時間絶食) に連日投与する第Ⅰ/Ⅱ相試験
有効性評価の対象となった8例における奏効割合は75.0% (95%CI 34.9-96.8) であった⁴⁾。
海外第Ⅲ相試験 (NO25026試験:BRIM3)³⁾
化学療法歴のないBRAF V600変異を有する根治切除不能なⅢ期/Ⅳ期の悪性黒色腫患者675例を対象とし、 ダカルバジン1000mg/m²を3週毎に投与する群とベムラフェニブ1回960mgを1日2回連日投与する群を比較した第Ⅲ相非盲検ランダム化比較試験
OS解析において、 ダカルバジン投与群に対するベムラフェニブ投与群のハザード比は0.37 (95%CI 0.26–0.55) であり、 Kaplan-Meier法で推定した中央値は、 ダカルバジン投与群7.75ヵ月 (95%CI 6.28–10.28)、 ベムラフェニブ投与群9.23ヵ月 (95%CI : 8.05–未到達) と、 統計学的に有意なOSの延長が確認された (非層別Log-rank検定 p<0.0001)。
PFS解析において、 ダカルバジン投与群に対するベムラフェニブ投与群のハザード比は0.26 (95%CI 0.20–0.33) であり、 Kaplan-Meier法で推定した中央値はダカルバジン投与群1.61ヵ月 (95%CI 1.58–1.74)、 ベムラフェニブ投与群5.32ヵ月 (95%CI 4.86–6.57) と、 統計学的に有意なPFSの延長が確認された (非層別Log-rank検定 p<0.0001)。 奏効割合はダカルバジン投与群5%、 ベムラフェニブ投与群48%であった。
有害事象とその対策
国内第I/Ⅱ相試験において安全性評価対象例11例中11例 (100%) に副作用が認められた。 主な副作用は、 関節痛10例 (90.9%)、 発疹 (湿疹、 丘疹等) 10例 (90.9%)、 筋骨格痛7例 (63.6%)、 脱毛症7例 (63.6%)、 疲労6例 (54.5%) 等であった⁴⁾。
また、 海外第Ⅲ相試験の結果から主な副作用として発疹 (湿疹、 丘疹等) 178例 (52.8%)、 関節痛162例 (48.1%)、 光線過敏症157例 (46.6%)、 脱毛症153例 (45.4%)、 疲労146例 (43.3%) 等がみられた³⁾。
さらに、 注意すべき副作用としてQT間隔延長と皮膚悪性腫瘍 (有棘細胞がん) の二次発がんがあげられる。 頻度は少ないが十分な観察が求められる。
出典
- 中外製薬株式会社. ゼルボラフ®電子添文 (2022年12月改訂 第2版) [最終閲覧 : 2024/8/25]
- 中外製薬株式会社. ゼルボラフ®適正使用ガイド (2022年7月作成) [最終閲覧 : 2024/8/25]
- Improved survival with vemurafenib in melanoma with BRAF V600E mutation. N Engl J Med. 2011 Jun 30;364(26):2507-16. PMID: 21639808
- Phase I/II study of vemurafenib in patients with unresectable or recurrent melanoma with BRAF(V) (600) mutations. J Dermatol. 2015 Jul;42(7):661-6. PMID: 25884515
その他情報は随時更新予定です
最終更新日 : 2024年8月25日
監修医師 : 国立がん研究センター中央病院皮膚腫瘍科長 山崎直也先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。