治療スケジュール
概要
監修医師
DTX:ドセタキセル(タキソテール®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 70mg/m² 点滴 | 1~ | Day1 |
前投薬
| デキサメタゾン注6.6mg day1 点滴、 ファモチジン注20mg day1 点滴、 クロルフェニラミン注5mg day1 点滴 |
その他
| 1コース21~28日間。 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
タキソテール® (添付文書¹⁾)
用法用量
電子添文¹⁾の用法および用量
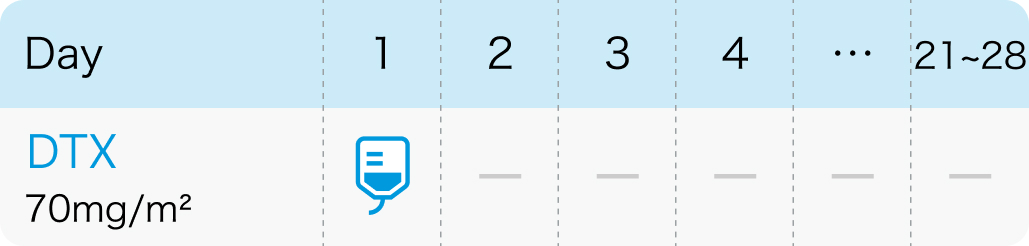
70mg/m²を1時間以上かけて3~4週間間隔で点滴静注
タキソテール®電子添文 (2024年6月改訂 第5版)¹⁾より作図、 引用
前投薬
LECレジメンとして扱う
- デキサメタゾン注6.6mg day1 点滴
- ファモチジン注20mg day1 点滴
- クロルフェニラミン注5mg day1 点滴
執筆 : 神奈川県立がんセンター消化器内科 古田 光寛先生
投与開始基準
第Ⅱ相試験²⁾のプロトコル
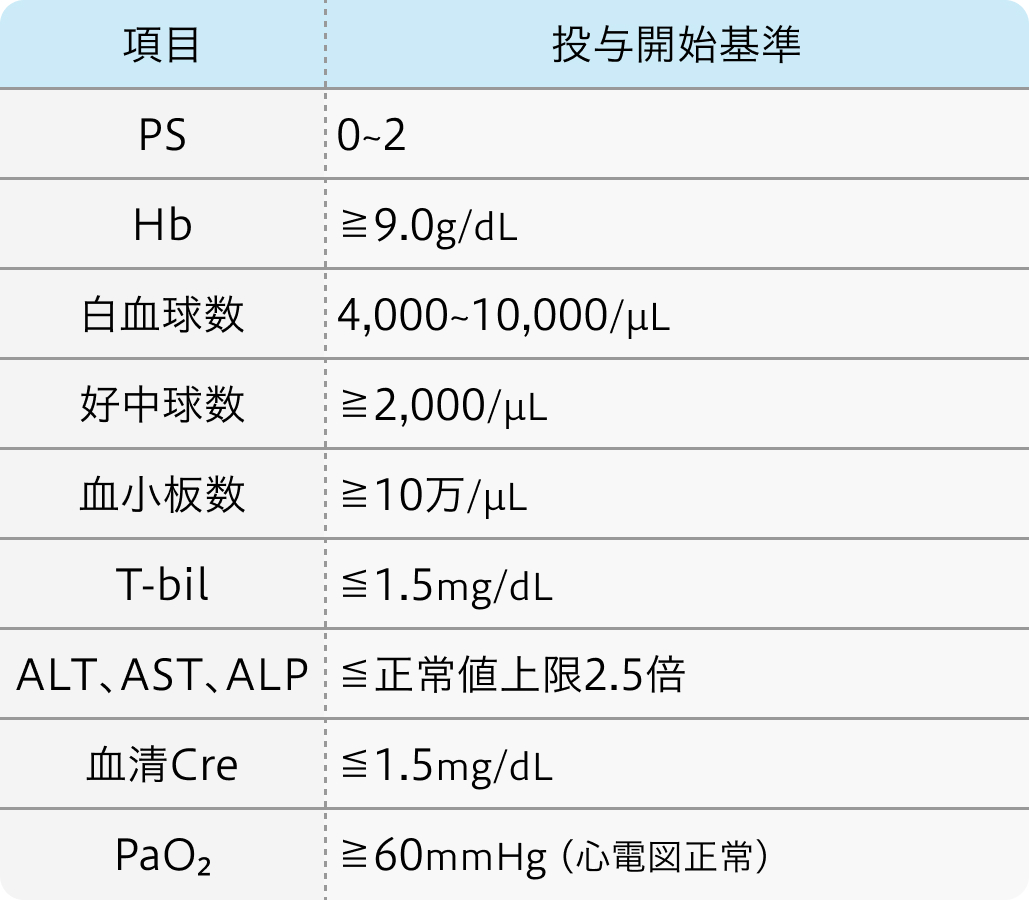
Ann Oncol. 2004 Jun;15(6):955-9²⁾より作図
減量・中止基準
第Ⅱ相試験²⁾のプロトコル
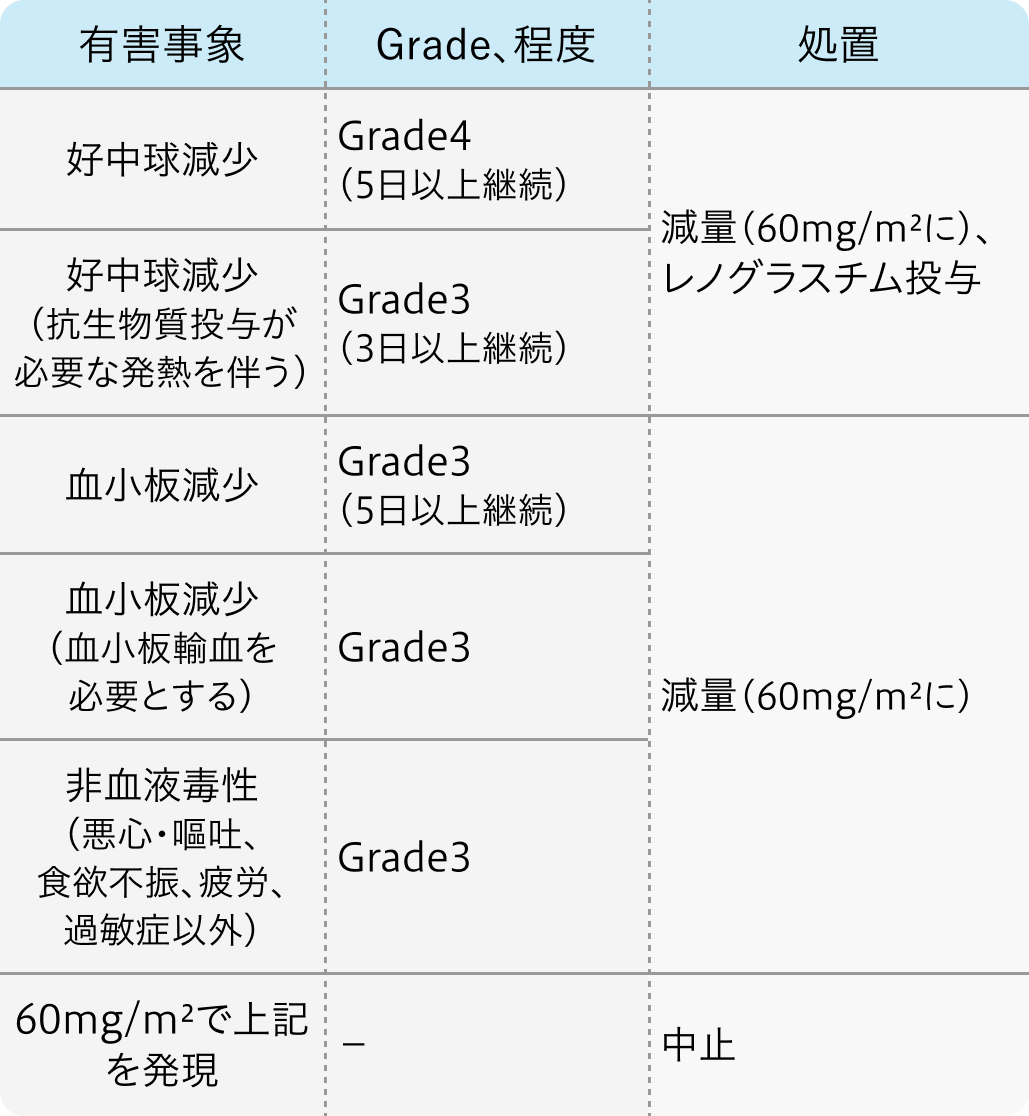
Ann Oncol. 2004 Jun;15(6):955-9²⁾より作図
主な有害事象
第Ⅱ相試験²⁾
主な有害事象 (カッコ内はGrade3~4)
- 好中球減少症 100% (87.8%)
- 白血球減少症 100% (73.5%)
- 貧血 67.3% (12.2%)
- 血小板減少症 28.6% (4.1%)
- 発熱性好中球減少症 18.4% (18.4%)
- 倦怠感 89.8% (12.2%)
- 下痢 40.8% (6.1%)
- 悪心 36.7% (4.1%)
- 嘔吐 16.3% (0%)
Ann Oncol. 2004 Jun;15(6):955-9²⁾より引用
上手に使うためのワンポイント
- 本レジメンはFP+Nivo/Pemが不応・不耐の症例もしくは2次治療でのニボルマブもしくはペムブロリズマブが不応・不耐となった症例が対象となる。
- フッ化ピリミジンおよびプラチナに不応となった食道扁平上皮癌に対する2次治療としてのパクリタキセルとドセタキセルを比較したOGSG1201試験³⁾ではパクリタキセル群でOS、 PFS、 ORRともに良好な成績であった。
- ドセタキセルにはアルコールフリー製剤があること、 パクリタキセルと比較して末梢神経障害の頻度が低いことなどから、 アルコール不耐や末梢神経障害を有する症例などパクリタキセルが不適と考えられる症例でドセタキセルを検討する。
執筆 : 神奈川県立がんセンター消化器内科 古田 光寛先生
特徴と注意点
- ドセタキセルにはアルコールが含まれる製剤とアルコールフリー製剤があり院内でどちらが採用されているかを確認しておく。 アルコールが含まれる場合は投与当日の車の運転を控えさせる。
- アレルギー反応が生じる可能性があるため抗アレルギー薬を投与する。
- ドセタキセルでは脱毛、 浮腫が出現するためあらかじめ説明しておく。
- OGSG1201試験³⁾では骨髄抑制が高頻度で認められ発熱性好中球数減少症も46%と高頻度であった。 このため、 発熱時の対応についても患者に説明しておく必要がある。
執筆 : 神奈川県立がんセンター消化器内科 古田 光寛先生
関連する臨床試験|第II相試験²⁾
転移性食道癌に対するドセタキセル単剤投与の効果を検証した第Ⅱ相試験の結果より、 治療効果は認められたものの、 好中球減少症の管理の必要性が示された。
部分奏効
- RECIST基準 : 20%
(95%CI 10-34%)
- WHO基準 : 24%
(95%CI 13-39%)
完全奏効はいなかった。
奏効期間 (中央値)
4.7ヵ月
全生存期間 (中央値)
8.1ヵ月
(95%CI 6.6-11.3ヵ月)
1年時OS率
35%
(95%CI 21-48%)
出典
- サノフィ株式会社. タキソテール®電子添文 (2024年6月改訂 第5版) [最終閲覧 : 2024/8/26]
- A phase II study of single-agent docetaxel in patients with metastatic esophageal cancer. Ann Oncol. 2004 Jun;15(6):955-9. PMID: 15151954
- Randomized phase II study of docetaxel versus paclitaxel in patients with esophageal squamous cell carcinoma refractory to fluoropyrimidine- and platinum-based chemotherapy: OGSG1201. Eur J Cancer. 2021 Sep:154:307-315. PMID: 34311300
最終更新日 : 2024年8月26日
執筆医 : 神奈川県立がんセンター消化器内科 古田 光寛先生
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
DTX
ドセタキセル (タキソテール®)
2024年08月28日更新
DTX:ドセタキセル(タキソテール®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 70mg/m² 点滴 | 1~ | Day1 |
前投薬
| デキサメタゾン注6.6mg day1 点滴、 ファモチジン注20mg day1 点滴、 クロルフェニラミン注5mg day1 点滴 |
その他
| 1コース21~28日間。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
タキソテール® (添付文書¹⁾)
用法用量
電子添文¹⁾の用法および用量

70mg/m²を1時間以上かけて3~4週間間隔で点滴静注
タキソテール®電子添文 (2024年6月改訂 第5版)¹⁾より作図、 引用
前投薬
LECレジメンとして扱う
- デキサメタゾン注6.6mg day1 点滴
- ファモチジン注20mg day1 点滴
- クロルフェニラミン注5mg day1 点滴
執筆 : 神奈川県立がんセンター消化器内科 古田 光寛先生
投与開始基準
第Ⅱ相試験²⁾のプロトコル

Ann Oncol. 2004 Jun;15(6):955-9²⁾より作図
減量・中止基準
第Ⅱ相試験²⁾のプロトコル

Ann Oncol. 2004 Jun;15(6):955-9²⁾より作図
主な有害事象
第Ⅱ相試験²⁾
主な有害事象 (カッコ内はGrade3~4)
- 好中球減少症 100% (87.8%)
- 白血球減少症 100% (73.5%)
- 貧血 67.3% (12.2%)
- 血小板減少症 28.6% (4.1%)
- 発熱性好中球減少症 18.4% (18.4%)
- 倦怠感 89.8% (12.2%)
- 下痢 40.8% (6.1%)
- 悪心 36.7% (4.1%)
- 嘔吐 16.3% (0%)
Ann Oncol. 2004 Jun;15(6):955-9²⁾より引用
上手に使うためのワンポイント
- 本レジメンはFP+Nivo/Pemが不応・不耐の症例もしくは2次治療でのニボルマブもしくはペムブロリズマブが不応・不耐となった症例が対象となる。
- フッ化ピリミジンおよびプラチナに不応となった食道扁平上皮癌に対する2次治療としてのパクリタキセルとドセタキセルを比較したOGSG1201試験³⁾ではパクリタキセル群でOS、 PFS、 ORRともに良好な成績であった。
- ドセタキセルにはアルコールフリー製剤があること、 パクリタキセルと比較して末梢神経障害の頻度が低いことなどから、 アルコール不耐や末梢神経障害を有する症例などパクリタキセルが不適と考えられる症例でドセタキセルを検討する。
執筆 : 神奈川県立がんセンター消化器内科 古田 光寛先生
特徴と注意点
- ドセタキセルにはアルコールが含まれる製剤とアルコールフリー製剤があり院内でどちらが採用されているかを確認しておく。 アルコールが含まれる場合は投与当日の車の運転を控えさせる。
- アレルギー反応が生じる可能性があるため抗アレルギー薬を投与する。
- ドセタキセルでは脱毛、 浮腫が出現するためあらかじめ説明しておく。
- OGSG1201試験³⁾では骨髄抑制が高頻度で認められ発熱性好中球数減少症も46%と高頻度であった。 このため、 発熱時の対応についても患者に説明しておく必要がある。
執筆 : 神奈川県立がんセンター消化器内科 古田 光寛先生
関連する臨床試験|第II相試験²⁾
転移性食道癌に対するドセタキセル単剤投与の効果を検証した第Ⅱ相試験の結果より、 治療効果は認められたものの、 好中球減少症の管理の必要性が示された。
部分奏効
- RECIST基準 : 20%
(95%CI 10-34%)
- WHO基準 : 24%
(95%CI 13-39%)
完全奏効はいなかった。
奏効期間 (中央値)
4.7ヵ月
全生存期間 (中央値)
8.1ヵ月
(95%CI 6.6-11.3ヵ月)
1年時OS率
35%
(95%CI 21-48%)
出典
- サノフィ株式会社. タキソテール®電子添文 (2024年6月改訂 第5版) [最終閲覧 : 2024/8/26]
- A phase II study of single-agent docetaxel in patients with metastatic esophageal cancer. Ann Oncol. 2004 Jun;15(6):955-9. PMID: 15151954
- Randomized phase II study of docetaxel versus paclitaxel in patients with esophageal squamous cell carcinoma refractory to fluoropyrimidine- and platinum-based chemotherapy: OGSG1201. Eur J Cancer. 2021 Sep:154:307-315. PMID: 34311300
最終更新日 : 2024年8月26日
執筆医 : 神奈川県立がんセンター消化器内科 古田 光寛先生
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(消化器)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
