概要
監修医師
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
タキソール® (添付文書)
用法用量
SBCCSG-01試験¹⁾より抜粋
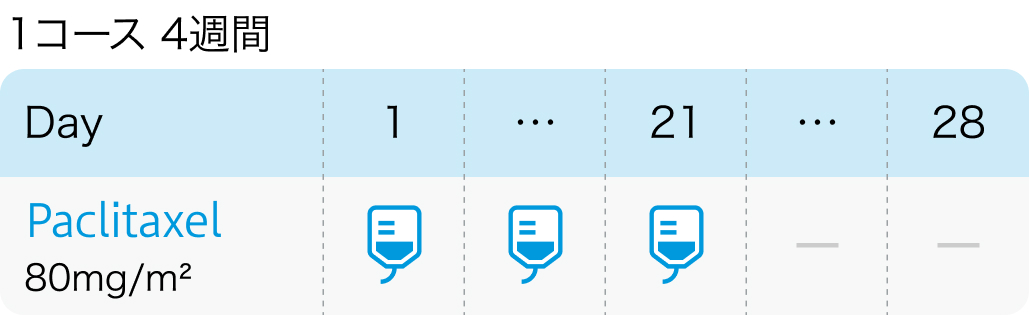
添付文書とはパクリタクセルの用法が異なる。 添付文書では、 「1日1回210mg/m2(体表面積)を3時間かけて点滴静注し、 少なくとも3週間休薬」もしくは「1日1回100mg/m²を1時間かけて点滴静注し、 週1回投与を6週連続し、 少なくとも2週間休薬」と記載あり
前投薬
パクリタキセル製剤の添加剤であるポリオキシエチレンヒマシ油での重篤な過敏症状の発現を防止するための、 投与前にH1ブロッカー、H2ブロッカー、ステロイドを検討する。
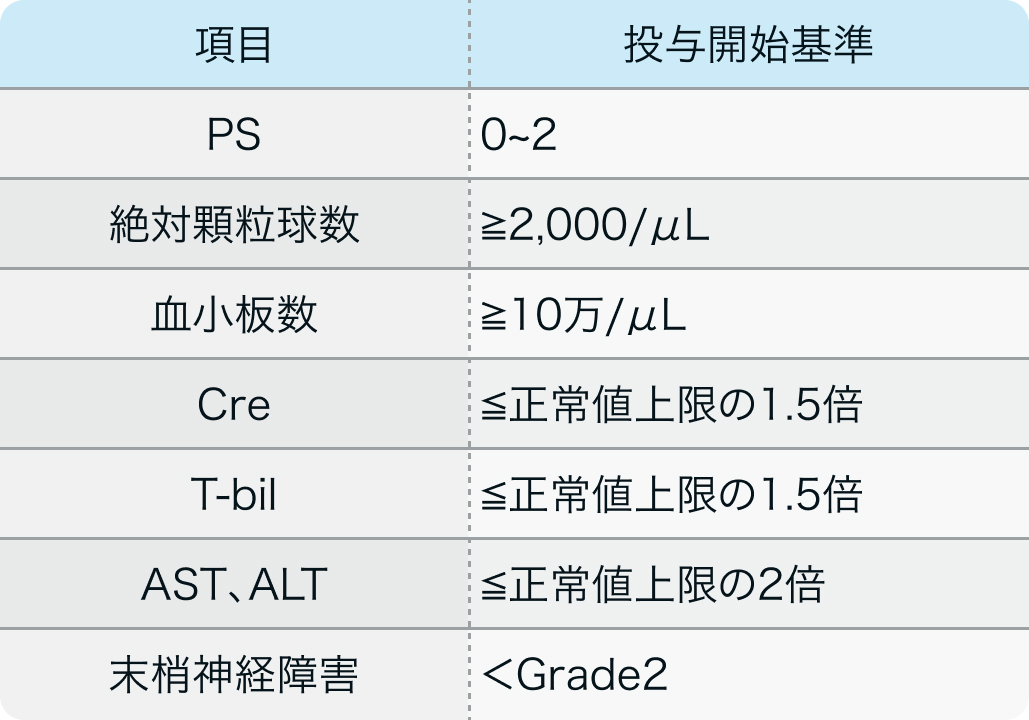
投与開始基準
SBCCSG-01試験¹⁾より抜粋
18~75歳で組織学的に確認された進行性または転移性乳癌の以下に該当する患者
主な有害事象
SBCCSG-01試験¹⁾
有害事象データを一部引用 (カッコ内はGrade3~4)
主な有害事象
- 白血球数減少 50.0% (14.9%)
- 好中球数減少 45.9% (10.8%)
- 発熱性好中球減少症 1.4% (1.4%)
- Hb減少 36.5% (1.4%)
- 血小板数減少 4.1% (0%)
- AST増加 20.3% (0%)
- 悪心 24.3% (0%)
- 嘔吐 6.8% (0%)
- 下痢 8.1% (1.4%)
- 倦怠感 36.5% (1.4%)
注意すべき有害事象
- 脱毛症 93.2% (0%)
特徴と注意点
- HER2陰性の転移再発乳癌が対象で病勢進行まで継続する。
- 1週間に1回80mg/m²で3週投与し、 その後1週間休薬。
- パクリタキセルは1時間で点滴。
- パクリタキセルは無水エタノールを含有するため、 アルコール不耐の患者への投与には注意が必要である。
- パクリタキセル投与時は、 可塑剤としてDEHPを含有しているものの使用を避ける。
- 併用禁忌はジスルフィラム、シアナミド、プロカルバジン塩酸塩 (アルコール反応を起こす恐れ) である。
- 併用注意はアゾール系抗真菌薬、 マクロライド系抗生剤、 ビタミンA、 ジヒドロピリジン系カルシウムチャンネルブロッカー、 ステロイド系ホルモン剤、 シクロスポリン、 ベラパミル塩酸塩、 キニジン硫酸塩水和物、 ミダゾラム、 フェナセチン、 ラパチニブトシル酸塩水和物 (CYP2C8、 CYP3A4等を阻害し、 パクリタキセルの代謝が阻害され、 パクリタキセルの血中濃度が上昇する)
参考文献
最終更新日:2023年11月20日
監修医師:HOKUTO編集部監修医師
執筆:公益財団法人 がん研究会 がん研有明病院 薬剤部 平岡 知子先生
Paclitaxel (3週投与1週休薬)
パクリタキセル (タキソール®)
2024年03月06日更新
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
タキソール® (添付文書)
用法用量
SBCCSG-01試験¹⁾より抜粋

添付文書とはパクリタクセルの用法が異なる。 添付文書では、 「1日1回210mg/m2(体表面積)を3時間かけて点滴静注し、 少なくとも3週間休薬」もしくは「1日1回100mg/m²を1時間かけて点滴静注し、 週1回投与を6週連続し、 少なくとも2週間休薬」と記載あり
前投薬
パクリタキセル製剤の添加剤であるポリオキシエチレンヒマシ油での重篤な過敏症状の発現を防止するための、 投与前にH1ブロッカー、H2ブロッカー、ステロイドを検討する。
投与開始基準
SBCCSG-01試験¹⁾より抜粋
18~75歳で組織学的に確認された進行性または転移性乳癌の以下に該当する患者

主な有害事象
SBCCSG-01試験¹⁾
有害事象データを一部引用 (カッコ内はGrade3~4)
主な有害事象
- 白血球数減少 50.0% (14.9%)
- 好中球数減少 45.9% (10.8%)
- 発熱性好中球減少症 1.4% (1.4%)
- Hb減少 36.5% (1.4%)
- 血小板数減少 4.1% (0%)
- AST増加 20.3% (0%)
- 悪心 24.3% (0%)
- 嘔吐 6.8% (0%)
- 下痢 8.1% (1.4%)
- 倦怠感 36.5% (1.4%)
注意すべき有害事象
- 脱毛症 93.2% (0%)
特徴と注意点
- HER2陰性の転移再発乳癌が対象で病勢進行まで継続する。
- 1週間に1回80mg/m²で3週投与し、 その後1週間休薬。
- パクリタキセルは1時間で点滴。
- パクリタキセルは無水エタノールを含有するため、 アルコール不耐の患者への投与には注意が必要である。
- パクリタキセル投与時は、 可塑剤としてDEHPを含有しているものの使用を避ける。
- 併用禁忌はジスルフィラム、シアナミド、プロカルバジン塩酸塩 (アルコール反応を起こす恐れ) である。
- 併用注意はアゾール系抗真菌薬、 マクロライド系抗生剤、 ビタミンA、 ジヒドロピリジン系カルシウムチャンネルブロッカー、 ステロイド系ホルモン剤、 シクロスポリン、 ベラパミル塩酸塩、 キニジン硫酸塩水和物、 ミダゾラム、 フェナセチン、 ラパチニブトシル酸塩水和物 (CYP2C8、 CYP3A4等を阻害し、 パクリタキセルの代謝が阻害され、 パクリタキセルの血中濃度が上昇する)
参考文献
最終更新日:2023年11月20日
監修医師:HOKUTO編集部監修医師
執筆:公益財団法人 がん研究会 がん研有明病院 薬剤部 平岡 知子先生
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(乳腺)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。