治療スケジュール
概要
監修医師
Rmab:Ramucirumab(サイラムザ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 8mg/kg 点滴 | 1~ | Day1 |
CPT-11:Irinotecan(トポテシン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 150~180mg/m² 点滴 | 1~ | Day1 |
l-LV:Levofolinate(アイソボリン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg/m² 点滴 | 1~ | Day1 |
5-FU:Fluorouracil(5-FU®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 400mg/m² 急速静注 | 1~ | Day1 |
| 2,,400mg/m² 持続静注 | 1~ | Day1~3 |
その他
| 1コース14日間。 |
| CPT-11+l-LV+5-FUをFORFIRI療法と呼ぶ。 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*日本イーライリリー株式会社の外部サイトへ遷移します
用法用量
RAISE試験⁶⁾のプロトコル
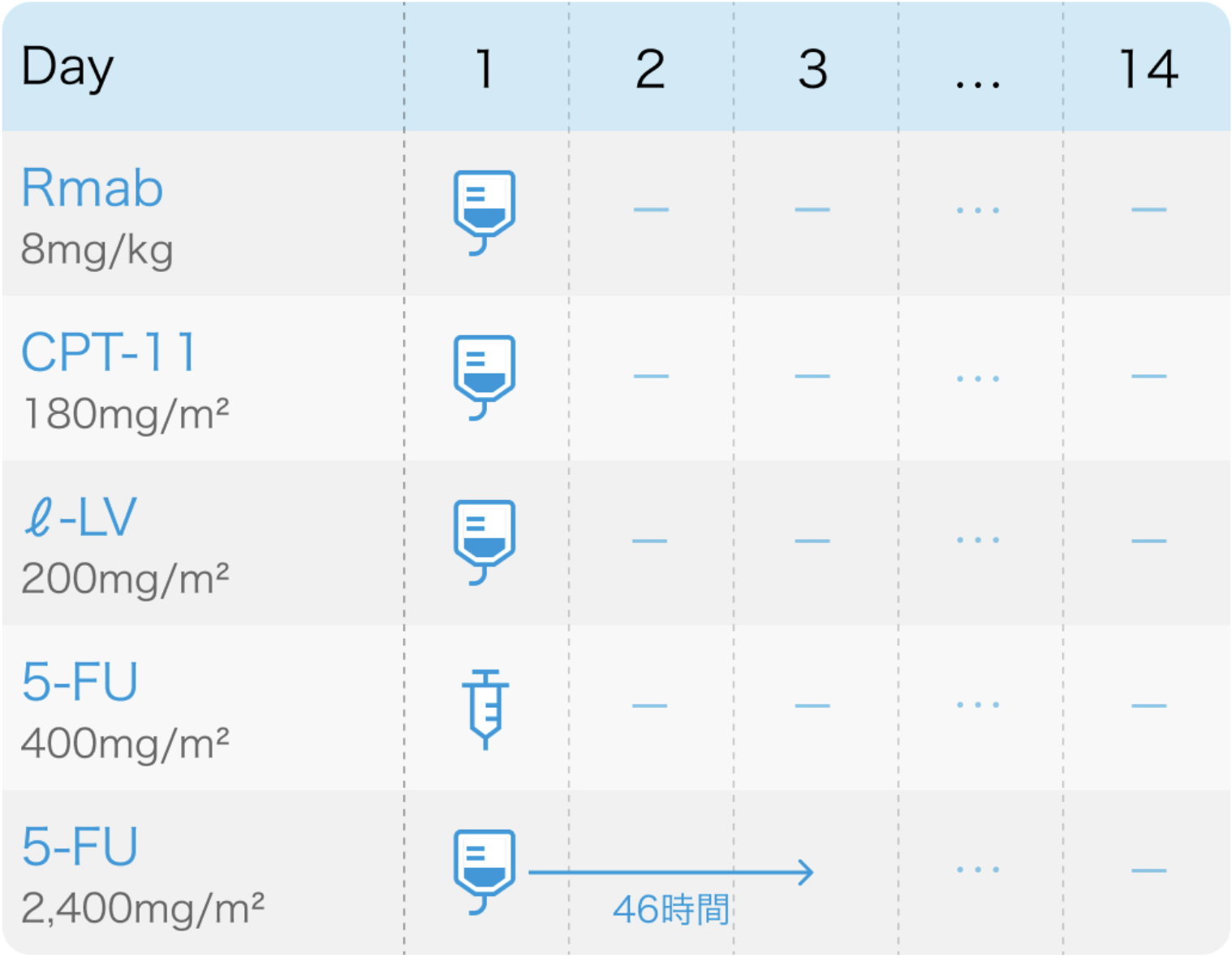
Lancet Oncol. 2015 May;16(5):499-508⁶⁾より作図
投与開始基準
RAISE試験⁶⁾のプロトコル (FOLFIRI)

Lancet Oncol. 2015 May;16(5):499-508⁶⁾より作図
減量・休薬・中止基準
RAISE試験¹⁾のプロトコル (FOLFIRI)
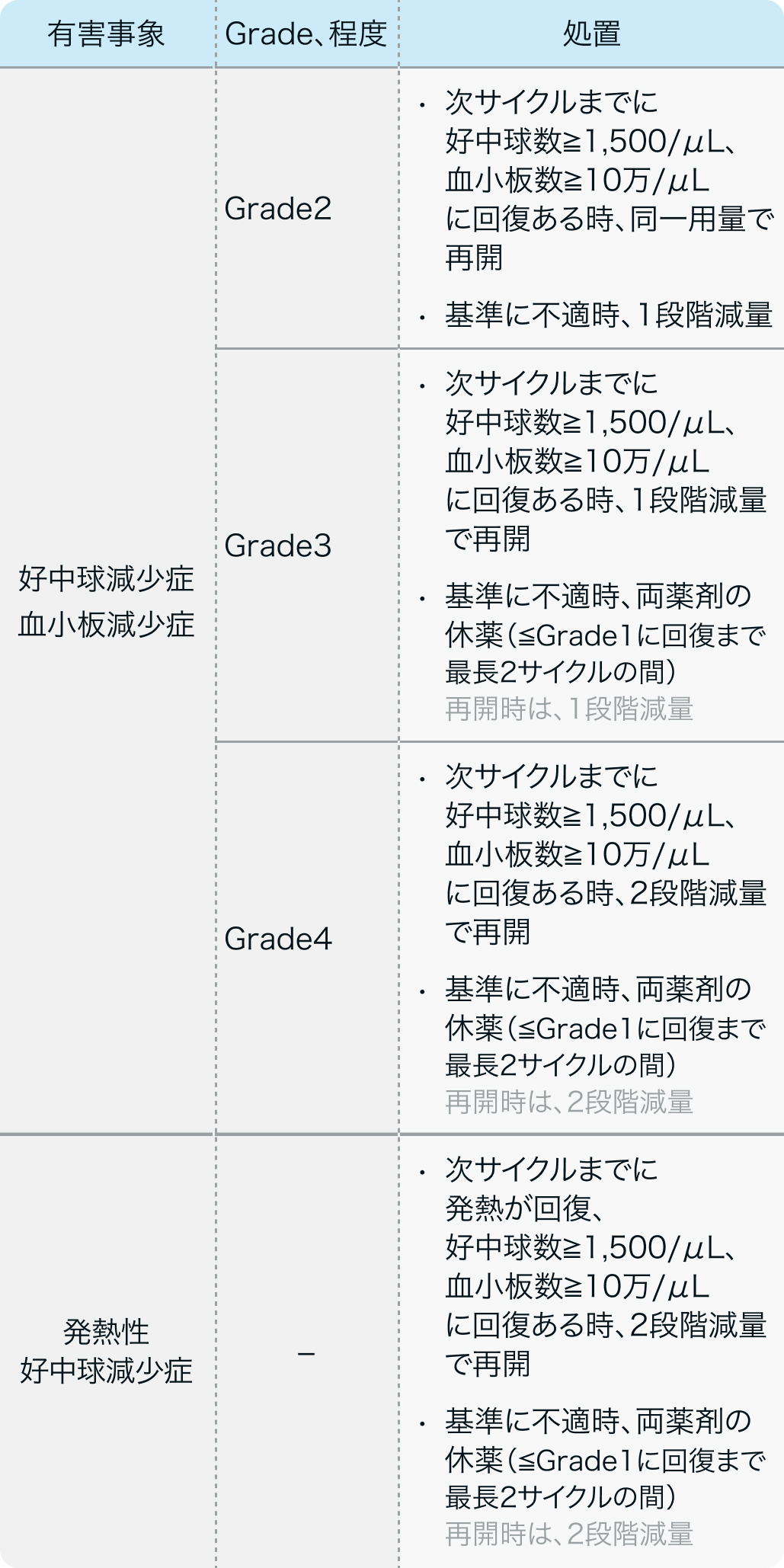
Lancet Oncol. 2015 May;16(5):499-508⁶⁾より作図
ラムシルマブ電子添文⁴⁾の基準

サイラムザ®電子添文 (2024年6月改訂第4版)⁴⁾より作図
初回基準量と減量レベル

Lancet Oncol. 2015 May;16(5):499-508⁶⁾、 サイラムザ®電子添文 (2024年6月改訂第4版)⁴⁾より作図
主な有害事象
RAISE試験⁶⁾
主な有害事象 (カッコ内はGrade3~4)
- 好中球減少症 35.5% (21.7%)
- 貧血 15.9% (1.5%)
- 血小板減少症 14.6% (1.3%)
- 下痢 59.7% (10.8%)
- 悪心 49.5% (2.5%)
- 口内炎 30.8% (3.8%)
- 嘔吐 29.1% (2.8%)
- 便秘 28.5% (0.9%)
- 腹痛 22.3% (3.0%)
- 消化不良 5.1% (0.2%)
- 疲労 46.7% (7.9%)
- 発熱 15.1% (0.4%)
- 倦怠感 7.4% (0%)
- 好中球数減少 25.9% (17.4%)
- 血小板数減少 14.7% (1.9%)
- 白血球数減少 8.9% (2.1%)
- 食欲減退 37.4% (2.5%)
注意すべき有害事象(カッコ内はGrade3~4)
- 末梢性感覚ニューロパチー 5.3% (0.9%)
- 蛋白尿 16.8% (2.8%)
- 脱毛症 29.3% (0%)
- 手掌・足底発赤知覚不全症候群 12.9% (1.1%)
- 高血圧 25.7% (10.8%)
Lancet Oncol. 2015 May;16(5):499-508⁶⁾より引用
上手に使うためのワンポイント
- 前治療でフッ化ピリミジンを含んだレジメンを使用後の2次治療として使用する際には、 必ずしも5-FUは必要ではない。 そのため、 毒性による減量を考慮する場合には5-FUを優先して減量・中止することを考慮する。
- 一般的には好中球数≧1500/μLが投与開始基準となっているが、 前治療の骨髄抑制が軽微だった場合など、 毒性が軽度だろうと予想できる場合には好中球数1200/μL前後でも投与可能とする医師はいる。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
特徴と注意点
- イリノテカン180mg/m²でレジメン登録をされている施設もあると考えられるため、 オーダーする際には体表面積あたりの設定用量を確認すること。 国内試験の結果から実際は150mg/m²で投与されることが多い。180mg/m²で使用する場合にはUGT1A1遺伝子多型検査の結果を確認すること。
- 2次治療以降のレジメンであり、 純粋な1次治療としては用いるエビデンスに乏しい。 術後補助化学療法CAPOX/FOLFOX後の早期再発例には選択肢となり得る。
- RAS野生型で抗EGFR抗体を含む1次治療後の2次治療としてのエビデンスがある。
- 2次治療として用いる場合は、 前治療における毒性と減量薬剤を考慮した初回用量設定を行う。
- 若年・女性など、 悪心リスクが高い患者には、 初回投与時から選択的NK1受容体拮抗型制吐剤を前投薬として用いることを検討する。
- ベバシズマブによる尿蛋白1+出現時には、 次コースからのUPCRの事前測定を考慮する。 リアルワールドでは、 尿蛋白2+でもUPCR<2.0で投与可能とする医師はいる。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
関連する臨床試験
RAISE試験⁶⁾
ベバシズマブ、 オキサリプラチン及びフッ化ピリミジン系薬剤の併用投与による1次治療中又はその後に増悪した転移性結腸・直腸癌患者を対象にFOLFIRI+サイラムザ又はプラセボを併用投与したときの全生存期間をサイラムザとプラセボ間で比較する試験。 日本人を含む1072例を検証した。
Lancet Oncol. 2015 May;16(5):499-508.
出典
- 協和キリン株式会社. 5-FU®電子添文 (2024年6月改訂 第4版) [最終閲覧 : 2024/7/17]
- ファイザー・ファーマ株式会社. アイソボリン®電子添文 (2023年3月改訂 第1版) [最終閲覧 : 2024/7/17]
- アルフレッサ ファーマ株式会社. トポテシン®電子添文 (2023年8月改訂 第1版) [最終閲覧 : 2024/7/17]
- 日本イーライリリー株式会社. サイラムザ®電子添文 (2024年6月改訂第4版) [最終閲覧 : 2024/7/17]
- 日本イーライリリー株式会社. サイラムザ®適正使用ガイド (2024年6月作成) [最終閲覧 : 2024/7/17]
- Ramucirumab versus placebo in combination with second-line FOLFIRI in patients with metastatic colorectal carcinoma that progressed during or after first-line therapy with bevacizumab, oxaliplatin, and a fluoropyrimidine (RAISE): a randomised, double-blind, multicentre, phase 3 study. Lancet Oncol. 2015 May;16(5):499-508. PMID: 25877855
最終更新日 : 2024年8月21日
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
FOLFIRI + RAM
フルオロウラシル + レボホリナート + イリノテカン + ラムシルマブ
2024年08月21日更新
Rmab:Ramucirumab(サイラムザ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 8mg/kg 点滴 | 1~ | Day1 |
CPT-11:Irinotecan(トポテシン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 150~180mg/m² 点滴 | 1~ | Day1 |
l-LV:Levofolinate(アイソボリン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg/m² 点滴 | 1~ | Day1 |
5-FU:Fluorouracil(5-FU®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 400mg/m² 急速静注 | 1~ | Day1 |
| 2,,400mg/m² 持続静注 | 1~ | Day1~3 |
その他
| 1コース14日間。 |
| CPT-11+l-LV+5-FUをFORFIRI療法と呼ぶ。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*日本イーライリリー株式会社の外部サイトへ遷移します
用法用量
RAISE試験⁶⁾のプロトコル

Lancet Oncol. 2015 May;16(5):499-508⁶⁾より作図
投与開始基準
RAISE試験⁶⁾のプロトコル (FOLFIRI)

Lancet Oncol. 2015 May;16(5):499-508⁶⁾より作図
減量・休薬・中止基準
RAISE試験¹⁾のプロトコル (FOLFIRI)

Lancet Oncol. 2015 May;16(5):499-508⁶⁾より作図
ラムシルマブ電子添文⁴⁾の基準

サイラムザ®電子添文 (2024年6月改訂第4版)⁴⁾より作図
初回基準量と減量レベル

Lancet Oncol. 2015 May;16(5):499-508⁶⁾、 サイラムザ®電子添文 (2024年6月改訂第4版)⁴⁾より作図
主な有害事象
RAISE試験⁶⁾
主な有害事象 (カッコ内はGrade3~4)
- 好中球減少症 35.5% (21.7%)
- 貧血 15.9% (1.5%)
- 血小板減少症 14.6% (1.3%)
- 下痢 59.7% (10.8%)
- 悪心 49.5% (2.5%)
- 口内炎 30.8% (3.8%)
- 嘔吐 29.1% (2.8%)
- 便秘 28.5% (0.9%)
- 腹痛 22.3% (3.0%)
- 消化不良 5.1% (0.2%)
- 疲労 46.7% (7.9%)
- 発熱 15.1% (0.4%)
- 倦怠感 7.4% (0%)
- 好中球数減少 25.9% (17.4%)
- 血小板数減少 14.7% (1.9%)
- 白血球数減少 8.9% (2.1%)
- 食欲減退 37.4% (2.5%)
注意すべき有害事象(カッコ内はGrade3~4)
- 末梢性感覚ニューロパチー 5.3% (0.9%)
- 蛋白尿 16.8% (2.8%)
- 脱毛症 29.3% (0%)
- 手掌・足底発赤知覚不全症候群 12.9% (1.1%)
- 高血圧 25.7% (10.8%)
Lancet Oncol. 2015 May;16(5):499-508⁶⁾より引用
上手に使うためのワンポイント
- 前治療でフッ化ピリミジンを含んだレジメンを使用後の2次治療として使用する際には、 必ずしも5-FUは必要ではない。 そのため、 毒性による減量を考慮する場合には5-FUを優先して減量・中止することを考慮する。
- 一般的には好中球数≧1500/μLが投与開始基準となっているが、 前治療の骨髄抑制が軽微だった場合など、 毒性が軽度だろうと予想できる場合には好中球数1200/μL前後でも投与可能とする医師はいる。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
特徴と注意点
- イリノテカン180mg/m²でレジメン登録をされている施設もあると考えられるため、 オーダーする際には体表面積あたりの設定用量を確認すること。 国内試験の結果から実際は150mg/m²で投与されることが多い。180mg/m²で使用する場合にはUGT1A1遺伝子多型検査の結果を確認すること。
- 2次治療以降のレジメンであり、 純粋な1次治療としては用いるエビデンスに乏しい。 術後補助化学療法CAPOX/FOLFOX後の早期再発例には選択肢となり得る。
- RAS野生型で抗EGFR抗体を含む1次治療後の2次治療としてのエビデンスがある。
- 2次治療として用いる場合は、 前治療における毒性と減量薬剤を考慮した初回用量設定を行う。
- 若年・女性など、 悪心リスクが高い患者には、 初回投与時から選択的NK1受容体拮抗型制吐剤を前投薬として用いることを検討する。
- ベバシズマブによる尿蛋白1+出現時には、 次コースからのUPCRの事前測定を考慮する。 リアルワールドでは、 尿蛋白2+でもUPCR<2.0で投与可能とする医師はいる。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
関連する臨床試験
RAISE試験⁶⁾
ベバシズマブ、 オキサリプラチン及びフッ化ピリミジン系薬剤の併用投与による1次治療中又はその後に増悪した転移性結腸・直腸癌患者を対象にFOLFIRI+サイラムザ又はプラセボを併用投与したときの全生存期間をサイラムザとプラセボ間で比較する試験。 日本人を含む1072例を検証した。
Lancet Oncol. 2015 May;16(5):499-508.
出典
- 協和キリン株式会社. 5-FU®電子添文 (2024年6月改訂 第4版) [最終閲覧 : 2024/7/17]
- ファイザー・ファーマ株式会社. アイソボリン®電子添文 (2023年3月改訂 第1版) [最終閲覧 : 2024/7/17]
- アルフレッサ ファーマ株式会社. トポテシン®電子添文 (2023年8月改訂 第1版) [最終閲覧 : 2024/7/17]
- 日本イーライリリー株式会社. サイラムザ®電子添文 (2024年6月改訂第4版) [最終閲覧 : 2024/7/17]
- 日本イーライリリー株式会社. サイラムザ®適正使用ガイド (2024年6月作成) [最終閲覧 : 2024/7/17]
- Ramucirumab versus placebo in combination with second-line FOLFIRI in patients with metastatic colorectal carcinoma that progressed during or after first-line therapy with bevacizumab, oxaliplatin, and a fluoropyrimidine (RAISE): a randomised, double-blind, multicentre, phase 3 study. Lancet Oncol. 2015 May;16(5):499-508. PMID: 25877855
最終更新日 : 2024年8月21日
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(消化器)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。

