本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ヌクレオシド系抗悪性腫瘍剤 トリフルリジン・チピラシル
*大鵬薬品の外部サイトへ遷移します
投与スケジュール
電子添文¹⁾の用法および用量 (1コース4週)

ロンサーフ®電子添文 (2024年10月改訂 第4版)¹⁾より作図
1コース2週間として以下の投与を繰り返す
- 1日2回 (朝夕) 5日間経口投与し、2日間休薬
- 上記を2回繰り返したのち14日間休薬
<参考: 体表面積に応じたFTD/TPI初回投与量>
基準量 (トリフルリジンとして約35mg/m²/回) をもとに体表面積 (BSA) から1回投与量を決定
BSA<1.07m² :35mg/回 (70mg/日)
1.07≦BSA<1.23:40mg/回 (80mg/日)
1.23≦BSA<1.38:45mg/回 (90mg/日)
1.38≦BSA<1.53:50mg/回 (100mg/日)
1.53≦BSA<1.69:55mg/回 (110mg/日)
1.69≦BSA<1.84:60mg/回 (120mg/日)
1.84≦BSA<1.99:65mg/回 (130mg/日)
1.99≦BSA<2.15:70mg/回 (140mg/日)
2.15≦BSA :75mg/回 (150mg/日)
ロンサーフ®電子添文 (2024年10月改訂 第4版)¹⁾より引用
各プロトコル
投与開始基準
適正使用ガイド²⁾の基準
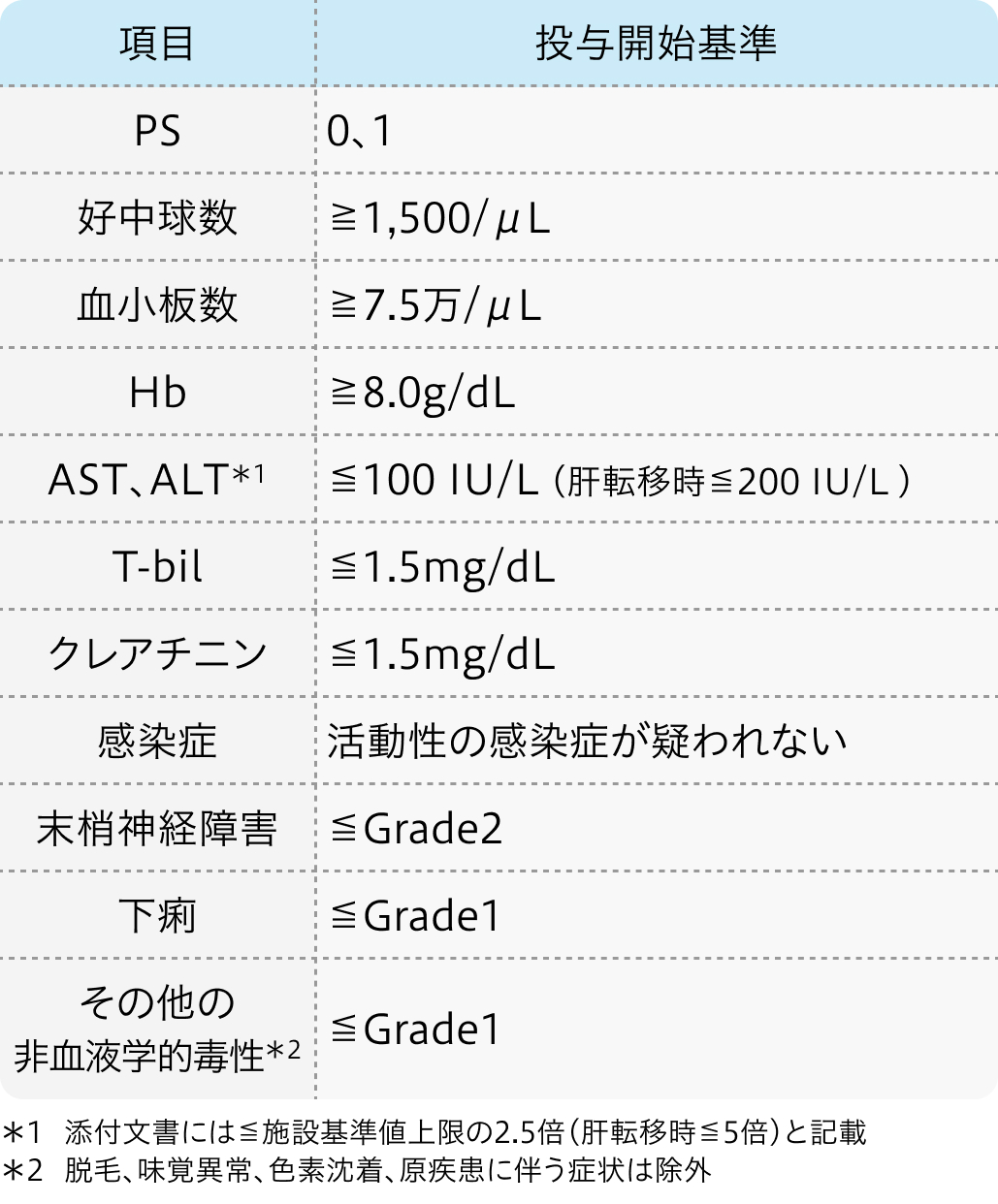
ロンサーフ®適正使用ガイド²⁾より作図
減量・休薬基準
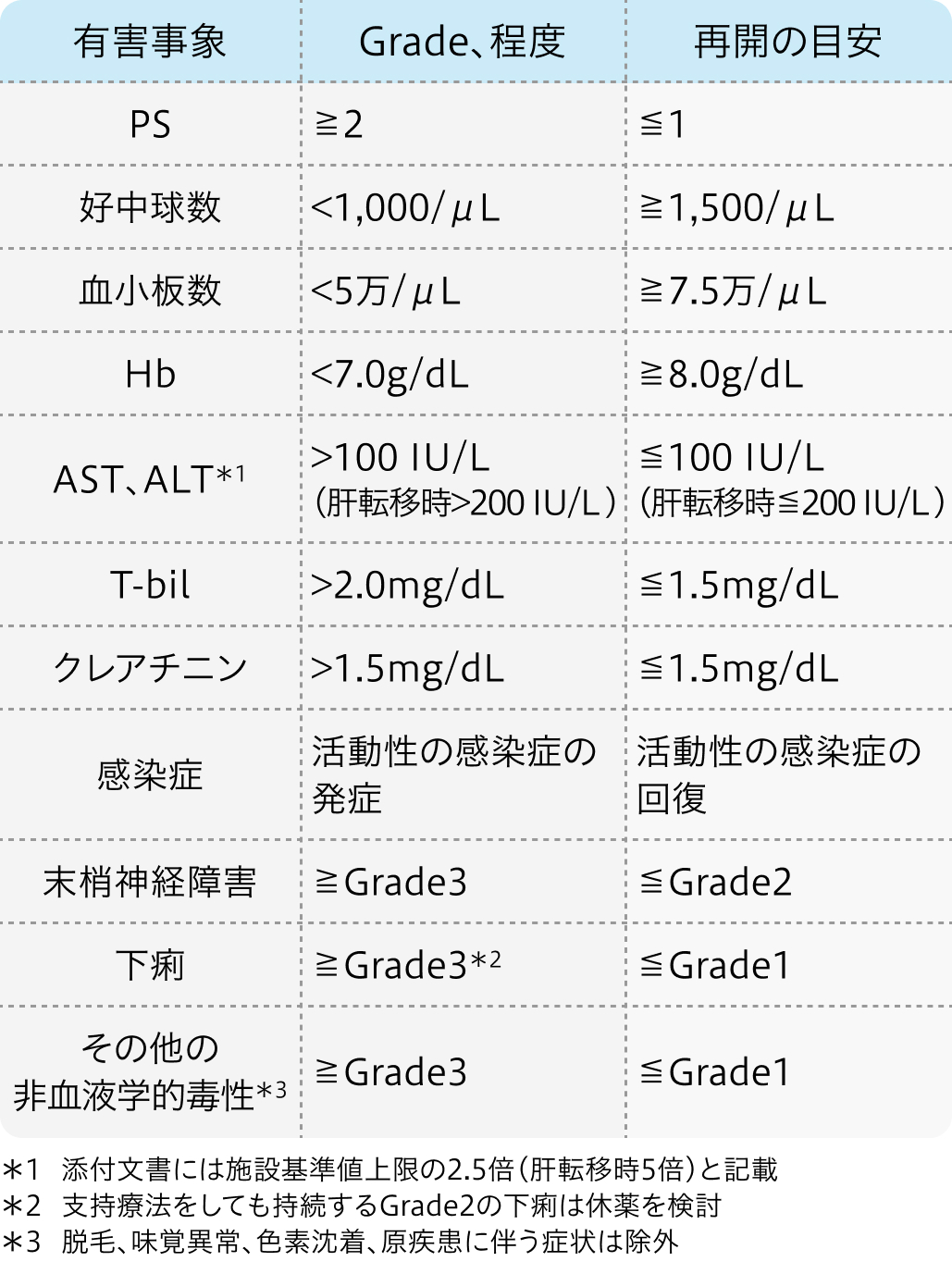

ロンサーフ®適正使用ガイド²⁾より作図
主な有害事象
TAGS試験³⁾
主な有害事象 (カッコ内はGrade3~4)
- 好中球減少症 37.6% (23.0%)
- 貧血 31.0% (11.0%)
- 白血球減少症 15.5% (6.9%)
- 血小板減少症 8.4% (1.8%)
- リンパ球減少 5.4% (1.2%)
- 汎血球減少症 2.1% (2.1%)
- 発熱性好中球減少症 1.8% (1.8%)
- 悪心 25.4% (2.1%)
- 下痢 16.1% (2.7%)
- 嘔吐 10.7% (0.6%)
- 便秘 3.6% (0%)
- 口内炎 3.6% (0%)
- 疲労 18.8% (3.0%)
- 発熱 3.0% (0%)
- 倦怠感 2.7% (0%)
- 好中球減少 14.9% (11.0%)
- 血小板減少 7.2% (1.2%)
- 白血球減少 6.9% (2.7%)
- 体重減少 2.7% (0.3%)
- 食欲減退 18.2% (3.0%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 高血糖 0.6% (0%)
- 末梢性ニューロパチー 1.2% (0.3%)
- 末梢性ニューロパチー 0.3% (0%)
- 蛋白尿 0.3% (0%)
- 脱毛症 3.6% (0.3%)
- 高血圧 0.3% (0.3%)
Lancet Oncol. 2018 Nov;19(11):1437-1448³⁾より引用
上手に使うためのワンポイント
国内ではCINVリスクが中等度とされており、 その他患者要因のCINVリスク (若年、 女性など) や前治療までのCINV状況を加味して、 前投薬を工夫する。
内服方法が複雑であるため、 初回コースの内服期間は1週毎の診察にするなど患者ごとの理解力にあわせて検討する。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
特徴と注意点
胃癌治療ガイドライン医師用 2021年7月改訂 第6版では、 胃癌3次治療において 「推奨される化学療法レジメン」 である。
骨髄抑制による治療開始延期割合が高いため、 回復までの延期日数によっては2週休薬を3週休薬にするなどの工夫が必要である。
有害事象としてILDの報告が少ないため、 前治療によるILD発症症例には選択肢となる。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
関連する臨床試験
TAGS試験³⁾
Lancet Oncol. 2018;19(11):1437-48.
フッ化ピリミジン系抗悪性腫瘍剤、 白金系抗悪性腫瘍剤並びにタキサン系抗悪性腫瘍剤及び/又はイリノテカンを用いた化学療法並びにヒト上皮細胞増殖因子受容体2 (HER2) /neu陽性 (HER2+) が判明している場合は抗HER2療法を含む2レジメン以上が施行され不応又は不耐となった治癒切除不能な進行・再発の胃癌を対象に、 ロンサーフのプラセボ投与に対する優越性の検証を目的とした多施設国際共同無作為化二重盲検第Ⅲ相比較試験。 主要評価項目は全生存期間 (OS)、 副次評価項目は無増悪生存期間 (PFS)、 奏効率 (ORR)、 病勢コントロール率 (DCR)、 ECOG PSが2以上に悪化するまでの期間、 EORTC QLQ-C30、 EORTC QLQ-STO22とされた。
出典
- 大鵬薬品工業株式会社. ロンサーフ®電子添文 (2024年10月改訂 第4版) [最終閲覧 : 2024/11/29]
- 大鵬薬品工業株式会社. ロンサーフ®適正使用ガイド [最終閲覧 : 2024/11/29]
- Trifluridine/tipiracil versus placebo in patients with heavily pretreated metastatic gastric cancer (TAGS): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2018 Nov;19(11):1437-1448. PMID: 30355453
最終更新日:2024年11月29日
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
FTD/TPI
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ヌクレオシド系抗悪性腫瘍剤 トリフルリジン・チピラシル
*大鵬薬品の外部サイトへ遷移します
投与スケジュール
電子添文¹⁾の用法および用量 (1コース4週)

ロンサーフ®電子添文 (2024年10月改訂 第4版)¹⁾より作図
1コース2週間として以下の投与を繰り返す
- 1日2回 (朝夕) 5日間経口投与し、2日間休薬
- 上記を2回繰り返したのち14日間休薬
<参考: 体表面積に応じたFTD/TPI初回投与量>
基準量 (トリフルリジンとして約35mg/m²/回) をもとに体表面積 (BSA) から1回投与量を決定
BSA<1.07m² :35mg/回 (70mg/日)
1.07≦BSA<1.23:40mg/回 (80mg/日)
1.23≦BSA<1.38:45mg/回 (90mg/日)
1.38≦BSA<1.53:50mg/回 (100mg/日)
1.53≦BSA<1.69:55mg/回 (110mg/日)
1.69≦BSA<1.84:60mg/回 (120mg/日)
1.84≦BSA<1.99:65mg/回 (130mg/日)
1.99≦BSA<2.15:70mg/回 (140mg/日)
2.15≦BSA :75mg/回 (150mg/日)
ロンサーフ®電子添文 (2024年10月改訂 第4版)¹⁾より引用
各プロトコル
投与開始基準
適正使用ガイド²⁾の基準

ロンサーフ®適正使用ガイド²⁾より作図
減量・休薬基準


ロンサーフ®適正使用ガイド²⁾より作図
主な有害事象
TAGS試験³⁾
主な有害事象 (カッコ内はGrade3~4)
- 好中球減少症 37.6% (23.0%)
- 貧血 31.0% (11.0%)
- 白血球減少症 15.5% (6.9%)
- 血小板減少症 8.4% (1.8%)
- リンパ球減少 5.4% (1.2%)
- 汎血球減少症 2.1% (2.1%)
- 発熱性好中球減少症 1.8% (1.8%)
- 悪心 25.4% (2.1%)
- 下痢 16.1% (2.7%)
- 嘔吐 10.7% (0.6%)
- 便秘 3.6% (0%)
- 口内炎 3.6% (0%)
- 疲労 18.8% (3.0%)
- 発熱 3.0% (0%)
- 倦怠感 2.7% (0%)
- 好中球減少 14.9% (11.0%)
- 血小板減少 7.2% (1.2%)
- 白血球減少 6.9% (2.7%)
- 体重減少 2.7% (0.3%)
- 食欲減退 18.2% (3.0%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 高血糖 0.6% (0%)
- 末梢性ニューロパチー 1.2% (0.3%)
- 末梢性ニューロパチー 0.3% (0%)
- 蛋白尿 0.3% (0%)
- 脱毛症 3.6% (0.3%)
- 高血圧 0.3% (0.3%)
Lancet Oncol. 2018 Nov;19(11):1437-1448³⁾より引用
上手に使うためのワンポイント
国内ではCINVリスクが中等度とされており、 その他患者要因のCINVリスク (若年、 女性など) や前治療までのCINV状況を加味して、 前投薬を工夫する。
内服方法が複雑であるため、 初回コースの内服期間は1週毎の診察にするなど患者ごとの理解力にあわせて検討する。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
特徴と注意点
胃癌治療ガイドライン医師用 2021年7月改訂 第6版では、 胃癌3次治療において 「推奨される化学療法レジメン」 である。
骨髄抑制による治療開始延期割合が高いため、 回復までの延期日数によっては2週休薬を3週休薬にするなどの工夫が必要である。
有害事象としてILDの報告が少ないため、 前治療によるILD発症症例には選択肢となる。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
関連する臨床試験
TAGS試験³⁾
Lancet Oncol. 2018;19(11):1437-48.
フッ化ピリミジン系抗悪性腫瘍剤、 白金系抗悪性腫瘍剤並びにタキサン系抗悪性腫瘍剤及び/又はイリノテカンを用いた化学療法並びにヒト上皮細胞増殖因子受容体2 (HER2) /neu陽性 (HER2+) が判明している場合は抗HER2療法を含む2レジメン以上が施行され不応又は不耐となった治癒切除不能な進行・再発の胃癌を対象に、 ロンサーフのプラセボ投与に対する優越性の検証を目的とした多施設国際共同無作為化二重盲検第Ⅲ相比較試験。 主要評価項目は全生存期間 (OS)、 副次評価項目は無増悪生存期間 (PFS)、 奏効率 (ORR)、 病勢コントロール率 (DCR)、 ECOG PSが2以上に悪化するまでの期間、 EORTC QLQ-C30、 EORTC QLQ-STO22とされた。
出典
- 大鵬薬品工業株式会社. ロンサーフ®電子添文 (2024年10月改訂 第4版) [最終閲覧 : 2024/11/29]
- 大鵬薬品工業株式会社. ロンサーフ®適正使用ガイド [最終閲覧 : 2024/11/29]
- Trifluridine/tipiracil versus placebo in patients with heavily pretreated metastatic gastric cancer (TAGS): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2018 Nov;19(11):1437-1448. PMID: 30355453
最終更新日:2024年11月29日
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。