本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
【催吐性】中等度催吐性
カンプト® (添付文書¹⁾)
用法用量
国内第Ⅱ相試験²⁾のプロトコル
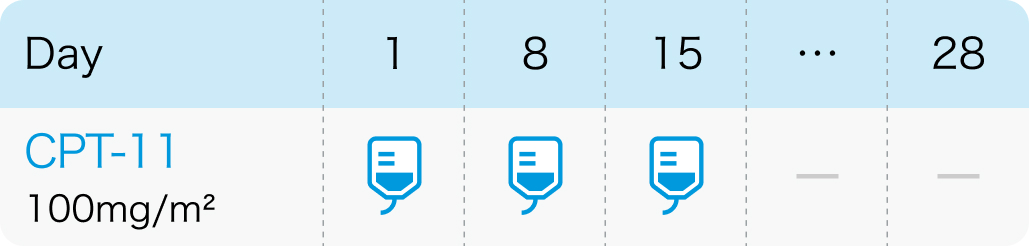
Gynecol Oncol. 2006 Feb;100(2):412-6²⁾より作図
電子添文¹⁾の用法および用量
A法 : 1日1回、 100mg/m²を1週間間隔で3~4回点滴静注し、 少なくとも2週間休薬
B法 : 1日1回、 150mg/m²を2週間間隔で2~3回点滴静注し、 少なくとも3週間休薬
カンプト®電子添文 (2022年12月改訂 第1版)¹⁾より引用
前投薬・投与スケジュール例
- DEX 6.6mg+5HT₃拮抗剤 + 生食 100ml (30分)
- CPT-11 100mg/m² + 5%ブ糖液 500mL (90分)
日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生提供
投与開始基準
国内第Ⅱ相試験²⁾のプロトコル
プラチナまたはタキサン難治性で、 治療中または治療終了後3ヵ月以内に腫瘍の進行が見られる患者 または
プラチナまたはタキサン抵抗性で、 直近の治療終了後3~6ヵ月の間に腫瘍進行が見られる患者
Gynecol Oncol. 2006 Feb;100(2):412-6²⁾より引用
休薬・中止基準
電子添文¹⁾の基準
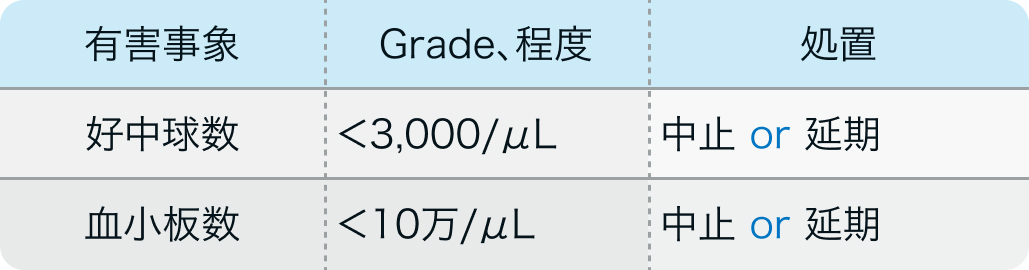
カンプト®電子添文 (2022年12月改訂 第1版)¹⁾より作図
投与可能な数値であっても、 白血球数又は血小板数が急激な減少傾向にあるなど、 骨髄機能抑制が疑われる場合には、 中止又は延期
白血球数が異常な高値を示す患者及びCRPが異常値を示すなど感染症が疑われる患者において、 投与後に白血球の急激な減少が起こった場合、 投与可能な数値であっても、 骨髄機能の回復を十分に確認してから投与を行うこと
カンプト®電子添文 (2022年12月改訂 第1版)¹⁾より引用
KeyData|臨床試験結果
国内第Ⅱ相試験²⁾
対象: プラチナ/タキサンに抵抗性または難治性の卵巣癌、 腹膜癌、 卵管癌の患者28例
方法: イリノテカン100mg/m²を週1回投与
【有効性】
- ORR 29%
- mPFS 17週
- mOS 8ヵ月
【安全性】主な有害事象 (カッコ内 Grade3~4)
- 白血球数数減少 75.0% (17.9%)
- 好中球数減少 71.4% (17.9%)
- 貧血 85.7% (3.6%)
- 悪心 92.9% (0%)
- 下痢 82.1% (10.7%)
- 嘔吐 64.3% (0%)
- 便秘 25.0% (0%)
- 脱毛症 50.0% (0%)
Gynecol Oncol. 2006 Feb;100(2):412-6²⁾より引用
エキスパートによるワンポイント
国内第Ⅱ相試験²⁾の結果
29% (8/28人) の奏効率を認めています。
重症下痢のマネジメント³⁾
CPT-11投与時の注意点としては、 下痢があります。 時に重症な下痢を引き起こすことがあります。
CPT-11の副作用を予測する検査として、 UGT1A1遺伝子多型検査があります。UGT1A1は肝臓のUDPグルクロン酸転移酵素 (UGT : Uridine diphosphate glucuronosyltransferase) の分子種の1つであり、 CPT-11の代謝酵素です。 UGT1A1検査で、 6か28のホモ接合が認められた場合には、 重症下痢の発現頻度が80%にもなるという報告がありますので、 ホモ接合を認めた際には、 あらかじめ、 減量してから投与することが勧められます。
また、 重症下痢を起こした際には、 大量ロペラミド療法 (1回2カプセル、 2時間ごと投与、 1日24カプセル投与) が有効であると、 ガイドライン³⁾にも示されていますので、 知っておくとよいと思います。
監修 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
出典
- ヤクルト本社. カンプト®電子添文 (2022年12月改訂 第1版) [最終閲覧 : 2024/03/21]
- The safety and efficacy of the weekly dosing of irinotecan for platinum- and taxanes-resistant epithelial ovarian cancer. Gynecol Oncol. 2006 Feb;100(2):412-6. PMID: 16298422
- Recommended guidelines for the treatment of cancer treatment-induced diarrhea. J Clin Oncol. 2004 Jul 15;22(14):2918-26. PMID: 15254061
最終更新日 : 2024年8月3日
監修医師 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
CPT-11
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
【催吐性】中等度催吐性
カンプト® (添付文書¹⁾)
用法用量
国内第Ⅱ相試験²⁾のプロトコル

Gynecol Oncol. 2006 Feb;100(2):412-6²⁾より作図
電子添文¹⁾の用法および用量
A法 : 1日1回、 100mg/m²を1週間間隔で3~4回点滴静注し、 少なくとも2週間休薬
B法 : 1日1回、 150mg/m²を2週間間隔で2~3回点滴静注し、 少なくとも3週間休薬
カンプト®電子添文 (2022年12月改訂 第1版)¹⁾より引用
前投薬・投与スケジュール例
- DEX 6.6mg+5HT₃拮抗剤 + 生食 100ml (30分)
- CPT-11 100mg/m² + 5%ブ糖液 500mL (90分)
日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生提供
投与開始基準
国内第Ⅱ相試験²⁾のプロトコル
プラチナまたはタキサン難治性で、 治療中または治療終了後3ヵ月以内に腫瘍の進行が見られる患者 または
プラチナまたはタキサン抵抗性で、 直近の治療終了後3~6ヵ月の間に腫瘍進行が見られる患者
Gynecol Oncol. 2006 Feb;100(2):412-6²⁾より引用
休薬・中止基準
電子添文¹⁾の基準

カンプト®電子添文 (2022年12月改訂 第1版)¹⁾より作図
投与可能な数値であっても、 白血球数又は血小板数が急激な減少傾向にあるなど、 骨髄機能抑制が疑われる場合には、 中止又は延期
白血球数が異常な高値を示す患者及びCRPが異常値を示すなど感染症が疑われる患者において、 投与後に白血球の急激な減少が起こった場合、 投与可能な数値であっても、 骨髄機能の回復を十分に確認してから投与を行うこと
カンプト®電子添文 (2022年12月改訂 第1版)¹⁾より引用
KeyData|臨床試験結果
国内第Ⅱ相試験²⁾
対象: プラチナ/タキサンに抵抗性または難治性の卵巣癌、 腹膜癌、 卵管癌の患者28例
方法: イリノテカン100mg/m²を週1回投与
【有効性】
- ORR 29%
- mPFS 17週
- mOS 8ヵ月
【安全性】主な有害事象 (カッコ内 Grade3~4)
- 白血球数数減少 75.0% (17.9%)
- 好中球数減少 71.4% (17.9%)
- 貧血 85.7% (3.6%)
- 悪心 92.9% (0%)
- 下痢 82.1% (10.7%)
- 嘔吐 64.3% (0%)
- 便秘 25.0% (0%)
- 脱毛症 50.0% (0%)
Gynecol Oncol. 2006 Feb;100(2):412-6²⁾より引用
エキスパートによるワンポイント
国内第Ⅱ相試験²⁾の結果
29% (8/28人) の奏効率を認めています。
重症下痢のマネジメント³⁾
CPT-11投与時の注意点としては、 下痢があります。 時に重症な下痢を引き起こすことがあります。
CPT-11の副作用を予測する検査として、 UGT1A1遺伝子多型検査があります。UGT1A1は肝臓のUDPグルクロン酸転移酵素 (UGT : Uridine diphosphate glucuronosyltransferase) の分子種の1つであり、 CPT-11の代謝酵素です。 UGT1A1検査で、 6か28のホモ接合が認められた場合には、 重症下痢の発現頻度が80%にもなるという報告がありますので、 ホモ接合を認めた際には、 あらかじめ、 減量してから投与することが勧められます。
また、 重症下痢を起こした際には、 大量ロペラミド療法 (1回2カプセル、 2時間ごと投与、 1日24カプセル投与) が有効であると、 ガイドライン³⁾にも示されていますので、 知っておくとよいと思います。
監修 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
出典
- ヤクルト本社. カンプト®電子添文 (2022年12月改訂 第1版) [最終閲覧 : 2024/03/21]
- The safety and efficacy of the weekly dosing of irinotecan for platinum- and taxanes-resistant epithelial ovarian cancer. Gynecol Oncol. 2006 Feb;100(2):412-6. PMID: 16298422
- Recommended guidelines for the treatment of cancer treatment-induced diarrhea. J Clin Oncol. 2004 Jul 15;22(14):2918-26. PMID: 15254061
最終更新日 : 2024年8月3日
監修医師 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。