Nivo:ニボルマブ(オプジーボ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 240mg/body 点滴 | 1~4 | Day1 |
| 480mg/body 点滴 | 5~ (4週ごとの場合) | Day1 |
| 240mg/body 点滴 | 5~ (2週ごとの場合) | Day1 |
Ipi:イピリムマブ(ヤーボイ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1mg/kg 点滴 | 1~4 | Day1 |
その他
| MSI-High結腸・直腸癌に対するニボルマブの適応を、 コンパニオン診断薬を用いて判定する。 |
従来は、 がん化学療法後に増悪した治癒切除不能な進行・再発のMSI-High結腸・直腸癌を対象としていたが、 2025年8月25日に 「治癒切除不能な進行・再発のMSI-High結腸・直腸癌」 に改められ、 既治療要件が緩和された。
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*小野薬品工業株式会社の外部サイトへ遷移します
**ブリストル・マイヤーズ スクイブ株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】併用期3週間、 単剤期4又は2週間
【催吐性】最小度
【FN発症】未報告*
*CheckMate 8HW試験³⁾ではFN発生率未報告
併用期 : ニボルマブ (Nivo) 240mg/bodyとイピリムマブ (Ipi) 1mg/kg を3週ごとに4回投与

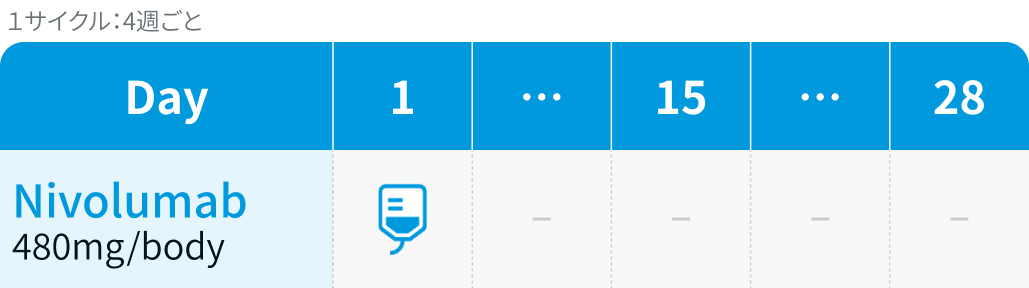
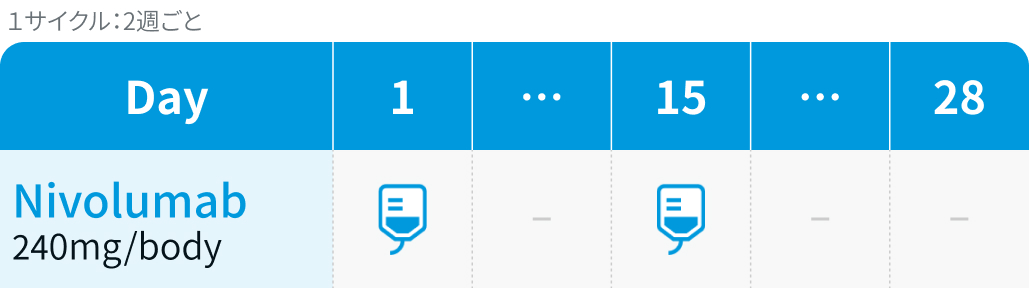
単剤期 : Nivo 480mg/bodyを4週ごと、 または240mg/bodyを2週ごとに投与。
Key Data|臨床試験結果
📊 CheckMate 8HW試験
N Engl J Med. 2024;391(21):2014-2026.
切除不能または転移性のMSI-H/dMMR結腸直腸癌を対象とした非盲検第III相無作為化比較試験。 Nivo+Ipi併用群、 Nivo単剤群、 化学療法群に2:2:1で無作為割付を行った。 主要評価項目は、 1次治療例におけるNivo+Ipi併用群と化学療法群のPFS、 ならびに既治療歴の有無を問わない患者におけるNivo+Ipi併用群とNivo単剤群のPFSであった。
【有効性】
Nivo+Ipi併用群 (vs 化学療法群) :
- PFS中央値 未到達 (vs 5.9ヵ月)
- 24ヵ月時点のPFS割合 72% (vs 14%)
- 24ヵ月時点のRMST* 19.2ヵ月 (vs 8.6ヵ月)、 差は10.6ヵ月 (95%CI 8.4–12.9ヵ月)
*RMST (制限付き平均生存時間) : 指定した時点までの生存期間の平均値を比較する指標。 比例ハザード性は前提とせず、 非比例ハザードが疑われる場合に特に有用。
【安全性】主な有害事象 : 全Grade (Grade≧3)
- 掻痒 22% (0%)
- 下痢 21% (1%)
- 甲状腺機能低下症 16% (1%)
- 無力症 14% (1%)
- 倦怠感 13% (<1%)
- 発疹 10% (1%)
- ALT上昇 10% (2%)
- 副腎不全 10% (3%)
- 悪心 5% (0%)
- 食欲減退 5% (<1%)
- 貧血 2% (0%)
- 嘔吐 2% (0%)
- 好中球減少症 2% (0%)
- 脱毛症 2% (0%)
- 口内炎 <1% (0%)
- 末梢神経障害 0% (0%)
各プロトコル
適格基準
CheckMate 8HW試験³⁾の主な適格基準 :
- 18歳以上
- ECOG PS 0-1
- 好中球数≧1,500/μL
- 血小板数≧10万/μL
- ヘモグロビン≧9.0g/dL
- 腎機能 : CrCl≧40mL/min
- 肝機能 : AST/ALT≦3.0xULN、 T-Bil≦1.5xULN
用量レベル
Nivo : 用量変更不可
Ipi : 施行当日の体重が用量算出時と10%以上乖離している場合は再計算を行う
CheckMate 8HW試験³⁾のプロトコルを基に記載
有害事象発現時の減量・休薬・中止基準
CheckMate 8HW試験³⁾では以下のとおり規定されていた。
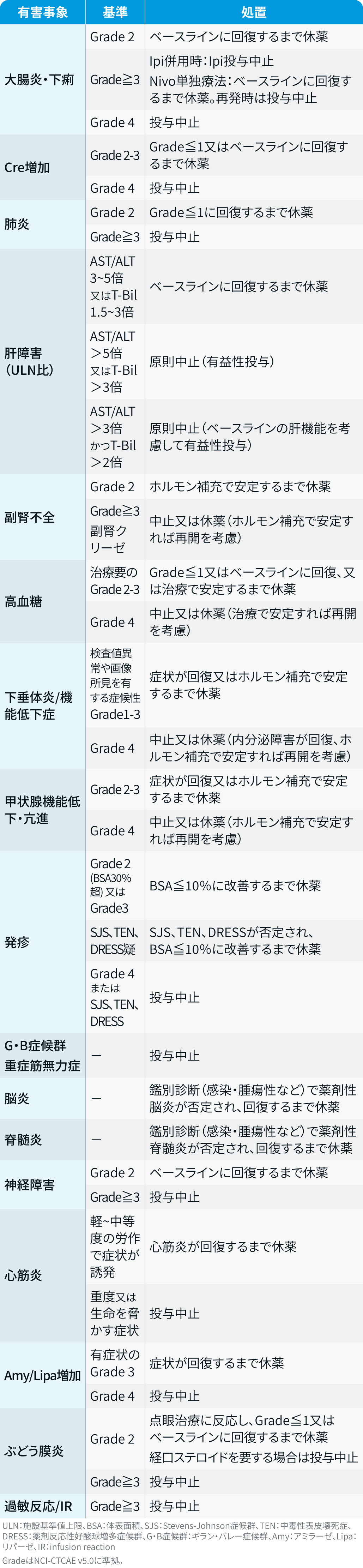
CheckMate 8HW試験³⁾のプロトコルを基に編集部作成
一方、 ヤーボイ®電子添文²⁾では、 有害事象発現時の休薬・中止基準が以下のとおり定められているため、 併せて確認すること。

ヤーボイ電子添文²⁾を基に編集部作成
レジメンの特徴と注意点
本レジメンは治癒切除不能な進行・再発MSI-High結腸・直腸癌の1次治療に適応される。
術後補助療法の有効性・安全性は確立していない¹⁾²⁾。
作用機序の特徴
Nivoは抗PD-1抗体であり、 PD-1とPD-L1/PD-L2の結合を阻害してT細胞を活性化し、 抗腫瘍免疫を高める。 一方、 Ipiは抗CTLA-4抗体であり、 CTLA-4とB7分子の結合を阻害してT細胞の抑制を解除し、 増殖と活性化を促進する。
レジメン適用時の注意事項
下痢・大腸炎・下垂体機能低下症など : Ipiで特に注意すべき免疫関連有害事象である。 投与終了後も観察を継続し、 異常時は適切に対応する。
肝障害・肝不全 : 定期的に肝機能検査を実施し、 状態を十分に観察する。
内分泌障害 : 投与前および投与中にTSH、 遊離T3、 遊離T4、 ACTH、 血中コルチゾール等を定期的に測定し、 必要に応じて画像検査も行う。
筋炎・横紋筋融解症・心筋炎 : 筋力低下、 筋肉痛、 眼瞼下垂、 呼吸困難、 嚥下障害、 CK上昇、 心電図異常、 ミオグロビン上昇等を十分に観察する。
糖尿病 (1型糖尿病を含む) : 口渇、 悪心、 嘔吐、 血糖値上昇等に注意し、 必要に応じて対応する。
間質性肺疾患 : 投与前および投与中は呼吸状態・咳・発熱等の症状を観察し、 SpO₂、 胸部X線、 CTを定期的に実施。 必要に応じてKL-6、 PaO₂、 A-aDO₂、 DLco等を評価。 CT読影は呼吸器専門医の助言を得る。 患者には初期症状出現時の速やかな受診を指導する。
輸注反応/過敏反応 : 重度輸注反応に備えて緊急対応体制を整えた上で投与を開始する。 2回目以降や投与終了後にも反応が出る可能性があるため、 バイタルサイン等を測定し十分に観察する。
RMP【重要な特定されたリスク】
オプジーボ® RMP : 医薬品リスク管理計画書
- 間質性肺疾患
- 重症筋無力症・心筋炎・筋炎・横紋筋融解症
- 大腸炎・小腸炎・重度の下痢
- 1型糖尿病
- 劇症肝炎・肝不全・肝機能障害・肝炎・硬化性胆管炎
- 内分泌障害 (甲状腺機能障害・下垂体機能障害・副腎障害)
- 神経障害
- 腎障害
- 脳炎・髄膜炎・脊髄炎
- 重度の皮膚障害
- 静脈血栓塞栓症
- Infusion reaction
- 重篤な血液障害
- 血球貪食症候群
- 結核
- 膵炎
- 重度の胃炎
- ぶどう膜炎
- 臓器移植歴 (造血幹細胞移植歴を含む) のある患者への使用
ヤーボイ® RMP
- 下痢・大腸炎・消化管穿孔
- 肝障害
- 皮膚障害
- 下垂体炎・下垂体機能低下症・甲状腺機能低下症・副腎機能不全
- 末梢性ニューロパチー
- 腎障害
- 間質性肺疾患
- Infusion reaction
- 筋炎
- 心筋炎
- ぶどう膜炎
- 脳炎・髄膜炎・脊髄炎
- 臓器移植歴 (造血幹細胞移植歴を含む) のある患者における拒絶反応
コンパニオン診断薬の情報
治癒切除不能な進行・再発のMSI-Highを有する結腸・直腸癌に対するニボルマブのコンパニオン診断薬として、 以下の検査法が承認されている。
マイクロサテライト不安定性 :
- MSI検査キット (FALCO)
- FoundationOne CDx がんゲノムプロファイル
- Guardant360 CDxがん遺伝子バネル
- Idyla MSI Test 「ニチレイバイオ」
ミスマッチ修復機能欠損 :
- PMS2 IHC pharmDx 「ダコ Omnis」
- MSH2 IHC pharmDx 「ダコ Omnis」
- MSH6 IHC pharmDx 「ダコ Omnis」
- MLH1 IHC pharmDx 「ダコ Omnis」
出典
- 小野薬品工業株式会社. オプジーボ®点滴静注 電子添文 2025年8月改訂(第25版)
- ブリストル・マイヤーズ スクイブ株式会社. ヤーボイ®点滴静注液 電子添文 2025年8月改訂(第16版)
- N Engl J Med. 2024;391(21):2014-2026.
最終更新日 : 2025年9月2日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : HOKUTO編集部 医師
Nivo + Ipi
Nivo:ニボルマブ(オプジーボ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 240mg/body 点滴 | 1~4 | Day1 |
| 480mg/body 点滴 | 5~ (4週ごとの場合) | Day1 |
| 240mg/body 点滴 | 5~ (2週ごとの場合) | Day1 |
Ipi:イピリムマブ(ヤーボイ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1mg/kg 点滴 | 1~4 | Day1 |
その他
| MSI-High結腸・直腸癌に対するニボルマブの適応を、 コンパニオン診断薬を用いて判定する。 |
概要
従来は、 がん化学療法後に増悪した治癒切除不能な進行・再発のMSI-High結腸・直腸癌を対象としていたが、 2025年8月25日に 「治癒切除不能な進行・再発のMSI-High結腸・直腸癌」 に改められ、 既治療要件が緩和された。
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*小野薬品工業株式会社の外部サイトへ遷移します
**ブリストル・マイヤーズ スクイブ株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】併用期3週間、 単剤期4又は2週間
【催吐性】最小度
【FN発症】未報告*
*CheckMate 8HW試験³⁾ではFN発生率未報告
併用期 : ニボルマブ (Nivo) 240mg/bodyとイピリムマブ (Ipi) 1mg/kg を3週ごとに4回投与

単剤期 : Nivo 480mg/bodyを4週ごと、 または240mg/bodyを2週ごとに投与。


Key Data|臨床試験結果
📊 CheckMate 8HW試験
N Engl J Med. 2024;391(21):2014-2026.
切除不能または転移性のMSI-H/dMMR結腸直腸癌を対象とした非盲検第III相無作為化比較試験。 Nivo+Ipi併用群、 Nivo単剤群、 化学療法群に2:2:1で無作為割付を行った。 主要評価項目は、 1次治療例におけるNivo+Ipi併用群と化学療法群のPFS、 ならびに既治療歴の有無を問わない患者におけるNivo+Ipi併用群とNivo単剤群のPFSであった。
【有効性】
Nivo+Ipi併用群 (vs 化学療法群) :
- PFS中央値 未到達 (vs 5.9ヵ月)
- 24ヵ月時点のPFS割合 72% (vs 14%)
- 24ヵ月時点のRMST* 19.2ヵ月 (vs 8.6ヵ月)、 差は10.6ヵ月 (95%CI 8.4–12.9ヵ月)
*RMST (制限付き平均生存時間) : 指定した時点までの生存期間の平均値を比較する指標。 比例ハザード性は前提とせず、 非比例ハザードが疑われる場合に特に有用。
【安全性】主な有害事象 : 全Grade (Grade≧3)
- 掻痒 22% (0%)
- 下痢 21% (1%)
- 甲状腺機能低下症 16% (1%)
- 無力症 14% (1%)
- 倦怠感 13% (<1%)
- 発疹 10% (1%)
- ALT上昇 10% (2%)
- 副腎不全 10% (3%)
- 悪心 5% (0%)
- 食欲減退 5% (<1%)
- 貧血 2% (0%)
- 嘔吐 2% (0%)
- 好中球減少症 2% (0%)
- 脱毛症 2% (0%)
- 口内炎 <1% (0%)
- 末梢神経障害 0% (0%)
各プロトコル
適格基準
CheckMate 8HW試験³⁾の主な適格基準 :
- 18歳以上
- ECOG PS 0-1
- 好中球数≧1,500/μL
- 血小板数≧10万/μL
- ヘモグロビン≧9.0g/dL
- 腎機能 : CrCl≧40mL/min
- 肝機能 : AST/ALT≦3.0xULN、 T-Bil≦1.5xULN
用量レベル
Nivo : 用量変更不可
Ipi : 施行当日の体重が用量算出時と10%以上乖離している場合は再計算を行う
CheckMate 8HW試験³⁾のプロトコルを基に記載
有害事象発現時の減量・休薬・中止基準
CheckMate 8HW試験³⁾では以下のとおり規定されていた。

CheckMate 8HW試験³⁾のプロトコルを基に編集部作成
一方、 ヤーボイ®電子添文²⁾では、 有害事象発現時の休薬・中止基準が以下のとおり定められているため、 併せて確認すること。

ヤーボイ電子添文²⁾を基に編集部作成
レジメンの特徴と注意点
本レジメンは治癒切除不能な進行・再発MSI-High結腸・直腸癌の1次治療に適応される。
術後補助療法の有効性・安全性は確立していない¹⁾²⁾。
作用機序の特徴
Nivoは抗PD-1抗体であり、 PD-1とPD-L1/PD-L2の結合を阻害してT細胞を活性化し、 抗腫瘍免疫を高める。 一方、 Ipiは抗CTLA-4抗体であり、 CTLA-4とB7分子の結合を阻害してT細胞の抑制を解除し、 増殖と活性化を促進する。
レジメン適用時の注意事項
下痢・大腸炎・下垂体機能低下症など : Ipiで特に注意すべき免疫関連有害事象である。 投与終了後も観察を継続し、 異常時は適切に対応する。
肝障害・肝不全 : 定期的に肝機能検査を実施し、 状態を十分に観察する。
内分泌障害 : 投与前および投与中にTSH、 遊離T3、 遊離T4、 ACTH、 血中コルチゾール等を定期的に測定し、 必要に応じて画像検査も行う。
筋炎・横紋筋融解症・心筋炎 : 筋力低下、 筋肉痛、 眼瞼下垂、 呼吸困難、 嚥下障害、 CK上昇、 心電図異常、 ミオグロビン上昇等を十分に観察する。
糖尿病 (1型糖尿病を含む) : 口渇、 悪心、 嘔吐、 血糖値上昇等に注意し、 必要に応じて対応する。
間質性肺疾患 : 投与前および投与中は呼吸状態・咳・発熱等の症状を観察し、 SpO₂、 胸部X線、 CTを定期的に実施。 必要に応じてKL-6、 PaO₂、 A-aDO₂、 DLco等を評価。 CT読影は呼吸器専門医の助言を得る。 患者には初期症状出現時の速やかな受診を指導する。
輸注反応/過敏反応 : 重度輸注反応に備えて緊急対応体制を整えた上で投与を開始する。 2回目以降や投与終了後にも反応が出る可能性があるため、 バイタルサイン等を測定し十分に観察する。
RMP【重要な特定されたリスク】
オプジーボ® RMP : 医薬品リスク管理計画書
- 間質性肺疾患
- 重症筋無力症・心筋炎・筋炎・横紋筋融解症
- 大腸炎・小腸炎・重度の下痢
- 1型糖尿病
- 劇症肝炎・肝不全・肝機能障害・肝炎・硬化性胆管炎
- 内分泌障害 (甲状腺機能障害・下垂体機能障害・副腎障害)
- 神経障害
- 腎障害
- 脳炎・髄膜炎・脊髄炎
- 重度の皮膚障害
- 静脈血栓塞栓症
- Infusion reaction
- 重篤な血液障害
- 血球貪食症候群
- 結核
- 膵炎
- 重度の胃炎
- ぶどう膜炎
- 臓器移植歴 (造血幹細胞移植歴を含む) のある患者への使用
ヤーボイ® RMP
- 下痢・大腸炎・消化管穿孔
- 肝障害
- 皮膚障害
- 下垂体炎・下垂体機能低下症・甲状腺機能低下症・副腎機能不全
- 末梢性ニューロパチー
- 腎障害
- 間質性肺疾患
- Infusion reaction
- 筋炎
- 心筋炎
- ぶどう膜炎
- 脳炎・髄膜炎・脊髄炎
- 臓器移植歴 (造血幹細胞移植歴を含む) のある患者における拒絶反応
コンパニオン診断薬の情報
治癒切除不能な進行・再発のMSI-Highを有する結腸・直腸癌に対するニボルマブのコンパニオン診断薬として、 以下の検査法が承認されている。
マイクロサテライト不安定性 :
- MSI検査キット (FALCO)
- FoundationOne CDx がんゲノムプロファイル
- Guardant360 CDxがん遺伝子バネル
- Idyla MSI Test 「ニチレイバイオ」
ミスマッチ修復機能欠損 :
- PMS2 IHC pharmDx 「ダコ Omnis」
- MSH2 IHC pharmDx 「ダコ Omnis」
- MSH6 IHC pharmDx 「ダコ Omnis」
- MLH1 IHC pharmDx 「ダコ Omnis」
出典
- 小野薬品工業株式会社. オプジーボ®点滴静注 電子添文 2025年8月改訂(第25版)
- ブリストル・マイヤーズ スクイブ株式会社. ヤーボイ®点滴静注液 電子添文 2025年8月改訂(第16版)
- N Engl J Med. 2024;391(21):2014-2026.
最終更新日 : 2025年9月2日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : HOKUTO編集部 医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。


