治療スケジュール
概要
監修医師
Ponatinib:ポナチ二ブ(アイクルシグ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 30mg 1日1回 経口 | 1~ | Day 1~ |
BLINA:ブリナツモマブ(ビーリンサイト®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 28μg/日 <持続点滴> | 最大5まで | Day 1~28 |
DEX:デキサメタゾン(デカドロン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 20mg/日 | 最大5まで | Day1 (BLINA投与1hr前に投与) |
前投薬
| BLINA各コース投与前にDEX20mgを投与. |
その他
| BLINAは1コース42日間. |
| BLINAは最大5コースまで併用し、 その後はPonatinib単剤療法. |
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*適正使用ガイドは「大塚製薬株式会社」 の外部サイトへ遷移します.
*適正使用ガイドは「アステラス製薬株式会社」 の外部サイトへ遷移します.
主な有害事象
- 詳細な有害事象の頻度については記載なし.
- Grade3以上の有害事象 (臨床試験¹⁾から引用)
- 感染症 37%
- アミラーゼ又はリパーゼの上昇 8%
- ALT又はAST増加 7%
- 疼痛 7%
- 高血圧 7%
特徴と注意点
- ポナチニブ+ブリナツモマブ療法は、 未治療または再燃/難治性Ph陽性ALLに対し、 高率に分子学的完全寛解を得られたとの報告¹⁾がある.
- 但し、 本邦における両剤の適応は 再発/難治性のみとなっている (2023.5時点).
- また、 本邦における両者の併用の有効性と安全性は確立されていないことに注意 (2023.8時点).
- スケジュール画像は、 下記の臨床試験の用法・用量となっているため注意.¹⁾
- 本邦においてブリナツモマブ初回使用時には、 はじめの7日間は低用量 (体重45kg以上は9µg/日、 体重45kg未満は5µg/m²/日)で投与する.
※ブリナツモマブの本邦における使用方法の詳細はBlinatumomab単剤療法を参照.
ポナチニブ (Ponatinib)
- 第3世代TKI (tyrosine kinase inhibitor) .
- イマチニブ抵抗性の原因となるBCR-ABL1融合遺伝子の点突然変異の1つであるT315I変異に有効.
- 血管閉塞性事象 (心筋梗塞、 脳梗塞、 網膜動脈閉塞症、 末梢動脈閉塞性疾患、 静脈血栓塞栓症) の死亡報告あり.
- 動脈の血管閉塞性事象は高齢および虚血性疾患の既往歴を有する患者に発現頻度が高い.
- 本療法¹⁾におけるポナチニブ用量は30mgを1日1回経口.
※慢性骨髄性白血病の場合は、 45mgを1日1回経口.
ブリナツモマブ (BLINA)
- CD3とCD19の両者に特異的に結合するT細胞誘導 (BiTE®) 抗体.
- T細胞とB細胞性白血病細胞を架橋しT細胞を活性化.
- 注意すべき副作用としてサイトカイン症候群 (CRS)があり、 特に初回投与で多い.
副作用と対策
ポナチニブ
- 投与前に必ず血圧、 心電図、 頸動脈エコー、 心エコー、 ABI検査、 血液検査等により心血管系疾患の危険因子を評価.
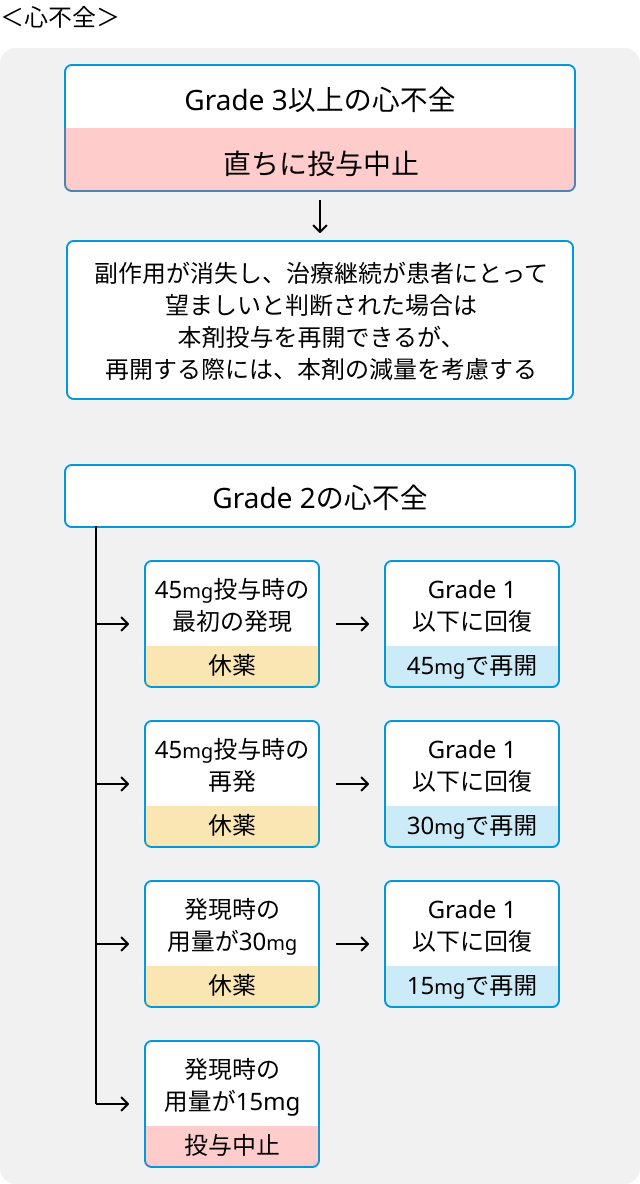
- 血管閉塞性事象又はGrade 3以上の心不全が発現した場合は直ちに中止.
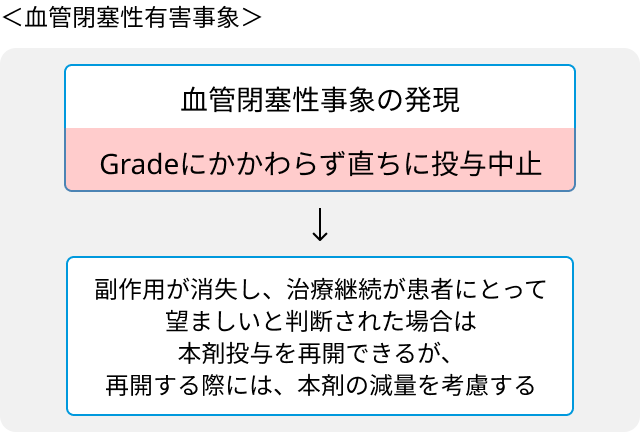
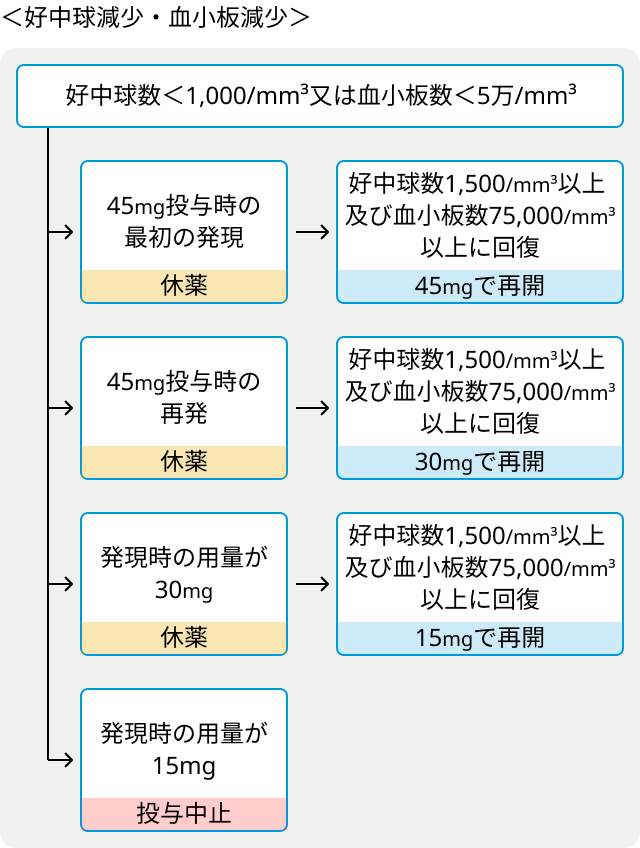
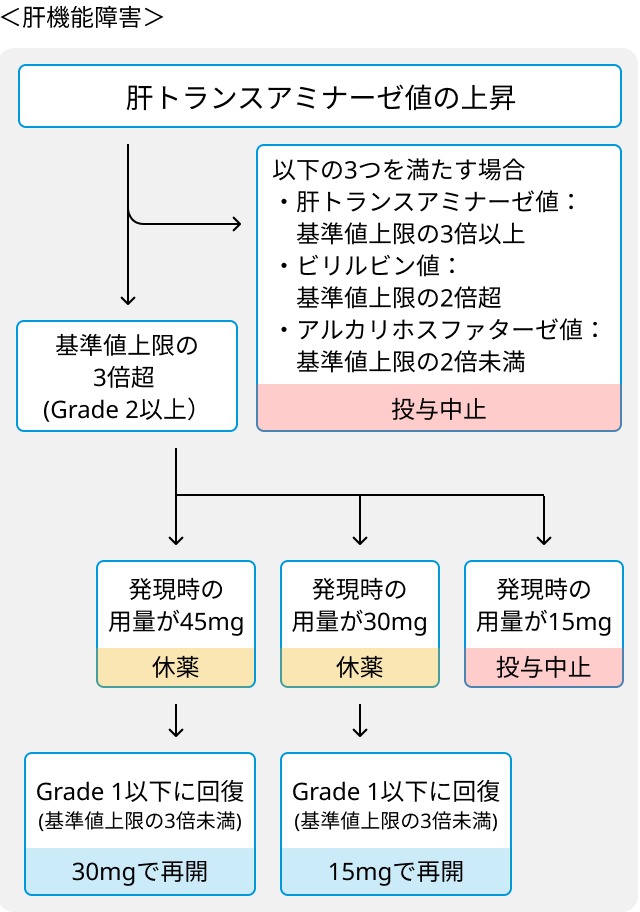
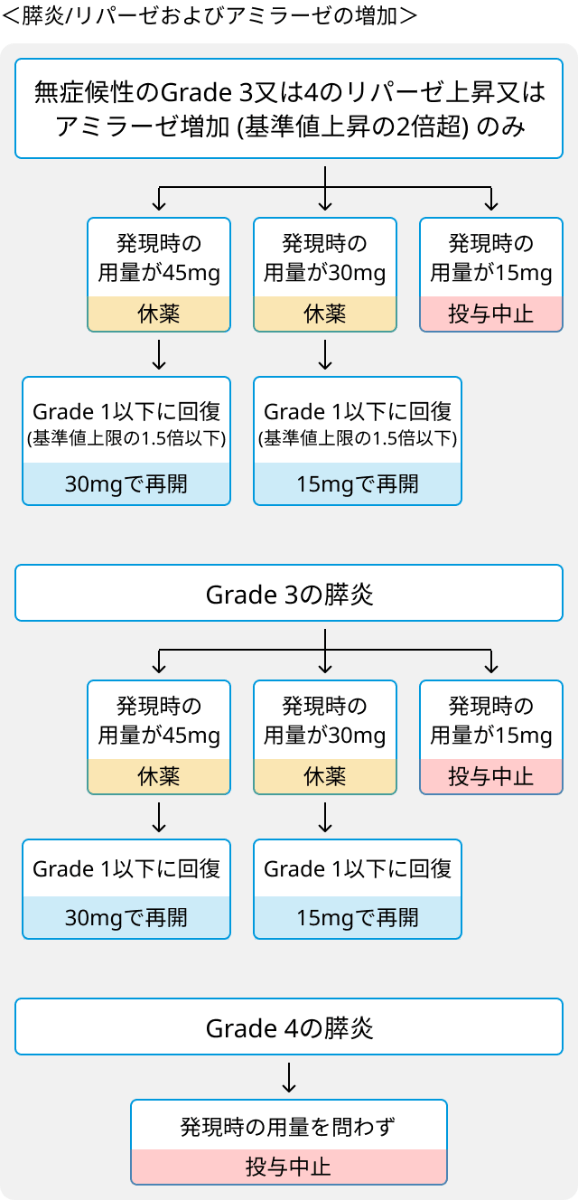
ブリナツモマブ
- サイトカイン放出症候群 (CRS)
- 発熱、 頭痛、 低血圧、 悪心などが出現.
- デキサメタゾンの前治療、 前投与で可能な限り予防.
- 発現時にはNSAIDsを避け、 アセトアミノフェンあるいはデキサメタゾンを推奨.
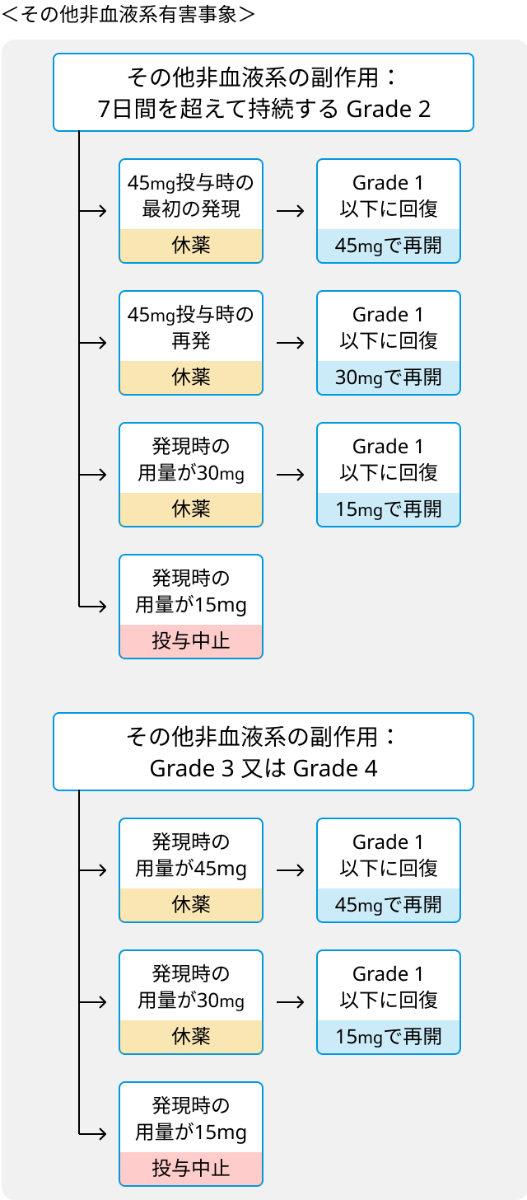
- 神経学的事象 (脳血管障害, 脳症, 痙攣発作, 錯乱, 失語症など)
- リスク因子:ALLの活動性中枢神経系病変やてんかんの既往.
- 神経学的事象発現時は投与を中止、 中断又は減量.
- 2回以上の痙攣発作には再投与は避ける.
関連する臨床試験
Lancet Haematol. 2023 Jan;10(1):e24-e34. ¹⁾
概要
- 単施設単群第2相試験
- 対象:新規又は再発/難治性Ph陽性ALL又はリンパ芽球期CML患者 (18歳以上)
- 介入:ポナチニブ+ブリナツモマブ*を施行
*ポナチニブ30mg 経口+ブリナツモマブ28μg 24時間持続静注 (各コース28日間)を最大5コース42日間併用投与し、 その後はポナチニブ単剤療法. CNS予防として12回の髄腔内化学療法を併用.
- 主要評価項目:新規診断ALL患者における分子的完全寛解、 及び再発/難治性ALL又はリンパ芽球期のCML患者における全奏効
結果
- 評価対象72名のうち60名*が本療法を施行.
*新規Ph陽性ALL 40名、 再発/難治性Ph陽性ALL 14名、 リンパ芽球期CML 6名
- 追跡期間中央値:16ヵ月
- 新規診断Ph陽性ALL:分子的完全寛解 87% (38名中33名).
- 再発/難治性Ph陽性ALL:全奏効 92% (12名) 、 分子的完全寛解 79% (11名) .
- リンパ芽球期CML:全奏効 83% (5名)、 分子的完全寛解 33% (2名).
- 5%以上の患者に発生した最も一般的なGrade3/4の有害事象は、 感染症 37% (22名)、 アミラーゼまたはリパーゼ濃度の上昇 8% (5名)、 ALTまたはAST濃度の増加 7% (4名)、 疼痛 7% (4名)、 高血圧:7% (4名)であった.
- 振戦のため 2% (1名) の患者がブリナツモマブを中止した.
- 脳血管虚血、 門脈血栓症、 冠動脈狭窄のため 5% (各1名ずつ計3名) の患者がポナチニブを中止した.
- 治療関連死は認められなかった.
- 本療法は新規診断及び再発/難治性のPh陽性ALL患者において、 高率に分子学的完全寛解が得られた.
- 新規診断のPh陽性ALL患者は、 化学療法に伴う毒性及び初回反応時の同種造血幹細胞移植の必要性を免れる可能性がある.
参考文献
最終更新:2023年8月27日
執筆担当:HOKUTO編集部薬剤師
監修医師:HOKUTO編集部医師
Ponatinib+Blinatumomab
ポナチニブ、 ブリナツモマブ
2023年09月02日更新
Ponatinib:ポナチ二ブ(アイクルシグ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 30mg 1日1回 経口 | 1~ | Day 1~ |
BLINA:ブリナツモマブ(ビーリンサイト®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 28μg/日 <持続点滴> | 最大5まで | Day 1~28 |
DEX:デキサメタゾン(デカドロン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 20mg/日 | 最大5まで | Day1 (BLINA投与1hr前に投与) |
前投薬
| BLINA各コース投与前にDEX20mgを投与. |
その他
| BLINAは1コース42日間. |
| BLINAは最大5コースまで併用し、 その後はPonatinib単剤療法. |
概要
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*適正使用ガイドは「大塚製薬株式会社」 の外部サイトへ遷移します.
*適正使用ガイドは「アステラス製薬株式会社」 の外部サイトへ遷移します.
主な有害事象
- 詳細な有害事象の頻度については記載なし.
- Grade3以上の有害事象 (臨床試験¹⁾から引用)
- 感染症 37%
- アミラーゼ又はリパーゼの上昇 8%
- ALT又はAST増加 7%
- 疼痛 7%
- 高血圧 7%
特徴と注意点
- ポナチニブ+ブリナツモマブ療法は、 未治療または再燃/難治性Ph陽性ALLに対し、 高率に分子学的完全寛解を得られたとの報告¹⁾がある.
- 但し、 本邦における両剤の適応は 再発/難治性のみとなっている (2023.5時点).
- また、 本邦における両者の併用の有効性と安全性は確立されていないことに注意 (2023.8時点).
- スケジュール画像は、 下記の臨床試験の用法・用量となっているため注意.¹⁾
- 本邦においてブリナツモマブ初回使用時には、 はじめの7日間は低用量 (体重45kg以上は9µg/日、 体重45kg未満は5µg/m²/日)で投与する.
※ブリナツモマブの本邦における使用方法の詳細はBlinatumomab単剤療法を参照.
ポナチニブ (Ponatinib)
- 第3世代TKI (tyrosine kinase inhibitor) .
- イマチニブ抵抗性の原因となるBCR-ABL1融合遺伝子の点突然変異の1つであるT315I変異に有効.
- 血管閉塞性事象 (心筋梗塞、 脳梗塞、 網膜動脈閉塞症、 末梢動脈閉塞性疾患、 静脈血栓塞栓症) の死亡報告あり.
- 動脈の血管閉塞性事象は高齢および虚血性疾患の既往歴を有する患者に発現頻度が高い.
- 本療法¹⁾におけるポナチニブ用量は30mgを1日1回経口.
※慢性骨髄性白血病の場合は、 45mgを1日1回経口.
ブリナツモマブ (BLINA)
- CD3とCD19の両者に特異的に結合するT細胞誘導 (BiTE®) 抗体.
- T細胞とB細胞性白血病細胞を架橋しT細胞を活性化.
- 注意すべき副作用としてサイトカイン症候群 (CRS)があり、 特に初回投与で多い.
副作用と対策
ポナチニブ
- 投与前に必ず血圧、 心電図、 頸動脈エコー、 心エコー、 ABI検査、 血液検査等により心血管系疾患の危険因子を評価.
- 血管閉塞性事象又はGrade 3以上の心不全が発現した場合は直ちに中止.






ブリナツモマブ
- サイトカイン放出症候群 (CRS)
- 発熱、 頭痛、 低血圧、 悪心などが出現.
- デキサメタゾンの前治療、 前投与で可能な限り予防.
- 発現時にはNSAIDsを避け、 アセトアミノフェンあるいはデキサメタゾンを推奨.
- 神経学的事象 (脳血管障害, 脳症, 痙攣発作, 錯乱, 失語症など)
- リスク因子:ALLの活動性中枢神経系病変やてんかんの既往.
- 神経学的事象発現時は投与を中止、 中断又は減量.
- 2回以上の痙攣発作には再投与は避ける.
関連する臨床試験
Lancet Haematol. 2023 Jan;10(1):e24-e34. ¹⁾
概要
- 単施設単群第2相試験
- 対象:新規又は再発/難治性Ph陽性ALL又はリンパ芽球期CML患者 (18歳以上)
- 介入:ポナチニブ+ブリナツモマブ*を施行
*ポナチニブ30mg 経口+ブリナツモマブ28μg 24時間持続静注 (各コース28日間)を最大5コース42日間併用投与し、 その後はポナチニブ単剤療法. CNS予防として12回の髄腔内化学療法を併用.
- 主要評価項目:新規診断ALL患者における分子的完全寛解、 及び再発/難治性ALL又はリンパ芽球期のCML患者における全奏効
結果
- 評価対象72名のうち60名*が本療法を施行.
*新規Ph陽性ALL 40名、 再発/難治性Ph陽性ALL 14名、 リンパ芽球期CML 6名
- 追跡期間中央値:16ヵ月
- 新規診断Ph陽性ALL:分子的完全寛解 87% (38名中33名).
- 再発/難治性Ph陽性ALL:全奏効 92% (12名) 、 分子的完全寛解 79% (11名) .
- リンパ芽球期CML:全奏効 83% (5名)、 分子的完全寛解 33% (2名).
- 5%以上の患者に発生した最も一般的なGrade3/4の有害事象は、 感染症 37% (22名)、 アミラーゼまたはリパーゼ濃度の上昇 8% (5名)、 ALTまたはAST濃度の増加 7% (4名)、 疼痛 7% (4名)、 高血圧:7% (4名)であった.
- 振戦のため 2% (1名) の患者がブリナツモマブを中止した.
- 脳血管虚血、 門脈血栓症、 冠動脈狭窄のため 5% (各1名ずつ計3名) の患者がポナチニブを中止した.
- 治療関連死は認められなかった.
- 本療法は新規診断及び再発/難治性のPh陽性ALL患者において、 高率に分子学的完全寛解が得られた.
- 新規診断のPh陽性ALL患者は、 化学療法に伴う毒性及び初回反応時の同種造血幹細胞移植の必要性を免れる可能性がある.
参考文献
最終更新:2023年8月27日
執筆担当:HOKUTO編集部薬剤師
監修医師:HOKUTO編集部医師
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(血液)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
