本コンテンツは特定の治療法を推奨するものではございません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
2024年5月31日、 「EGFR遺伝子変異陽性の切除不能な進行・再発の非小細胞肺癌」 を対象として製造販売承認を申請し、 2025年5月19日に正式に承認された。
薬剤情報
EGFR/MET二重特異性抗体 アミバンタマブ
*ヤンセンファーマ株式会社の外部サイトへ遷移します
-カルボプラチン® (添付文書)
-ペメトレキセド® (添付文書)
投与スケジュール
EGFR遺伝子変異陽性の切除不能な進行・再発の非小細胞肺癌
【1コース】21日間
【催吐性】中等度
【FN発症】低リスク*
*MARIPOSA-2試験³⁾のFN発症率2%に基づき編集部が分類。
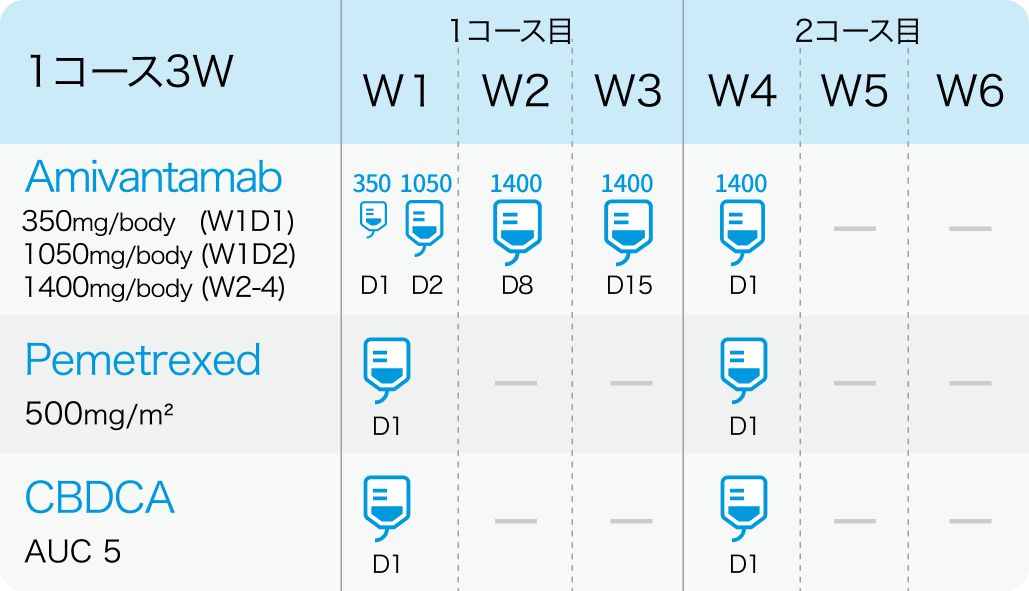
1、 2コース目 (W1は1週目、 D1は1日目を指す)
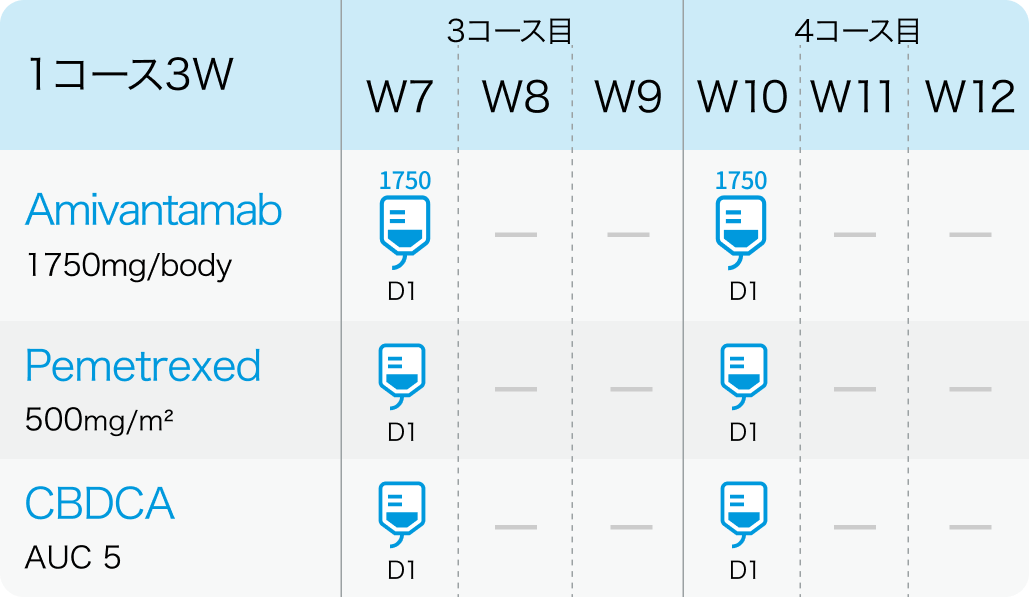
3、 4コース目
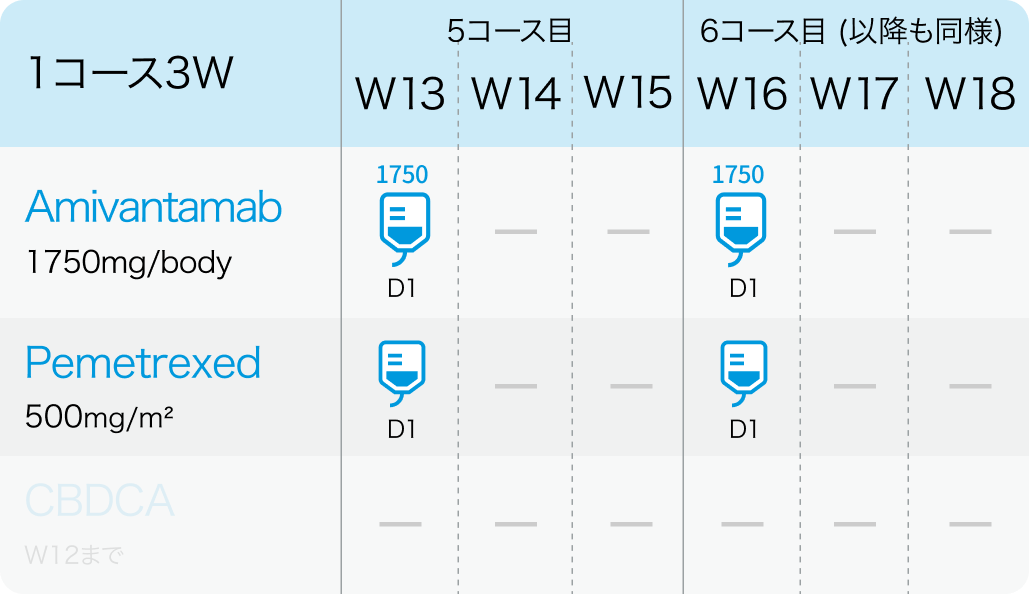
5コース目以降
ライブリバント®電子添文を基に編集部作成
アミバンタマブは、 体重<80kgでは1,400mg (≧80kgでは1,750mg) を週1回で4週間投与し、 3サイクル目 (7週目) 以降は1,750mg (同2,100mg) を3週ごとに投与。 初回投与は2日間に分割し、 サイクル1 Day1に350mg、 Day2に残量を投与。
Key Data|臨床試験結果
📊 MARIPOSA-2試験³⁾
オシメルチニブによる治療中または治療後に病勢進行したEGFR遺伝子変異 (Ex19delまたはL858R) 陽性の局所進行または転移性NSCLC患者657例を対象とした国際共同第III相非盲検ランダム化比較試験。 Amivantamab+化学療法 (カルボプラチン+ペメトレキセド) 群と化学療法単独群、 およびAmivantamab+Lazertinib+化学療法群に2:1:2の比率で無作為に割り付け、 主要評価項目としてPFSがAmivantamab+化学療法群 vs 化学療法群、 およびAmivantamab+Lazertinib+化学療法群 vs 化学療法群で評価された。
【有効性】Amivantamab+化学療法群
- PFS中央値: 6.3ヵ月、 HR 0.48 (vs 化学療法、 p<0.001)
- 6ヵ月PFS率: 51%、 12ヵ月PFS率: 22%
- 頭蓋内PFS中央値: 12.5ヵ月、 HR 0.55 (vs 化学療法)
- 客観的奏効率: 64%
- 奏効期間中央値: 6.9ヵ月
- OS (中間解析): HR 0.77 (vs 化学療法)
【安全性】主な有害事象: 全Grade% (Grade≧3)
- 好中球減少: 57% (45%)
- 血小板減少: 44% (19%)
- Infusion-related reaction: 58% (5%)
- 貧血: 39% (12%)
- 爪囲炎: 37% (2%)
- 悪心: 45% (1%)
- 発疹: 43% (6%)
- 口内炎: 32% (1%)
- 白血球減少: 28% (20%)
- 低アルブミン血症: 22% (2%)
- 便秘: 38% (1%)
- 食欲減退: 31% (0%)
- 末梢性浮腫: 32% (2%)
- 嘔吐: 25% (1%)
- 疲労: 28% (3%)
- 下痢: 14% (1%)
- 無力症: 26% (1%)
- ざ瘡様皮膚炎: 20% (4%)
- ALT上昇: 20% (5%)
- 低カリウム血症: 18% (5%)
- COVID-19: 21% (2%)
- 低カルシウム血症: 12% (1%)
- AST上昇: 15% (1%)
- 低ナトリウム血症: 10% (4%)
- 掻痒症: 15% (0%)
各プロトコル
適格基準
MARIPOSA-2試験の主な適格基準
- 年齢: 18歳以上
- PS: ECOG PS 0または1
- 好中球数: ≧1,500/μL
- 血小板数: ≧10万/μL
- ヘモグロビン値: ≧10 g/dL
- 腎機能: CrCl >50 mL/min
- 肝機能: 総ビリルビン ≤1.5x ULN (肝転移例では≤3x ULN)、 ALT/AST ≤3x ULN
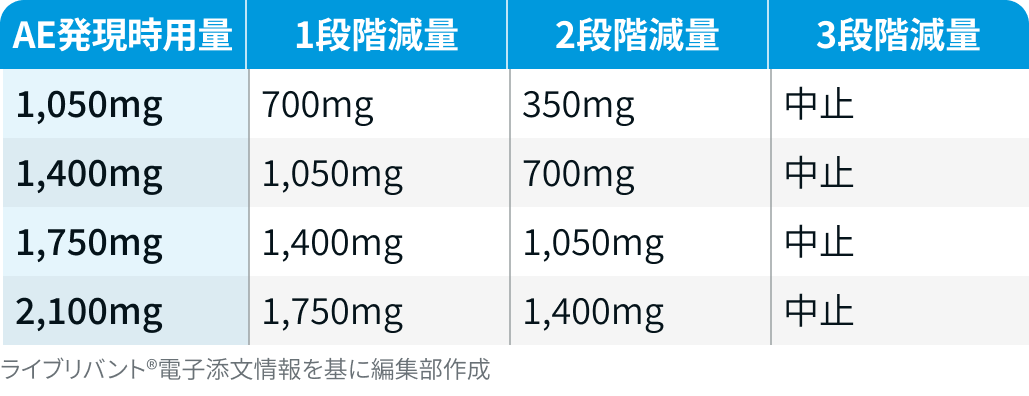
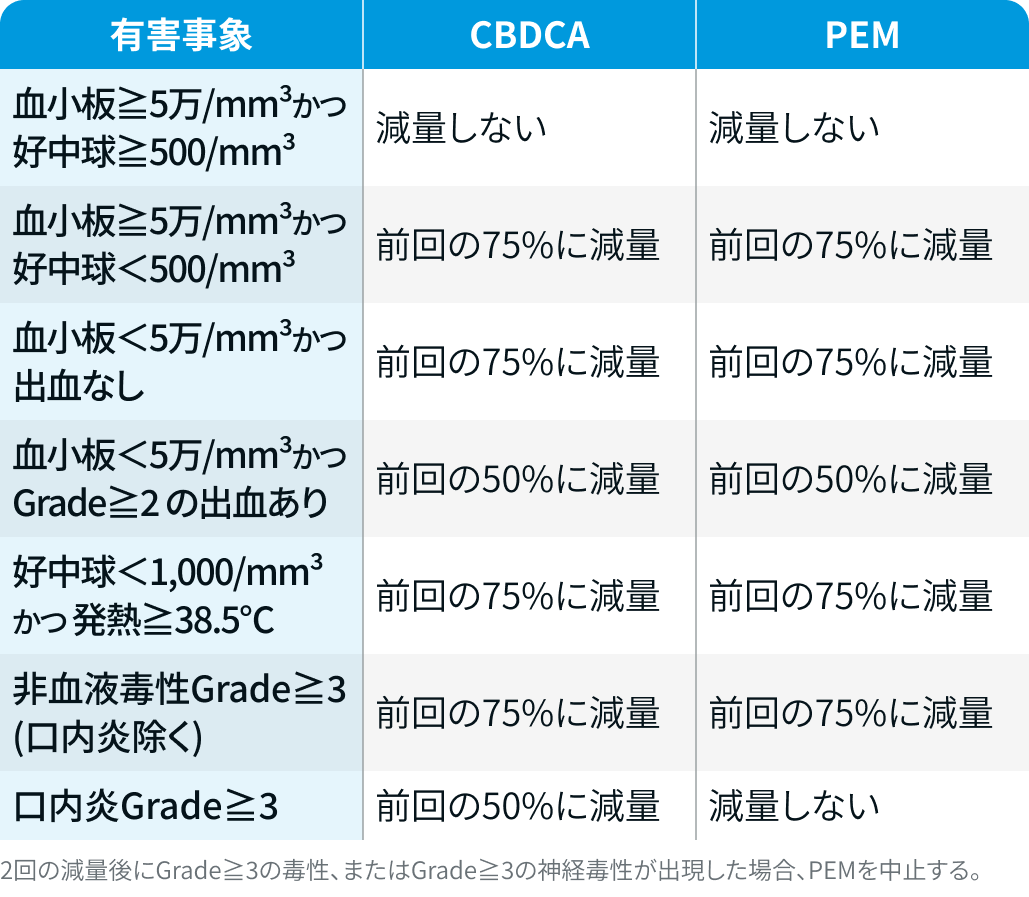
有害事象発現時の用量レベル
▼アミバンタマブ
▼CBDCA/PEM
腎障害患者に対する用量調整
▼CBDCA⁴⁾
- Calvert式で投与量を算出する
▼PEM⁴⁾
- 重度の腎機能障害患者には投与しない。 なお、 CrCl<45mL/minの患者は臨床試験において除外されている
休薬・中止基準
▼アミバンタマブの休薬・中止基準
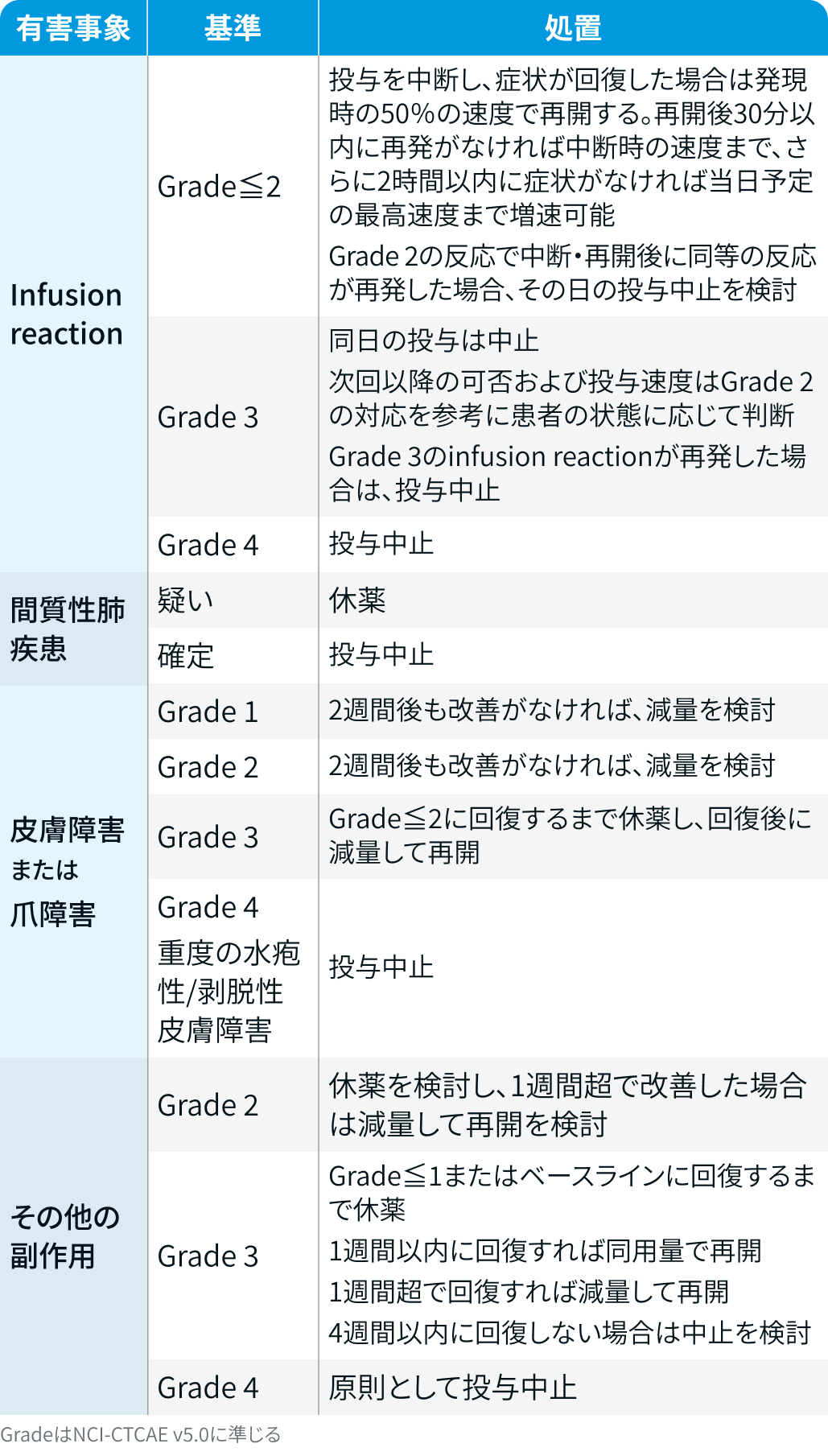
ライブリバント®電子添文を基に編集部作成
レジメンの特徴と注意点
👨⚕️MARIPOSA試験と比較すると皮膚障害はやや軽度であるものの、 IRR、 下痢、 浮腫、 骨髄抑制など多様な有害事象への管理が求められる。
和歌山県立医科大学附属病院 赤松弘朗先生
作用機序の特徴
アミバンタマブは、 EGFRとMETに対する二重特異性モノクローナル抗体であり、 シグナル伝達の阻害とADCC活性などにより腫瘍増殖を抑制すると考えられている。
本レジメンの位置づけ
本レジメンはEGFR遺伝子変異陽性NSCLCに対するオシメルチニブ治療後の進行例に対する2次治療以降の選択肢。
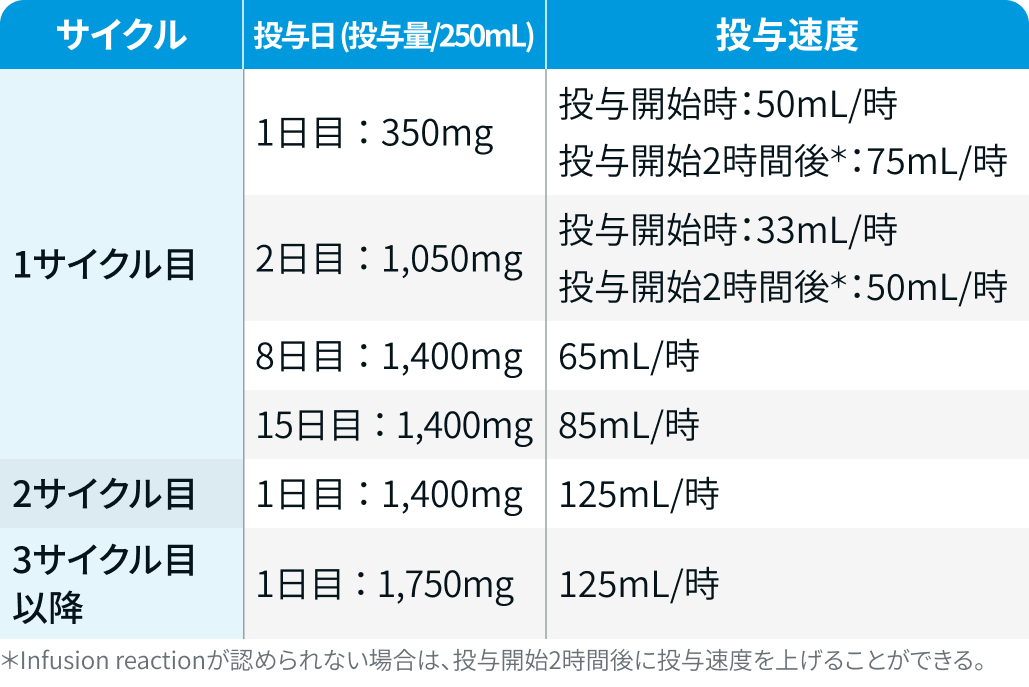
Infusion reactionの予防と投与速度
初回投与時 (1サイクル目の1日目) に多く発現するため、 1日目および2日目には副腎皮質ホルモン剤、 抗ヒスタミン剤、 解熱鎮痛剤を投与し、 必要に応じてH₂受容体拮抗剤や制吐剤を併用する。 第8日目以降は、 抗ヒスタミン剤および解熱鎮痛剤を基本とし、 必要に応じて副腎皮質ホルモン剤などを追加する。
調製後の希釈液 (全量250mL) を以下の速度で投与する。
体重<80kg
体重≧80kg
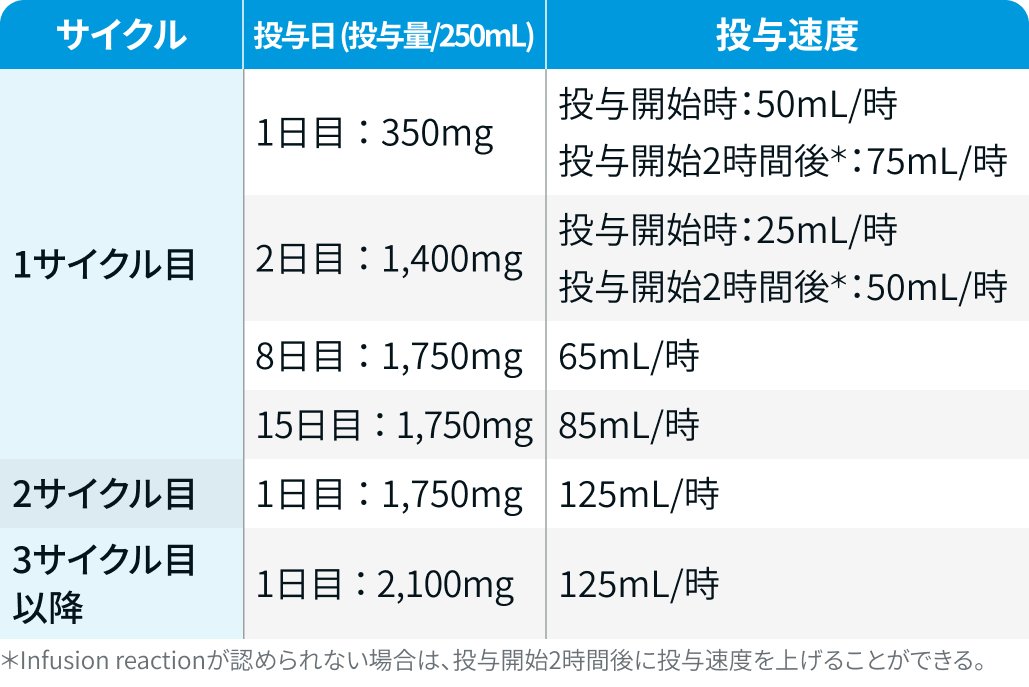
レジメン適用時の注意事項
- 静脈血栓塞栓症の既往がある患者では、 悪化や再発のリスクがあるため慎重に投与を判断する
- アミバンタマブ、 ラゼルチニブ、 カルボプラチン、 ペメトレキセドの4剤併用投与は行わない
- ざ瘡様皮膚炎、 発疹、 皮膚乾燥、 爪囲炎などの重度の皮膚障害が報告されており、 早期の発見と、 症状に応じたステロイド外用薬、 抗菌薬内服、 スキンケアなどによる適切な対処を行う
- 体液貯留が認められた場合は、 深部静脈血栓症の鑑別を行う
- EGFRおよびMET経路阻害により多様な消化管副作用が生じ得るため、 重症度に応じて休薬・減量・中止を検討し、 止痢薬の使用や食事・生活指導を行う
RMP【重要な特定されたリスク】
ライブリバント® 医薬品リスク管理計画書 (RMP)
- Infusion reaction
- 間質性肺疾患
- 重度の皮膚障害
- 静脈血栓塞栓症 (ラゼルチニブ併用時)
出典
- ライブリバント®点滴静注350mg 電子添文 (2025年5月改訂 第3版) [最終閲覧 : 2025/5/26]
- ライブリバント®点滴静注350mg 適正使用ガイド (2025年5月改訂) [最終閲覧 : 2025/5/26]
- Ann Oncol. 2024;35(1):77-90.
- がん薬物療法時の腎障害診療ガイドライン2022
最終更新日 : 2025年5月27日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : HOKUTO編集部監修医師
Amivantamab+CBDCA+PEM
本コンテンツは特定の治療法を推奨するものではございません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
2024年5月31日、 「EGFR遺伝子変異陽性の切除不能な進行・再発の非小細胞肺癌」 を対象として製造販売承認を申請し、 2025年5月19日に正式に承認された。
薬剤情報
EGFR/MET二重特異性抗体 アミバンタマブ
*ヤンセンファーマ株式会社の外部サイトへ遷移します
-カルボプラチン® (添付文書)
-ペメトレキセド® (添付文書)
投与スケジュール
EGFR遺伝子変異陽性の切除不能な進行・再発の非小細胞肺癌
【1コース】21日間
【催吐性】中等度
【FN発症】低リスク*
*MARIPOSA-2試験³⁾のFN発症率2%に基づき編集部が分類。
1、 2コース目 (W1は1週目、 D1は1日目を指す)

3、 4コース目

5コース目以降

ライブリバント®電子添文を基に編集部作成
アミバンタマブは、 体重<80kgでは1,400mg (≧80kgでは1,750mg) を週1回で4週間投与し、 3サイクル目 (7週目) 以降は1,750mg (同2,100mg) を3週ごとに投与。 初回投与は2日間に分割し、 サイクル1 Day1に350mg、 Day2に残量を投与。
Key Data|臨床試験結果
📊 MARIPOSA-2試験³⁾
オシメルチニブによる治療中または治療後に病勢進行したEGFR遺伝子変異 (Ex19delまたはL858R) 陽性の局所進行または転移性NSCLC患者657例を対象とした国際共同第III相非盲検ランダム化比較試験。 Amivantamab+化学療法 (カルボプラチン+ペメトレキセド) 群と化学療法単独群、 およびAmivantamab+Lazertinib+化学療法群に2:1:2の比率で無作為に割り付け、 主要評価項目としてPFSがAmivantamab+化学療法群 vs 化学療法群、 およびAmivantamab+Lazertinib+化学療法群 vs 化学療法群で評価された。
【有効性】Amivantamab+化学療法群
- PFS中央値: 6.3ヵ月、 HR 0.48 (vs 化学療法、 p<0.001)
- 6ヵ月PFS率: 51%、 12ヵ月PFS率: 22%
- 頭蓋内PFS中央値: 12.5ヵ月、 HR 0.55 (vs 化学療法)
- 客観的奏効率: 64%
- 奏効期間中央値: 6.9ヵ月
- OS (中間解析): HR 0.77 (vs 化学療法)
【安全性】主な有害事象: 全Grade% (Grade≧3)
- 好中球減少: 57% (45%)
- 血小板減少: 44% (19%)
- Infusion-related reaction: 58% (5%)
- 貧血: 39% (12%)
- 爪囲炎: 37% (2%)
- 悪心: 45% (1%)
- 発疹: 43% (6%)
- 口内炎: 32% (1%)
- 白血球減少: 28% (20%)
- 低アルブミン血症: 22% (2%)
- 便秘: 38% (1%)
- 食欲減退: 31% (0%)
- 末梢性浮腫: 32% (2%)
- 嘔吐: 25% (1%)
- 疲労: 28% (3%)
- 下痢: 14% (1%)
- 無力症: 26% (1%)
- ざ瘡様皮膚炎: 20% (4%)
- ALT上昇: 20% (5%)
- 低カリウム血症: 18% (5%)
- COVID-19: 21% (2%)
- 低カルシウム血症: 12% (1%)
- AST上昇: 15% (1%)
- 低ナトリウム血症: 10% (4%)
- 掻痒症: 15% (0%)
各プロトコル
適格基準
MARIPOSA-2試験の主な適格基準
- 年齢: 18歳以上
- PS: ECOG PS 0または1
- 好中球数: ≧1,500/μL
- 血小板数: ≧10万/μL
- ヘモグロビン値: ≧10 g/dL
- 腎機能: CrCl >50 mL/min
- 肝機能: 総ビリルビン ≤1.5x ULN (肝転移例では≤3x ULN)、 ALT/AST ≤3x ULN
有害事象発現時の用量レベル
▼アミバンタマブ

▼CBDCA/PEM

腎障害患者に対する用量調整
▼CBDCA⁴⁾
- Calvert式で投与量を算出する
▼PEM⁴⁾
- 重度の腎機能障害患者には投与しない。 なお、 CrCl<45mL/minの患者は臨床試験において除外されている
休薬・中止基準
▼アミバンタマブの休薬・中止基準

ライブリバント®電子添文を基に編集部作成
レジメンの特徴と注意点
👨⚕️MARIPOSA試験と比較すると皮膚障害はやや軽度であるものの、 IRR、 下痢、 浮腫、 骨髄抑制など多様な有害事象への管理が求められる。
和歌山県立医科大学附属病院 赤松弘朗先生
作用機序の特徴
アミバンタマブは、 EGFRとMETに対する二重特異性モノクローナル抗体であり、 シグナル伝達の阻害とADCC活性などにより腫瘍増殖を抑制すると考えられている。
本レジメンの位置づけ
本レジメンはEGFR遺伝子変異陽性NSCLCに対するオシメルチニブ治療後の進行例に対する2次治療以降の選択肢。
Infusion reactionの予防と投与速度
初回投与時 (1サイクル目の1日目) に多く発現するため、 1日目および2日目には副腎皮質ホルモン剤、 抗ヒスタミン剤、 解熱鎮痛剤を投与し、 必要に応じてH₂受容体拮抗剤や制吐剤を併用する。 第8日目以降は、 抗ヒスタミン剤および解熱鎮痛剤を基本とし、 必要に応じて副腎皮質ホルモン剤などを追加する。
調製後の希釈液 (全量250mL) を以下の速度で投与する。
体重<80kg

体重≧80kg

レジメン適用時の注意事項
- 静脈血栓塞栓症の既往がある患者では、 悪化や再発のリスクがあるため慎重に投与を判断する
- アミバンタマブ、 ラゼルチニブ、 カルボプラチン、 ペメトレキセドの4剤併用投与は行わない
- ざ瘡様皮膚炎、 発疹、 皮膚乾燥、 爪囲炎などの重度の皮膚障害が報告されており、 早期の発見と、 症状に応じたステロイド外用薬、 抗菌薬内服、 スキンケアなどによる適切な対処を行う
- 体液貯留が認められた場合は、 深部静脈血栓症の鑑別を行う
- EGFRおよびMET経路阻害により多様な消化管副作用が生じ得るため、 重症度に応じて休薬・減量・中止を検討し、 止痢薬の使用や食事・生活指導を行う
RMP【重要な特定されたリスク】
ライブリバント® 医薬品リスク管理計画書 (RMP)
- Infusion reaction
- 間質性肺疾患
- 重度の皮膚障害
- 静脈血栓塞栓症 (ラゼルチニブ併用時)
出典
- ライブリバント®点滴静注350mg 電子添文 (2025年5月改訂 第3版) [最終閲覧 : 2025/5/26]
- ライブリバント®点滴静注350mg 適正使用ガイド (2025年5月改訂) [最終閲覧 : 2025/5/26]
- Ann Oncol. 2024;35(1):77-90.
- がん薬物療法時の腎障害診療ガイドライン2022
最終更新日 : 2025年5月27日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : HOKUTO編集部監修医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。