治療スケジュール
概要
監修医師
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
ムンデシン®(添付文書)
主な有害事象
FDS-J02試験¹⁾より引用
【骨髄抑制】
- リンパ球減少症(100%、 ≧Grade3 96%)
- 白血球減少症(73%、 ≧Grade3 42%)
- 好中球減少症(56%、 ≧Grade3 35%)
- 血小板減少症(48%、 ≧Grade3 25%)
- 貧血(48%、 ≧Grade3 23%)
- 発熱性好中球減少症(13%、 ≧Grade3 13%)
【主な有害事象】
- 便秘(27%、 ≧Grade3 2%)
- 鼻咽頭炎(27%、 ≧Grade3 0%)
- 低アルブミン血症(25%、 ≧Grade3 4%)
- 浮腫(25%、 ≧Grade3 0%)
- 発熱(23%、 ≧Grade3 2%)
- 口内炎(23%、 ≧Grade3 2%)
- 頭痛(23%、 ≧Grade3 0%)
- 不眠症(21%、 ≧Grade3 0%)
- ALT増加(21%、 ≧Grade3 2%)
- 嘔気(19%、 ≧Grade3 2%)
- 食欲不振(19%、 ≧Grade3 8%)
- 倦怠感(17%、 ≧Grade3 0%)
- AST増加(17%、 ≧Grade3 0%)
- 発疹(17%、 ≧Grade3 0%)
- 肝機能異常(15%、 ≧Grade3 6%)
- 帯状疱疹(15%、 ≧Grade3 2%)
- 掻痒感(15%、 ≧Grade3 0%)
- タンパク尿(15%、 ≧Grade3 0%)
- 嘔吐(13%、 ≧Grade3 0%)
- サイトメガロウイルス感染症(10%、 ≧Grade3 0%)
- 肺炎(10%、 ≧Grade3 8%)
- 低Na血症(10%、 ≧Grade3 8%)
- 体重減少(10%、 ≧Grade3 2%)
【その他重要な有害事象】
- EBV関連リンパ腫 (8.3%、 Grade5=4.2%)
- 心不全(頻度不明、 海外試験で報告)
特徴と注意点
- PTCLに適応を持つ最初の経口薬として2017年に承認.
2021年11月に2剤目の経口薬としてツシジノスタットが承認された
- PNPを阻害しT細胞の増殖を抑える.
PNP:purine nucleoside phosphorylase
- 腎機能低下患者では減量を考慮.
副作用と対策
- Grade 3以上のリンパ球減少が高頻度に発現.
- 感染症予防にST合剤、 抗ヘルペスウイルス剤の投与を推奨.
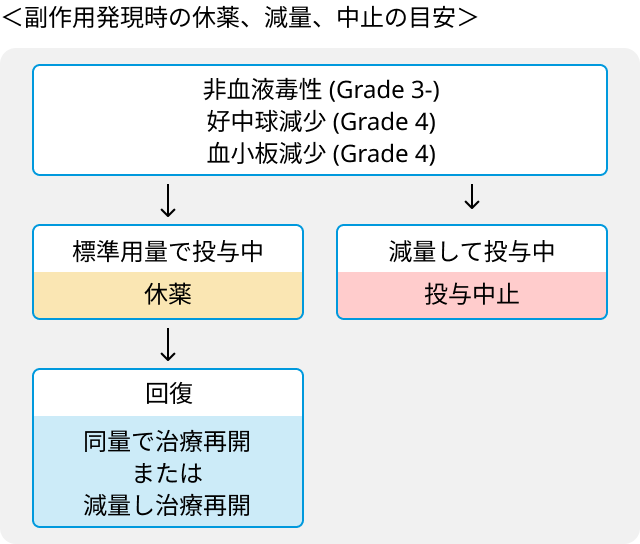
減量・休薬基準
- Grade 3以上の非血液毒性、 Grade 4の好中球減少、 血小板減少で休薬.
関連する臨床試験の結果
FDS-J02試験¹⁾
- 海外臨床試験では200mg1日1回でCTCL、 CLLへの有効性が認められず、 より高用量の300mg1日2回でPTCLに対する国内臨床試験が行われた.
概要
- 多施設共同非盲検第1/2相試験(シングルアーム).
- 対象:再発/難治性PTCLの日本人患者48例.
- 主要評価項目:ORR.
- 副次評価項目:DoR、 PFS、 OS、 安全性
ORR:全奏効割合、 DoR:奏効持続期間、 PFS:無増悪生存期間、 OS:全生存期間
結果
- ORR:22%
参考文献
1. Ann Hematol. 2019 Jan;98(1):131-142.
最終更新:2022年2月26日
監修医師:東海大学血液腫瘍内科 扇屋大輔
Forodesine
フォロデシン(ムンデシン®)
2023年06月07日更新
Forodesine:フォロデシン(ムンデシン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1回300mg 1日2回 経口 | 1~ | Day 1~ |
概要
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
ムンデシン®(添付文書)
主な有害事象
FDS-J02試験¹⁾より引用
【骨髄抑制】
- リンパ球減少症(100%、 ≧Grade3 96%)
- 白血球減少症(73%、 ≧Grade3 42%)
- 好中球減少症(56%、 ≧Grade3 35%)
- 血小板減少症(48%、 ≧Grade3 25%)
- 貧血(48%、 ≧Grade3 23%)
- 発熱性好中球減少症(13%、 ≧Grade3 13%)
【主な有害事象】
- 便秘(27%、 ≧Grade3 2%)
- 鼻咽頭炎(27%、 ≧Grade3 0%)
- 低アルブミン血症(25%、 ≧Grade3 4%)
- 浮腫(25%、 ≧Grade3 0%)
- 発熱(23%、 ≧Grade3 2%)
- 口内炎(23%、 ≧Grade3 2%)
- 頭痛(23%、 ≧Grade3 0%)
- 不眠症(21%、 ≧Grade3 0%)
- ALT増加(21%、 ≧Grade3 2%)
- 嘔気(19%、 ≧Grade3 2%)
- 食欲不振(19%、 ≧Grade3 8%)
- 倦怠感(17%、 ≧Grade3 0%)
- AST増加(17%、 ≧Grade3 0%)
- 発疹(17%、 ≧Grade3 0%)
- 肝機能異常(15%、 ≧Grade3 6%)
- 帯状疱疹(15%、 ≧Grade3 2%)
- 掻痒感(15%、 ≧Grade3 0%)
- タンパク尿(15%、 ≧Grade3 0%)
- 嘔吐(13%、 ≧Grade3 0%)
- サイトメガロウイルス感染症(10%、 ≧Grade3 0%)
- 肺炎(10%、 ≧Grade3 8%)
- 低Na血症(10%、 ≧Grade3 8%)
- 体重減少(10%、 ≧Grade3 2%)
【その他重要な有害事象】
- EBV関連リンパ腫 (8.3%、 Grade5=4.2%)
- 心不全(頻度不明、 海外試験で報告)
特徴と注意点
- PTCLに適応を持つ最初の経口薬として2017年に承認.
2021年11月に2剤目の経口薬としてツシジノスタットが承認された
- PNPを阻害しT細胞の増殖を抑える.
PNP:purine nucleoside phosphorylase
- 腎機能低下患者では減量を考慮.
副作用と対策
- Grade 3以上のリンパ球減少が高頻度に発現.
- 感染症予防にST合剤、 抗ヘルペスウイルス剤の投与を推奨.
減量・休薬基準
- Grade 3以上の非血液毒性、 Grade 4の好中球減少、 血小板減少で休薬.

関連する臨床試験の結果
FDS-J02試験¹⁾
- 海外臨床試験では200mg1日1回でCTCL、 CLLへの有効性が認められず、 より高用量の300mg1日2回でPTCLに対する国内臨床試験が行われた.
概要
- 多施設共同非盲検第1/2相試験(シングルアーム).
- 対象:再発/難治性PTCLの日本人患者48例.
- 主要評価項目:ORR.
- 副次評価項目:DoR、 PFS、 OS、 安全性
ORR:全奏効割合、 DoR:奏効持続期間、 PFS:無増悪生存期間、 OS:全生存期間
結果
- ORR:22%
参考文献
1. Ann Hematol. 2019 Jan;98(1):131-142.
最終更新:2022年2月26日
監修医師:東海大学血液腫瘍内科 扇屋大輔
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(血液)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。