概要
監修医師
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
タキサン系抗悪性腫瘍薬 ドセタキセル
*サノフィ株式会社の外部サイトへ遷移します
投与スケジュール
電子添文¹⁾の用法及び用量
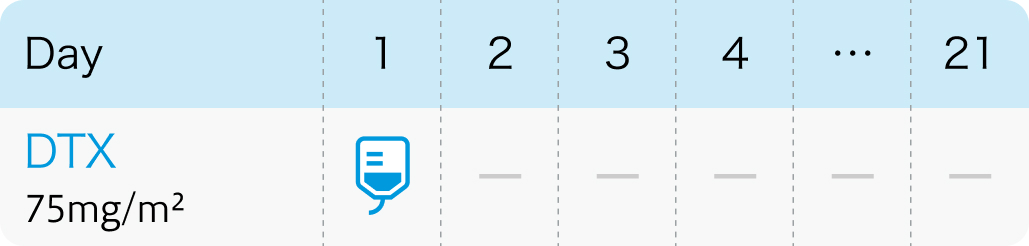
ワンタキソテール®電子添文 (2024年6月改訂第5版)より作図
特徴と注意点
ドセタキセルは6サイクルで終了する。 CRPCの治療と異なりプレドニゾロン併用は不要。
関連:DTX+PSL、 DTX (biweekly) +PSL
監修:国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
KeyData|臨床試験結果
CHAARTED試験³⁾
J Clin Oncol. 2018 Apr 10;36(11):1080-7.
ホルモン感受性の転移性前立腺癌患者において、 アンドロゲン除去療法 (ADT) とドセタキセル (DTX) 併用療法の効果を、 ADT単独療法を対照に検証した第Ⅲ相比較試験CHAARTEDの結果より、 高腫瘍量の患者における全生存期間 (OS) に対する有益性が示された。
有効性|ドセタキセル群
- mOS:全患者 57.6ヵ月
高腫瘍量患者 51.2ヵ月 低腫瘍量患者 63.5ヵ月
- CRPC発症までの期間 (中央値):19.4ヵ月
高腫瘍量患者 14.9ヵ月 低腫瘍量患者 31.0ヵ月
- 疾患進行までの期間 (中央値):33.0ヵ月
高腫瘍量患者 27.3ヵ月 低腫瘍量患者 42.5ヵ月
安全性|主な有害事象 (カッコ内はGrade3~5)
- 貧血 72.0% (2.1%)
- 好中球減少症 49.7% (32.3%)
- 血小板減少症 10.6% (0.5%)
- 発熱性好中球減少症 7.9% (7.9%)
- 好中球減少症による感染症 2.6% (2.6%)
- 倦怠感 74.1% (6.9%)
- 下痢 30.7% (0.5%)
- 悪心 29.1% (0%)
- ALT上昇 22.8% (1.6%)
- 便秘 22.2% (0%)
- AST上昇 20.1% (1.6%)
- 嘔吐 8.5%(0%)
注意すべき有害事象 (カッコ内はGrade3~5)
- 脱毛症 54.0% (2.6%)
- 感覚性ニューロパチー 28.6% (1.6%)
Lancet Oncol. 2013 Feb;14(2):149-58より引用
各プロトコル
投与開始基準
CHAARTED試験³⁾のプロトコル

J Clin Oncol . 2018 Apr 10;36(11):1080-1087より作図
休薬基準
CHAARTED試験²⁾のプロトコル
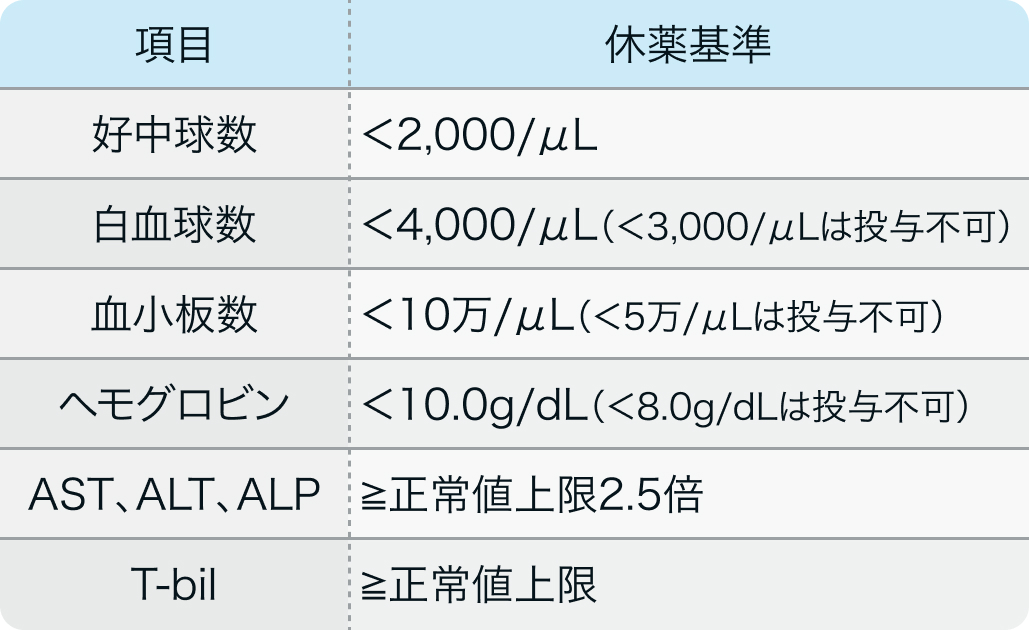
J Clin Oncol . 2018 Apr 10;36(11):1080-1087より作図
出典
- サノフィ株式会社. ワンタキソテール®電子添文 (2024年6月改訂第5版) [最終閲覧 : 2024/11/29]
- サノフィ株式会社. ワンタキソテール®適正使用ガイド (2024年11月作成) [最終閲覧 : 2024/11/29]
- Chemohormonal Therapy in Metastatic Hormone-Sensitive Prostate Cancer: Long-Term Survival Analysis of the Randomized Phase III E3805 CHAARTED Trial. J Clin Oncol . 2018 Apr 10;36(11):1080-1087. PMID: 29384722
- Androgen-deprivation therapy alone or with docetaxel in non-castrate metastatic prostate cancer (GETUG-AFU 15): a randomised, open-label, phase 3 trial. Lancet Oncol. 2013 Feb;14(2):149-58. PMID: 23306100
最終更新日:2024年11月29日
監修医師:国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
DTX
ドセタキセル (ワンタキソテール®)
2024年11月29日更新
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
タキサン系抗悪性腫瘍薬 ドセタキセル
*サノフィ株式会社の外部サイトへ遷移します
投与スケジュール
電子添文¹⁾の用法及び用量

ワンタキソテール®電子添文 (2024年6月改訂第5版)より作図
特徴と注意点
ドセタキセルは6サイクルで終了する。 CRPCの治療と異なりプレドニゾロン併用は不要。
関連:DTX+PSL、 DTX (biweekly) +PSL
監修:国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
KeyData|臨床試験結果
CHAARTED試験³⁾
J Clin Oncol. 2018 Apr 10;36(11):1080-7.
ホルモン感受性の転移性前立腺癌患者において、 アンドロゲン除去療法 (ADT) とドセタキセル (DTX) 併用療法の効果を、 ADT単独療法を対照に検証した第Ⅲ相比較試験CHAARTEDの結果より、 高腫瘍量の患者における全生存期間 (OS) に対する有益性が示された。
有効性|ドセタキセル群
- mOS:全患者 57.6ヵ月
高腫瘍量患者 51.2ヵ月 低腫瘍量患者 63.5ヵ月
- CRPC発症までの期間 (中央値):19.4ヵ月
高腫瘍量患者 14.9ヵ月 低腫瘍量患者 31.0ヵ月
- 疾患進行までの期間 (中央値):33.0ヵ月
高腫瘍量患者 27.3ヵ月 低腫瘍量患者 42.5ヵ月
安全性|主な有害事象 (カッコ内はGrade3~5)
- 貧血 72.0% (2.1%)
- 好中球減少症 49.7% (32.3%)
- 血小板減少症 10.6% (0.5%)
- 発熱性好中球減少症 7.9% (7.9%)
- 好中球減少症による感染症 2.6% (2.6%)
- 倦怠感 74.1% (6.9%)
- 下痢 30.7% (0.5%)
- 悪心 29.1% (0%)
- ALT上昇 22.8% (1.6%)
- 便秘 22.2% (0%)
- AST上昇 20.1% (1.6%)
- 嘔吐 8.5%(0%)
注意すべき有害事象 (カッコ内はGrade3~5)
- 脱毛症 54.0% (2.6%)
- 感覚性ニューロパチー 28.6% (1.6%)
Lancet Oncol. 2013 Feb;14(2):149-58より引用
各プロトコル
投与開始基準
CHAARTED試験³⁾のプロトコル

J Clin Oncol . 2018 Apr 10;36(11):1080-1087より作図
休薬基準
CHAARTED試験²⁾のプロトコル

J Clin Oncol . 2018 Apr 10;36(11):1080-1087より作図
出典
- サノフィ株式会社. ワンタキソテール®電子添文 (2024年6月改訂第5版) [最終閲覧 : 2024/11/29]
- サノフィ株式会社. ワンタキソテール®適正使用ガイド (2024年11月作成) [最終閲覧 : 2024/11/29]
- Chemohormonal Therapy in Metastatic Hormone-Sensitive Prostate Cancer: Long-Term Survival Analysis of the Randomized Phase III E3805 CHAARTED Trial. J Clin Oncol . 2018 Apr 10;36(11):1080-1087. PMID: 29384722
- Androgen-deprivation therapy alone or with docetaxel in non-castrate metastatic prostate cancer (GETUG-AFU 15): a randomised, open-label, phase 3 trial. Lancet Oncol. 2013 Feb;14(2):149-58. PMID: 23306100
最終更新日:2024年11月29日
監修医師:国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(泌尿器)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。