本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
カンプト® (添付文書¹⁾)
用法用量
3回投与+2週休薬
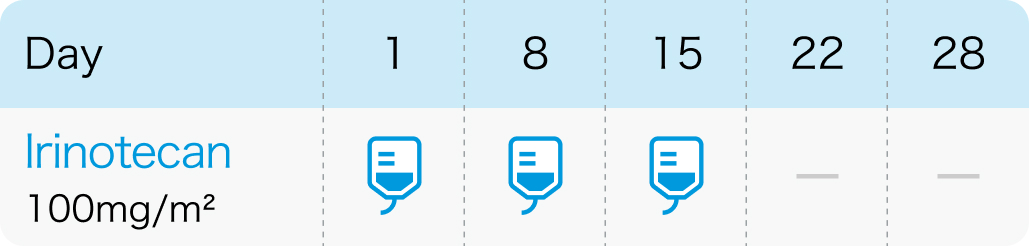
4回投与+2週休薬
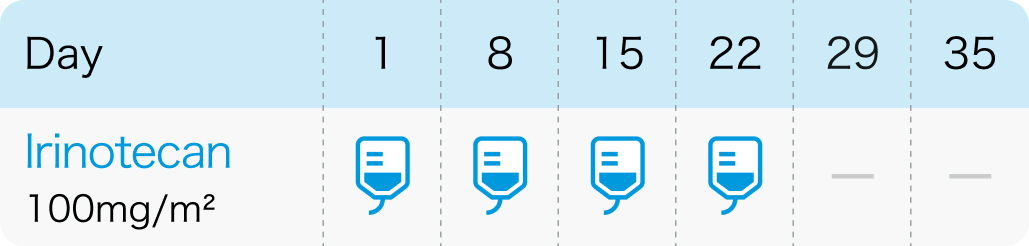
1日1回、 100mg/m²を1週間間隔で3~4回点滴静注し、 少なくとも2週間休薬¹⁾
カンプト®電子添文 (2022年12月改訂第1版) より作図
投与開始基準
国内第II相試験²⁾のプロトコル
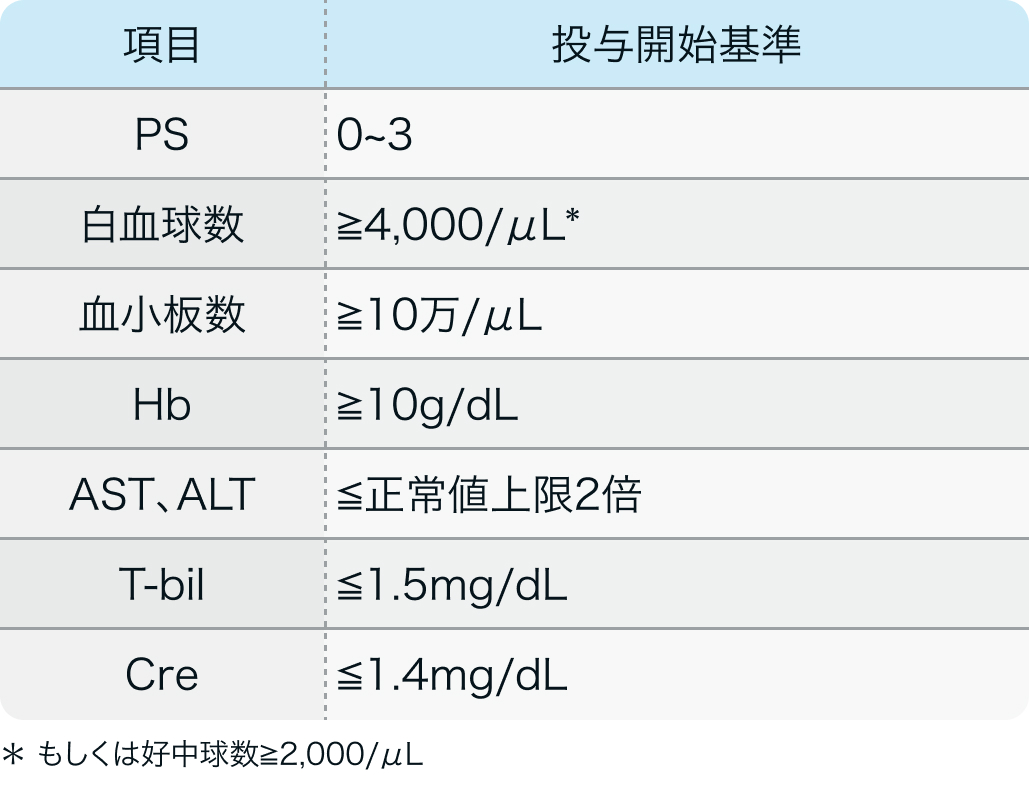
Skin Cancer. 1993;8 : 503-513²⁾より作図
休薬・中止基準
電子添文¹⁾「用法及び用量に関連する注意」
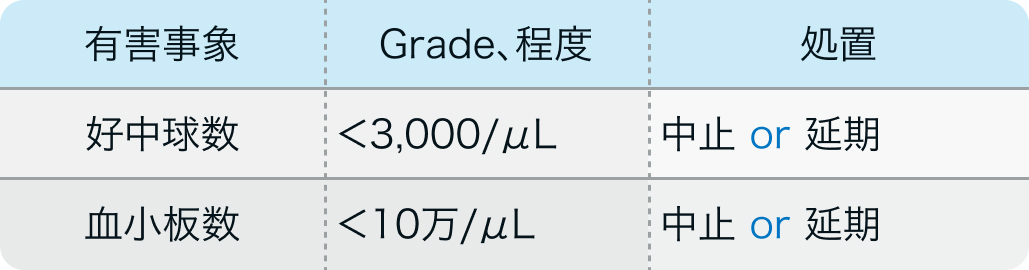
カンプト®電子添文 (2022年12月改訂第1版) より作図
投与可能な数値であっても、 白血球数又は血小板数が急激な減少傾向にあるなど、 骨髄機能抑制が疑われる場合には、 中止または延期
白血球数が異常な高値を示す患者及びCRPが異常値を示すなど感染症が疑われる患者において、 投与後に白血球の急激な減少が起こった場合、 投与可能な数値であっても、 骨髄機能の回復を十分に確認してから投与を行うこと
主な有害事象
国内第II相試験²⁾
主な有害事象 (カッコ内はGrade3~4)
- 白血球減少症 71.1% (18.4%)
- 貧血 46.1% (10.5%)
- 血小板減少症 11.8% (5.3%)
- AST上昇 13.2% (1.3%)
- ALT上昇 17.1% (0%)
- T-bil上昇 5.3% (0%)
- クレアチニン上昇 2.7% (1.3%)
- 食欲不振 73.7% (23.7%)
- 悪心/嘔吐 73.7% (15.8%)
- 下痢 52.6% (15.8%)
- 脱毛 35.6% (6.8%)
- 発熱 5.3% (1.3%)
- 全身倦怠感 2.6% (1.3%)
Skin Cancer. 1993;8 : 503-513より引用
エキスパートによるワンポイント
患者選定における注意点
国内では根治切除不能な局所進行または遠隔転移を有する有棘細胞癌に用いられることがある。 2024年2月にニボルマブが上皮系皮膚悪性腫瘍に承認されてからは、 ニボルマブに不応または自己免疫疾患を合併し免疫抑制剤を服用中等の理由で免疫療法が適さない患者に用いられる。 また、 UGT1A16又はUGT1A128のいずれかをホモ接合体またはヘテロ接合体としてもつ患者は、 好中球減少や下痢といった副作用のハイリスク群とされ、 投与する際には副作用に注意が必要である。
用法と用量、 および臨床効果
有棘細胞癌では、 A法を用いる。 用法・用量は、 イリノテカン塩酸塩として、 通常、 成人に1日1回、 100mg/m²を1週間間隔で3~4回点滴静注し、 少なくとも2週間休薬する。 これを1コースとして、 臨床効果が得られなくなるか、 許容できない副作用が発生するまで投与を繰り返す。 投与量は年齢、 症状により適宜増減する。 投与方法は、 500mL以上の生理食塩水、 ブドウ糖液または電解質維持液に混和し、 90分以上かけて点滴静注する。
国内第II相試験²⁾の結果と有害事象
有棘細胞癌および悪性黒色腫を対象にイリノテカン塩酸塩の単独投与レジメン (1日1回、 100mg/m²を1週間間隔で3~4回点滴静注し、 2週間休薬する) を評価する国内第II相試験²⁾が行われた。 有棘細胞癌では、 適格例41例中13例に奏効が確認され、 奏効割合は31.7%であった。 有棘細胞癌と悪性黒色腫を合わせた76例で観察されたGrade3以上の有害事象は、 食欲不振 (23.7%)、 悪心・嘔吐 (15.8%)、 下痢 (15.8%) などの消化器毒性が多く、 次いで白血球減少 (18.4%)、 貧血 (10.5%)、 血小板減少 (5.3%) などの血液毒性、 そして脱毛 (6.6%)、 腹痛 (2.6%)、 肝機能障害 (1.3%)、 腎機能障害 (1.3%)、 発熱 (1.3%)、 全身倦怠感 (1.3%) などであった。
代謝と副作用のリスク管理
イリノテカンは、 主に肝臓においてカルボキシルエステラーゼによって活性代謝物であるSN-38に変換される。 SN-38は、 主に肝臓の代謝酵素であるUGT1A1によってグルクロン酸抱合されSN-38Gとなり、 主に胆汁中に排泄される。 UGT1A16又はUGT1A128のいずれかをホモ接合体またはヘテロ接合体としてもつ患者は、 UGT1A1のグルクロン酸抱合能が低下し、 SN-38 の代謝が遅延することにより、 好中球減少や下痢といった副作用を生じやすいため注意が必要である。
監修 : 国立がん研究センター中央病院 皮膚腫瘍科 医長 並川 健二郎先生
出典
- ヤクルト本社. カンプト®電子添文 (2022年12月改訂第1版) [最終閲覧 : 2024/03/01]
- 有棘細胞癌および悪性黒色腫に対する塩酸イリノテカン (CPT-11) の後期第II相臨床試験. Skin Cancer. 1993;8 : 503-513
その他情報は随時更新予定です
最終更新日 : 2024年5月16日
監修医師 : 国立がん研究センター中央病院 皮膚腫瘍科 医長 並川 健二郎先生
Irinotecan
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
カンプト® (添付文書¹⁾)
用法用量
3回投与+2週休薬

4回投与+2週休薬

1日1回、 100mg/m²を1週間間隔で3~4回点滴静注し、 少なくとも2週間休薬¹⁾
カンプト®電子添文 (2022年12月改訂第1版) より作図
投与開始基準
国内第II相試験²⁾のプロトコル

Skin Cancer. 1993;8 : 503-513²⁾より作図
休薬・中止基準
電子添文¹⁾「用法及び用量に関連する注意」

カンプト®電子添文 (2022年12月改訂第1版) より作図
投与可能な数値であっても、 白血球数又は血小板数が急激な減少傾向にあるなど、 骨髄機能抑制が疑われる場合には、 中止または延期
白血球数が異常な高値を示す患者及びCRPが異常値を示すなど感染症が疑われる患者において、 投与後に白血球の急激な減少が起こった場合、 投与可能な数値であっても、 骨髄機能の回復を十分に確認してから投与を行うこと
主な有害事象
国内第II相試験²⁾
主な有害事象 (カッコ内はGrade3~4)
- 白血球減少症 71.1% (18.4%)
- 貧血 46.1% (10.5%)
- 血小板減少症 11.8% (5.3%)
- AST上昇 13.2% (1.3%)
- ALT上昇 17.1% (0%)
- T-bil上昇 5.3% (0%)
- クレアチニン上昇 2.7% (1.3%)
- 食欲不振 73.7% (23.7%)
- 悪心/嘔吐 73.7% (15.8%)
- 下痢 52.6% (15.8%)
- 脱毛 35.6% (6.8%)
- 発熱 5.3% (1.3%)
- 全身倦怠感 2.6% (1.3%)
Skin Cancer. 1993;8 : 503-513より引用
エキスパートによるワンポイント
患者選定における注意点
国内では根治切除不能な局所進行または遠隔転移を有する有棘細胞癌に用いられることがある。 2024年2月にニボルマブが上皮系皮膚悪性腫瘍に承認されてからは、 ニボルマブに不応または自己免疫疾患を合併し免疫抑制剤を服用中等の理由で免疫療法が適さない患者に用いられる。 また、 UGT1A16又はUGT1A128のいずれかをホモ接合体またはヘテロ接合体としてもつ患者は、 好中球減少や下痢といった副作用のハイリスク群とされ、 投与する際には副作用に注意が必要である。
用法と用量、 および臨床効果
有棘細胞癌では、 A法を用いる。 用法・用量は、 イリノテカン塩酸塩として、 通常、 成人に1日1回、 100mg/m²を1週間間隔で3~4回点滴静注し、 少なくとも2週間休薬する。 これを1コースとして、 臨床効果が得られなくなるか、 許容できない副作用が発生するまで投与を繰り返す。 投与量は年齢、 症状により適宜増減する。 投与方法は、 500mL以上の生理食塩水、 ブドウ糖液または電解質維持液に混和し、 90分以上かけて点滴静注する。
国内第II相試験²⁾の結果と有害事象
有棘細胞癌および悪性黒色腫を対象にイリノテカン塩酸塩の単独投与レジメン (1日1回、 100mg/m²を1週間間隔で3~4回点滴静注し、 2週間休薬する) を評価する国内第II相試験²⁾が行われた。 有棘細胞癌では、 適格例41例中13例に奏効が確認され、 奏効割合は31.7%であった。 有棘細胞癌と悪性黒色腫を合わせた76例で観察されたGrade3以上の有害事象は、 食欲不振 (23.7%)、 悪心・嘔吐 (15.8%)、 下痢 (15.8%) などの消化器毒性が多く、 次いで白血球減少 (18.4%)、 貧血 (10.5%)、 血小板減少 (5.3%) などの血液毒性、 そして脱毛 (6.6%)、 腹痛 (2.6%)、 肝機能障害 (1.3%)、 腎機能障害 (1.3%)、 発熱 (1.3%)、 全身倦怠感 (1.3%) などであった。
代謝と副作用のリスク管理
イリノテカンは、 主に肝臓においてカルボキシルエステラーゼによって活性代謝物であるSN-38に変換される。 SN-38は、 主に肝臓の代謝酵素であるUGT1A1によってグルクロン酸抱合されSN-38Gとなり、 主に胆汁中に排泄される。 UGT1A16又はUGT1A128のいずれかをホモ接合体またはヘテロ接合体としてもつ患者は、 UGT1A1のグルクロン酸抱合能が低下し、 SN-38 の代謝が遅延することにより、 好中球減少や下痢といった副作用を生じやすいため注意が必要である。
監修 : 国立がん研究センター中央病院 皮膚腫瘍科 医長 並川 健二郎先生
出典
- ヤクルト本社. カンプト®電子添文 (2022年12月改訂第1版) [最終閲覧 : 2024/03/01]
- 有棘細胞癌および悪性黒色腫に対する塩酸イリノテカン (CPT-11) の後期第II相臨床試験. Skin Cancer. 1993;8 : 503-513
その他情報は随時更新予定です
最終更新日 : 2024年5月16日
監修医師 : 国立がん研究センター中央病院 皮膚腫瘍科 医長 並川 健二郎先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。