Bmab:Bevacizumab(アバスチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 7.5mg/kg 点滴 | 1~ | Day1 |
L-OHP:Oxaliplatin(エルプラット®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 130mg/m² 点滴 | 1~ | Day1 |
S-1:Tegafur/Gimeracil/Oteracil(ティーエスワン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 80~120mg/日 経口 (40~60mg/回 朝夕食後) | 1~ | Day1夕~15朝 |
前投薬
| 制吐目的:パロノセトロン点滴静注バッグ0.75mg50mL+デキサメタゾン注射液3.3mg2A |
| 制吐目的+アレルギー予防:パロノセトロン点滴静注バッグ0.75mg50mL+デキサメタゾン注射液3.3mg4A+ファモチジン10mg1A+クロルフェニラミン5mg1A |
その他
| 1コース21日間。 |
| S-1+L-OHPをSOX療法と呼ぶ。 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*大鵬薬品工業株式会社の外部サイトへ遷移します
*中外製薬の外部サイトへ遷移します
用法用量
SOFT試験⁶⁾のプロトコル
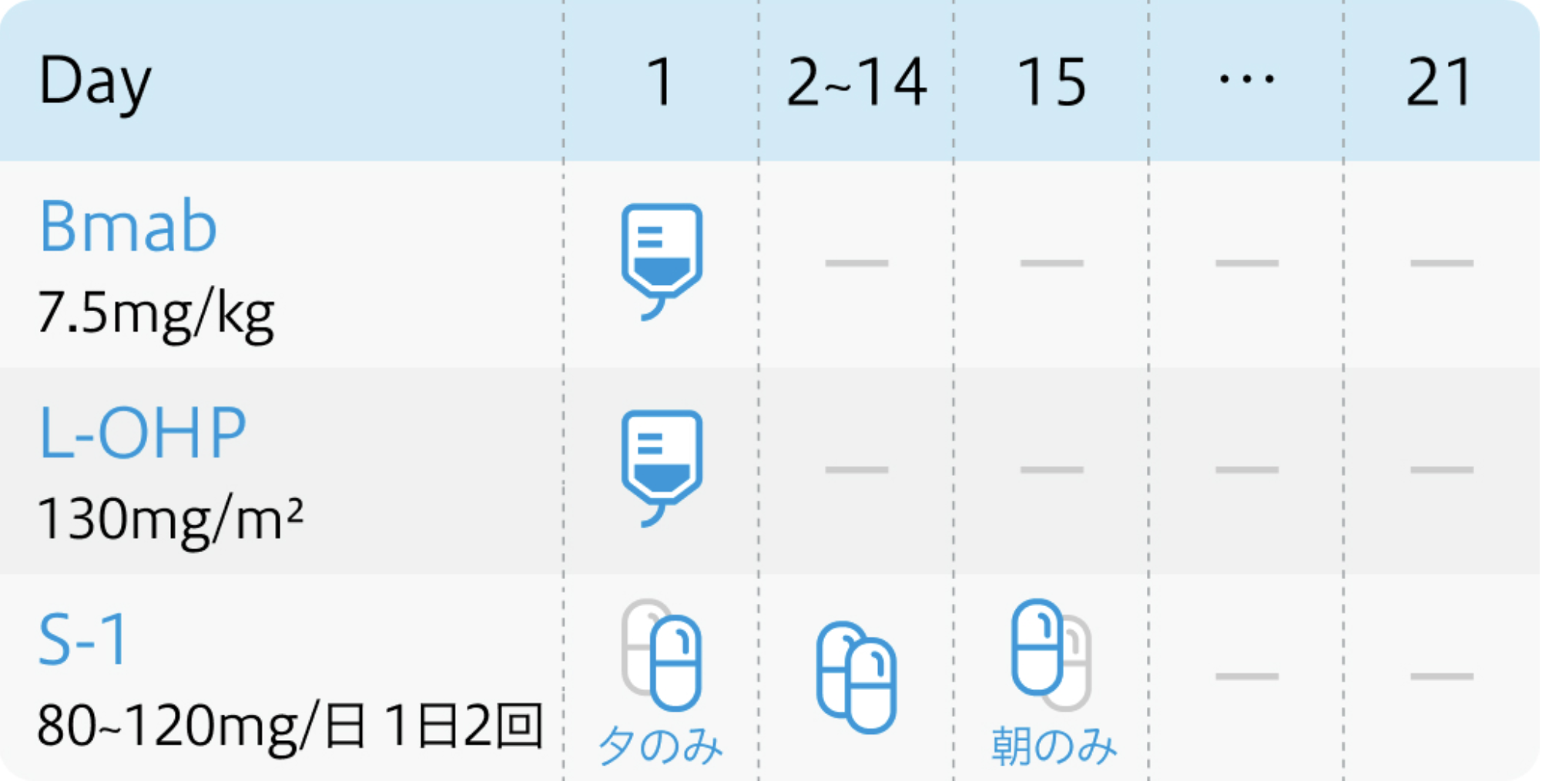
Lancet Oncol. 2013 Dec;14(13):1278-86.⁶⁾より作図
電子添文の用法および用量
ベバシズマブ : ①他の抗悪性腫瘍剤との併用において、 1回5mg/kgまたは10mg/kgを点滴静脈内注射する。 ②投与間隔は2週間以上とする。 他の抗悪性腫瘍剤との併用において、 1回7.5mg/kgを点滴静脈内注射する。 投与間隔は3週間以上とする。
アバスチン®電子添文 (2024年3月改訂 第5版)⁴⁾より引用
オキサリプラチン : A法またはB法を使用する。 [A法] 他の抗悪性腫瘍剤との併用において、 85mg/m²を1日1回静脈内に2時間で点滴投与し、 少なくとも13日間休薬する。 これを1サイクルとして投与を繰り返す。 [B法] 他の抗悪性腫瘍剤との併用において、 130mg/m²を1日1回静脈内に2時間で点滴投与し、 少なくとも20日間休薬する。 これを1サイクルとして投与を繰り返す。
エルプラット®電子添文 (2024年4月改訂 第4版)³⁾ より引用
S-1 : 結腸・直腸癌にはA法、 C法又はD法使用する。 [A法] 朝食後及び夕食後の1日2回、 28日間連日経口投与し、 その後14日間休薬する。 これを1コースとして投与を繰り返す。 [C法] 朝食後及び夕食後の1日2回、 14日間連日経口投与し、 その後7日間休薬する。 これを1コースとして投与を繰り返す。 [D法] 朝食後及び夕食後の1日2回、 14日間連日経口投与し、 その後14日間休薬する。
ティーエスワン®電子添文 (2023年9月改訂 第3版)¹⁾ より引用
前投薬
制吐目的 : パロノセトロン点滴静注バッグ0.75mg50mL+デキサメタゾン注射液3.3mg2A
制吐目的+アレルギー予防 : パロノセトロン点滴静注バッグ0.75mg50mL+デキサメタゾン注射液3.3mg4A+ファモチジン10mg1A+クロルフェニラミン5mg1A
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
投与開始基準
SOFT試験⁶⁾のプロトコル
20~80歳の組織学的に証明された根治切除不能、 進行または再発の大腸癌で以下の条件を満たす患者
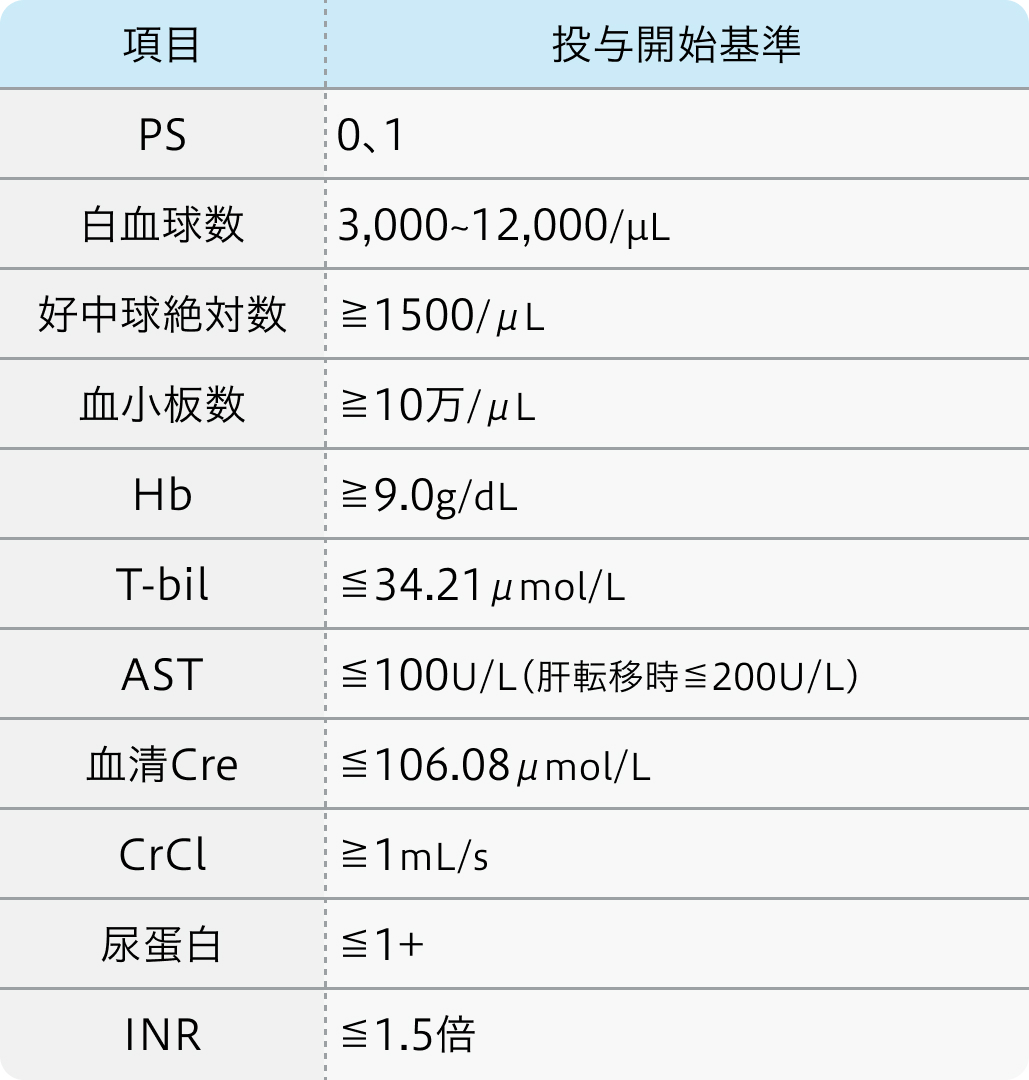
Lancet Oncol. 2013 Dec;14(13):1278-86.⁶⁾により作図
主な有害事象
SOFT試験⁶⁾
主な有害事象 (カッコ内はGrade3~4)
- 血小板減少症 70.0% (3.6%)
- 好中球減少症 59.2% (8.8%)
- 白血球減少症 58.0% (2.4%)
- AST増加 55.2% (4.4%)
- ALT増加 39.2% (4.8%)
- 貧血 39.2% (5.2%)
- 倦怠感 56.0% (2.8%)
- 下痢 53.2% (9.2%)
- 悪心 52.0% (2.0%)
- 口腔粘膜炎 41.2% (1.6%)
- 嘔吐 20.4% (8.0%)
- 発熱 15.2% (0%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 感覚ニューロパチー 91.2% (10.0%)
- 蛋白尿 46.0% (0%)
- 高血圧 26.0% (6.0%)
- 手足症候群 15.6% (0.4%)
- 脱毛症 6.0% (0%)
Lancet Oncol. 2013 Dec;14(13):1278-86.⁶⁾より引用
上手に使うためのワンポイント
- 実臨床ではCIPN評価に、 CTCAEよりも症状の期間を加味されたDEB-NTCを用いてオキサリプラチン中止時期を検討する。 コンバージョンが明らかに困難と思われ、 延命を目的とするような症例では、 QOL低下を考慮して、OPTIMOX1試験⁷⁾に準じたオキサリプラチン計画中止も積極的に検討する。
- オキサリプラチン130mg/m²は、 悪心・嘔吐を訴える症例が多く、 著者はルーチンでNK1受容体阻害薬 (例 : アプレピタント) を投与している。
- 早期にオキサリプラチンによるGrade2以下のアレルギーが生じた症例の場合は、 アレルギー予防⁸⁾を行いながら、 可能な範囲で継続を検討する。
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
特徴と注意点
- 大腸癌治療ガイドラインでは、 1次治療の標準治療の1つである⁹⁾。
- CrCl≦30mL/minの症例にはS-1は禁忌である。
- オキサリプラチンの末梢神経障害は、 長期に渡って遺残することが多い。 また、 中止後の増悪 (コースティング) も見られることから、 導入前に十分に患者に説明し、 適切なタイミングで中止する。
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
関連する臨床試験
SOFT試験⁶⁾
化学療法未施行の切除不能大腸癌を対象とし、 mFOLFOX6+BV療法を対照に、 SOX+BV療法の無増悪生存期間における非劣性を検証するためのオープンラベル非劣性検証無作為化第Ⅲ相試験。 主要評価項目は無増悪生存期間 (PFS)、 副次評価項目は全生存期間 (0S)、 無増悪期間、 有害事象の発現頻度と程度等とされた。
Lancet Oncol. 2013 Dec;14(13):1278-86. ⁶⁾
出典
- 大鵬薬品工業株式会社 . ティーエスワン®電子添文 (2023年9月改訂 第3版) [最終閲覧 : 2024/04/17]
- 大鵬薬品工業株式会社 . ティーエスワン®適正使用ガイド (2023年10月27日 更新) [最終閲覧 : 2024/04/17]
- ヤクルト本社. エルプラット®電子添文 (2024年4月改訂 第4版) [最終閲覧 : 2024/04/17]
- 中外製薬株式会社. アバスチン®電子添文 (2024年3月改訂 第5版) [最終閲覧 : 2024/04/17]
- 中外製薬株式会社. アバスチン®適正使用ガイド (2023年11月改訂) [最終閲覧 : 2024/04/17]
- Leucovorin, fluorouracil, and oxaliplatin plus bevacizumab versus S-1 and oxaliplatin plus bevacizumab in patients with metastatic colorectal cancer (SOFT): an open-label, non-inferiority, randomised phase 3 trial. Lancet Oncol. 2013 Dec;14(13):1278-86. PMID: 24225157
- OPTIMOX1: a randomized study of FOLFOX4 or FOLFOX7 with oxaliplatin in a stop-and-Go fashion in advanced colorectal cancer--a GERCOR study.J Clin Oncol. 2006 Jan 20;24(3):394-400. PMID: 16421419
- A single-arm Phase II validation study of preventing oxaliplatin-induced hypersensitivity reactions by dexamethasone: the AVOID trial. Drug Des Devel Ther. 2015 Nov 11;9:6067-73. PMID: 26648694
- 金原出版株式会社.大腸癌治療ガイドライン医師用2022年版. 大腸癌研究会編.
最終更新日 : 2024年4月17日
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
SOX + Bmab
Bmab:Bevacizumab(アバスチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 7.5mg/kg 点滴 | 1~ | Day1 |
L-OHP:Oxaliplatin(エルプラット®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 130mg/m² 点滴 | 1~ | Day1 |
S-1:Tegafur/Gimeracil/Oteracil(ティーエスワン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 80~120mg/日 経口 (40~60mg/回 朝夕食後) | 1~ | Day1夕~15朝 |
前投薬
| 制吐目的:パロノセトロン点滴静注バッグ0.75mg50mL+デキサメタゾン注射液3.3mg2A |
| 制吐目的+アレルギー予防:パロノセトロン点滴静注バッグ0.75mg50mL+デキサメタゾン注射液3.3mg4A+ファモチジン10mg1A+クロルフェニラミン5mg1A |
その他
| 1コース21日間。 |
| S-1+L-OHPをSOX療法と呼ぶ。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*大鵬薬品工業株式会社の外部サイトへ遷移します
*中外製薬の外部サイトへ遷移します
用法用量
SOFT試験⁶⁾のプロトコル

Lancet Oncol. 2013 Dec;14(13):1278-86.⁶⁾より作図
電子添文の用法および用量
ベバシズマブ : ①他の抗悪性腫瘍剤との併用において、 1回5mg/kgまたは10mg/kgを点滴静脈内注射する。 ②投与間隔は2週間以上とする。 他の抗悪性腫瘍剤との併用において、 1回7.5mg/kgを点滴静脈内注射する。 投与間隔は3週間以上とする。
アバスチン®電子添文 (2024年3月改訂 第5版)⁴⁾より引用
オキサリプラチン : A法またはB法を使用する。 [A法] 他の抗悪性腫瘍剤との併用において、 85mg/m²を1日1回静脈内に2時間で点滴投与し、 少なくとも13日間休薬する。 これを1サイクルとして投与を繰り返す。 [B法] 他の抗悪性腫瘍剤との併用において、 130mg/m²を1日1回静脈内に2時間で点滴投与し、 少なくとも20日間休薬する。 これを1サイクルとして投与を繰り返す。
エルプラット®電子添文 (2024年4月改訂 第4版)³⁾ より引用
S-1 : 結腸・直腸癌にはA法、 C法又はD法使用する。 [A法] 朝食後及び夕食後の1日2回、 28日間連日経口投与し、 その後14日間休薬する。 これを1コースとして投与を繰り返す。 [C法] 朝食後及び夕食後の1日2回、 14日間連日経口投与し、 その後7日間休薬する。 これを1コースとして投与を繰り返す。 [D法] 朝食後及び夕食後の1日2回、 14日間連日経口投与し、 その後14日間休薬する。
ティーエスワン®電子添文 (2023年9月改訂 第3版)¹⁾ より引用
前投薬
制吐目的 : パロノセトロン点滴静注バッグ0.75mg50mL+デキサメタゾン注射液3.3mg2A
制吐目的+アレルギー予防 : パロノセトロン点滴静注バッグ0.75mg50mL+デキサメタゾン注射液3.3mg4A+ファモチジン10mg1A+クロルフェニラミン5mg1A
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
投与開始基準
SOFT試験⁶⁾のプロトコル
20~80歳の組織学的に証明された根治切除不能、 進行または再発の大腸癌で以下の条件を満たす患者

Lancet Oncol. 2013 Dec;14(13):1278-86.⁶⁾により作図
主な有害事象
SOFT試験⁶⁾
主な有害事象 (カッコ内はGrade3~4)
- 血小板減少症 70.0% (3.6%)
- 好中球減少症 59.2% (8.8%)
- 白血球減少症 58.0% (2.4%)
- AST増加 55.2% (4.4%)
- ALT増加 39.2% (4.8%)
- 貧血 39.2% (5.2%)
- 倦怠感 56.0% (2.8%)
- 下痢 53.2% (9.2%)
- 悪心 52.0% (2.0%)
- 口腔粘膜炎 41.2% (1.6%)
- 嘔吐 20.4% (8.0%)
- 発熱 15.2% (0%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 感覚ニューロパチー 91.2% (10.0%)
- 蛋白尿 46.0% (0%)
- 高血圧 26.0% (6.0%)
- 手足症候群 15.6% (0.4%)
- 脱毛症 6.0% (0%)
Lancet Oncol. 2013 Dec;14(13):1278-86.⁶⁾より引用
上手に使うためのワンポイント
- 実臨床ではCIPN評価に、 CTCAEよりも症状の期間を加味されたDEB-NTCを用いてオキサリプラチン中止時期を検討する。 コンバージョンが明らかに困難と思われ、 延命を目的とするような症例では、 QOL低下を考慮して、OPTIMOX1試験⁷⁾に準じたオキサリプラチン計画中止も積極的に検討する。
- オキサリプラチン130mg/m²は、 悪心・嘔吐を訴える症例が多く、 著者はルーチンでNK1受容体阻害薬 (例 : アプレピタント) を投与している。
- 早期にオキサリプラチンによるGrade2以下のアレルギーが生じた症例の場合は、 アレルギー予防⁸⁾を行いながら、 可能な範囲で継続を検討する。
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
特徴と注意点
- 大腸癌治療ガイドラインでは、 1次治療の標準治療の1つである⁹⁾。
- CrCl≦30mL/minの症例にはS-1は禁忌である。
- オキサリプラチンの末梢神経障害は、 長期に渡って遺残することが多い。 また、 中止後の増悪 (コースティング) も見られることから、 導入前に十分に患者に説明し、 適切なタイミングで中止する。
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
関連する臨床試験
SOFT試験⁶⁾
化学療法未施行の切除不能大腸癌を対象とし、 mFOLFOX6+BV療法を対照に、 SOX+BV療法の無増悪生存期間における非劣性を検証するためのオープンラベル非劣性検証無作為化第Ⅲ相試験。 主要評価項目は無増悪生存期間 (PFS)、 副次評価項目は全生存期間 (0S)、 無増悪期間、 有害事象の発現頻度と程度等とされた。
Lancet Oncol. 2013 Dec;14(13):1278-86. ⁶⁾
出典
- 大鵬薬品工業株式会社 . ティーエスワン®電子添文 (2023年9月改訂 第3版) [最終閲覧 : 2024/04/17]
- 大鵬薬品工業株式会社 . ティーエスワン®適正使用ガイド (2023年10月27日 更新) [最終閲覧 : 2024/04/17]
- ヤクルト本社. エルプラット®電子添文 (2024年4月改訂 第4版) [最終閲覧 : 2024/04/17]
- 中外製薬株式会社. アバスチン®電子添文 (2024年3月改訂 第5版) [最終閲覧 : 2024/04/17]
- 中外製薬株式会社. アバスチン®適正使用ガイド (2023年11月改訂) [最終閲覧 : 2024/04/17]
- Leucovorin, fluorouracil, and oxaliplatin plus bevacizumab versus S-1 and oxaliplatin plus bevacizumab in patients with metastatic colorectal cancer (SOFT): an open-label, non-inferiority, randomised phase 3 trial. Lancet Oncol. 2013 Dec;14(13):1278-86. PMID: 24225157
- OPTIMOX1: a randomized study of FOLFOX4 or FOLFOX7 with oxaliplatin in a stop-and-Go fashion in advanced colorectal cancer--a GERCOR study.J Clin Oncol. 2006 Jan 20;24(3):394-400. PMID: 16421419
- A single-arm Phase II validation study of preventing oxaliplatin-induced hypersensitivity reactions by dexamethasone: the AVOID trial. Drug Des Devel Ther. 2015 Nov 11;9:6067-73. PMID: 26648694
- 金原出版株式会社.大腸癌治療ガイドライン医師用2022年版. 大腸癌研究会編.
最終更新日 : 2024年4月17日
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
