本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*中外製薬の外部サイトへ遷移します
*中外製薬の外部サイトへ遷移します
用法用量
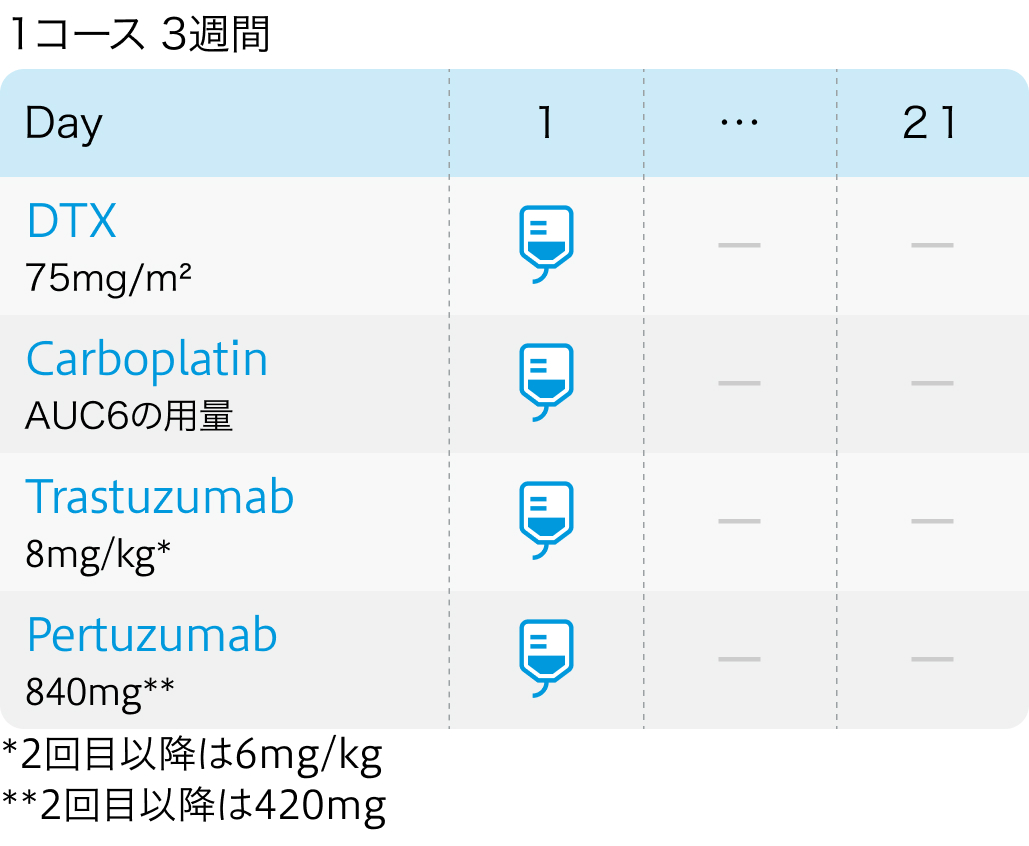
前投薬
中程度催吐性リスクのため、 デキサメタゾン、 5HT3受容体拮抗薬を前投薬で使用
投与開始基準
TRYPHAENA試験¹⁾より抜粋 (HER2+早期乳癌、 術前補助化学療法)
18歳以上で、 HER2+乳癌と診断されたPS0、 1、 LVEF≧55%の患者
KRISTINE試験³⁾より抜粋 (術前補助化学療法)
18歳以上でPS0、 1のHER2+のステージII~IIIの手術可能な乳癌の患者
APHINITY試験³⁾より抜粋 (術後療法)
18歳以上で、 乳房全摘術または乳房温存手術を受けたPS0、 1の患者
減量・中止基準
ペルツズマブ、 トラスツズマブの休薬・中止基準

ドセタキセルの減量・休薬・中止基準

主な有害事象
TRYPHAENA試験¹⁾
有害事象データを一部引用 (カッコ内はGrade3~4)
主な有害事象
- 下痢 72.4% (11.8%)
- 悪心 44.7% (0%)
- 好中球数減少 48.7% (46.1%)
- 嘔吐 39.5% (5.3%)
- 倦怠感 42.1% (3.9%)
- 貧血 36.8% (17.1%)
- 粘膜炎症 17.1% (0%)
- 便秘 15.8% (0%)
- 発熱性好中球減少症 17.1% (17.1%)
- 白血球数減少症 11.8% (11.8%)
- 血小板数減少 11.8% (11.8%)
- ALT増加 3.9% (3.9%)
注意すべき有害事象
- 脱毛症 53.9% (0%)
APHINITY試験³
Grade3以上の有害事象データを一部引用
主な有害事象
- 好中球減少症 16.3%
- 発熱性好中球減少症 12.1%
- 好中球数減少 9.6%
- 下痢 9.8%
- 貧血 6.9%
特徴と注意点
- HER2陽性早期乳癌患者 (再発リスクが高いと判断される患者) の術前または術後化学療法のためのレジメン。
- 3週間ごと、 6コース。
- トラスツズマブは初回投与は90分、 2回目以降は忍容性良好であれば30分まで投与時間の短縮が可能。
- ペルツズマブは初回投与は60分、 2回目以降は忍容性良好であれば30分まで投与時間の短縮が可能。
- ドセタキセルについては溶解剤にアルコールが含まれる、 またはアルコール含有のプレミックス製剤を使用する場合は、 アルコール過敏症の確認が必要である。 必要に応じてアルコール含有しない溶解剤を使用。
- カルボプラチンの投与量算出にはカルバート式を用いる。
- ペルツズマブは前回投与から6週間未満であれば420mg投与。 6週間以上あいた場合、 初回量840mgで投与し以降は420mgで継続する。
- ペルツズマブと併用している場合にトラスツズマブの投与が予定日より遅れた場合は、 前回投与から6週間未満では6mg/kgで投与。 6週間以上あいたときは8mg/kgに再ローディングし以降は6mg/kgで投与する。
- 主な有害事象はInfusion reaction、 下痢、 皮疹、 心機能低下、 浮腫、 骨髄抑制である。
- 投与開始前に心機能検査 (心エコー等) を必ず実施し、 左室駆出率 (LVEF) を含む心機能を確認する。
- Infusion reactionはトラスツズマブ、 ペルツズマブ投与中または投与開始後24時間以内に多く報告されている。
- ドセタキセル総投与量が増えるにつれ浮腫の発現頻度が高くなる。 利尿剤を適宜使用する。また、 浮腫予防として点滴翌日から2日間ステロイドを内服する。
- ドセタキセルの好中球減少は比較的早く、 1週間程度でnadiaとなるため早めの感染予防行動を指導する。
- ドセタキセルは起壊死性抗がん薬のため、 血管外漏出に注意する。
関連する臨床試験①|TRYPHAENA試験¹⁾
HER2陽性の局所進行性、 炎症性または早期乳癌患者の術前療法において、 トラスツズマブ+ペルツズマブ+標準化学療法の併用療法の忍容性を検証した第Ⅱ相ランダム化比較試験TRYPHAENAの結果より、 症候性左室収縮機能障害 (LVSD) の発生率は低く、 併用療法の有効性が示された。
DFS率 (3年時)
- A群 : 87%
(95%CI 79-95%)
- B群 : 88%
(95%CI 80-96%)
- C群 : 90%
(95%CI 82-97%)
PFS率 (3年時)
- A群 : 89%
(95%CI 81-96%)
- B群 : 89%
(95%CI 81-96%)
- C群 : 87%
(95%CI 80-95%)
OS率 (3年時)
- A群 : 94%
(95%CI 89-100%)
- B群 : 94%
(95%CI 89-100%)
- C群 : 93%
(95%CI 87-99%)
病理学的完全奏効 (tpCR)
- 術後、 tpCRに関する評価を受けた患者208例のうち、 128例がtpCRを達成し、 80例は達成しなかった。
- tpCRを達成した患者は、 3年後に無病である可能性が高かった。
HR 0.27 (95%CI 0.11-0.64)
bpCR率
ホルモン受容体陽性患者に比べてホルモン受容体陰性患者で高かった。
- A群 : 61.6%
- B群 : 57.3%
- C群 : 66.2%
ORR
- A群 : 91.8%
- B群 : 94.7%
- C群 : 89.6%
CRを達成した患者の割合
- A群 : 50.7%
- B群 : 28.0%
- C群 : 40.3%
治療前に乳房切除が計画された患者の乳房温存手術の実施率
- A群 21.7% (事前に乳房切除が計画 : 46例)
- B群 16.7% (事前に乳房切除が計画 : 36例)
- C群 27.0% (事前に乳房切除が計画 : 37例)
関連する臨床試験②|APHINITY試験³⁾
根治手術を受け、 組織学的に浸潤性HER2陽性と確認された乳癌患者において、 術後療法におけるペルツズマブ+トラスツズマブ+化学療法の効果を、 プラセボ+トラスツズマブ+化学療法を対照に検証した第Ⅲ相二重盲検無作為化比較試験APHINITYの結果より、 浸潤性疾患のない生存期間 (IDFS) に対する有効性が示された。
IDFS (6年時イベント数)
- ペルツズマブ群:221例 (9.2%)
- プラセボ群:287例 (11.9%)
HR 0.76 (95%CI 0.64-0.91)
初回IDFSイベントの大半は遠隔再発であり、 ペルツズマブ群 (5.9%) ではプラセボ群 (7.7%) よりも遠隔再発が少なかった。
IDFS率 (3年時、 6年時)
- ペルツズマブ群:94.1%、 91.0%
- プラセボ群:93.2%、 88.0%
IDFS率 (6年時) のサブグループ解析
リンパ節転移陽性患者
- ペルツズマブ群:88.0%
- プラセボ群:83.0%
リンパ節転移陰性患者
- ペルツズマブ群:95.0%
- プラセボ群:95.0%
乳癌以外の続発性原発癌をイベントとして含むIDFS率 (3年時)
- ペルツズマブ群:93.5%
(95%CI 92.5-94.5%)
- プラセボ群:92.5%
(95%CI 91.4-93.6%)
HR 0.82 (95%CI 0.68-0.99)、 p=0.043
OS (6年時イベント数)
- ペルツズマブ群:125例 (5.2%)
- プラセボ群:147例 (6.1%)
HR 0.85 (95%CI 0.67-1.07)、 p=0.17
OS率 (6年時)
- ペルツズマブ群:95.0%
- プラセボ群:94.0%
RFS率 (3年時)
- ペルツズマブ群:95.2%
- プラセボ群:94.3%
HR 0.79 (95%CI 0.63-0.99)、 p=0.043
DRFS率 (3年時)
- ペルツズマブ群:95.7%
- プラセボ群:95.1%
HR 0.82 (95%CI 0.64-1.04)、p=0.101
参考文献
- Pertuzumab plus trastuzumab in combination with standard neoadjuvant anthracycline-containing and anthracycline-free chemotherapy regimens in patients with HER2-positive early breast cancer: a randomized phase II cardiac safety study (TRYPHAENA). Ann Oncol. 2013 Sep;24(9):2278-84. PMID: 23704196
- Neoadjuvant trastuzumab, pertuzumab, and chemotherapy versus trastuzumab emtansine plus pertuzumab in patients with HER2-positive breast cancer (KRISTINE): a randomised, open-label, multicentre, phase 3 trial. Lancet Oncol. 2018 Jan;19(1):115-126. PMID: 29175149
- Adjuvant Pertuzumab and Trastuzumab in Early HER2-Positive Breast Cancer. N Engl J Med. 2017 Jul 13;377(2):122-131. PMID: 28581356
最終更新日:2024年3月25日
監修医師:HOKUTO編集部監修医師
執筆:公益財団法人 がん研究会 がん研有明病院 薬剤部 平岡 知子先生
Docetaxel+Carboplatin+Trastuzumab+Pertuzumab (TCbHP)
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*中外製薬の外部サイトへ遷移します
*中外製薬の外部サイトへ遷移します
用法用量

前投薬
中程度催吐性リスクのため、 デキサメタゾン、 5HT3受容体拮抗薬を前投薬で使用
投与開始基準
TRYPHAENA試験¹⁾より抜粋 (HER2+早期乳癌、 術前補助化学療法)
18歳以上で、 HER2+乳癌と診断されたPS0、 1、 LVEF≧55%の患者
KRISTINE試験³⁾より抜粋 (術前補助化学療法)
18歳以上でPS0、 1のHER2+のステージII~IIIの手術可能な乳癌の患者
APHINITY試験³⁾より抜粋 (術後療法)
18歳以上で、 乳房全摘術または乳房温存手術を受けたPS0、 1の患者
減量・中止基準
ペルツズマブ、 トラスツズマブの休薬・中止基準

ドセタキセルの減量・休薬・中止基準

主な有害事象
TRYPHAENA試験¹⁾
有害事象データを一部引用 (カッコ内はGrade3~4)
主な有害事象
- 下痢 72.4% (11.8%)
- 悪心 44.7% (0%)
- 好中球数減少 48.7% (46.1%)
- 嘔吐 39.5% (5.3%)
- 倦怠感 42.1% (3.9%)
- 貧血 36.8% (17.1%)
- 粘膜炎症 17.1% (0%)
- 便秘 15.8% (0%)
- 発熱性好中球減少症 17.1% (17.1%)
- 白血球数減少症 11.8% (11.8%)
- 血小板数減少 11.8% (11.8%)
- ALT増加 3.9% (3.9%)
注意すべき有害事象
- 脱毛症 53.9% (0%)
APHINITY試験³
Grade3以上の有害事象データを一部引用
主な有害事象
- 好中球減少症 16.3%
- 発熱性好中球減少症 12.1%
- 好中球数減少 9.6%
- 下痢 9.8%
- 貧血 6.9%
特徴と注意点
- HER2陽性早期乳癌患者 (再発リスクが高いと判断される患者) の術前または術後化学療法のためのレジメン。
- 3週間ごと、 6コース。
- トラスツズマブは初回投与は90分、 2回目以降は忍容性良好であれば30分まで投与時間の短縮が可能。
- ペルツズマブは初回投与は60分、 2回目以降は忍容性良好であれば30分まで投与時間の短縮が可能。
- ドセタキセルについては溶解剤にアルコールが含まれる、 またはアルコール含有のプレミックス製剤を使用する場合は、 アルコール過敏症の確認が必要である。 必要に応じてアルコール含有しない溶解剤を使用。
- カルボプラチンの投与量算出にはカルバート式を用いる。
- ペルツズマブは前回投与から6週間未満であれば420mg投与。 6週間以上あいた場合、 初回量840mgで投与し以降は420mgで継続する。
- ペルツズマブと併用している場合にトラスツズマブの投与が予定日より遅れた場合は、 前回投与から6週間未満では6mg/kgで投与。 6週間以上あいたときは8mg/kgに再ローディングし以降は6mg/kgで投与する。
- 主な有害事象はInfusion reaction、 下痢、 皮疹、 心機能低下、 浮腫、 骨髄抑制である。
- 投与開始前に心機能検査 (心エコー等) を必ず実施し、 左室駆出率 (LVEF) を含む心機能を確認する。
- Infusion reactionはトラスツズマブ、 ペルツズマブ投与中または投与開始後24時間以内に多く報告されている。
- ドセタキセル総投与量が増えるにつれ浮腫の発現頻度が高くなる。 利尿剤を適宜使用する。また、 浮腫予防として点滴翌日から2日間ステロイドを内服する。
- ドセタキセルの好中球減少は比較的早く、 1週間程度でnadiaとなるため早めの感染予防行動を指導する。
- ドセタキセルは起壊死性抗がん薬のため、 血管外漏出に注意する。
関連する臨床試験①|TRYPHAENA試験¹⁾
HER2陽性の局所進行性、 炎症性または早期乳癌患者の術前療法において、 トラスツズマブ+ペルツズマブ+標準化学療法の併用療法の忍容性を検証した第Ⅱ相ランダム化比較試験TRYPHAENAの結果より、 症候性左室収縮機能障害 (LVSD) の発生率は低く、 併用療法の有効性が示された。
DFS率 (3年時)
- A群 : 87%
(95%CI 79-95%)
- B群 : 88%
(95%CI 80-96%)
- C群 : 90%
(95%CI 82-97%)
PFS率 (3年時)
- A群 : 89%
(95%CI 81-96%)
- B群 : 89%
(95%CI 81-96%)
- C群 : 87%
(95%CI 80-95%)
OS率 (3年時)
- A群 : 94%
(95%CI 89-100%)
- B群 : 94%
(95%CI 89-100%)
- C群 : 93%
(95%CI 87-99%)
病理学的完全奏効 (tpCR)
- 術後、 tpCRに関する評価を受けた患者208例のうち、 128例がtpCRを達成し、 80例は達成しなかった。
- tpCRを達成した患者は、 3年後に無病である可能性が高かった。
HR 0.27 (95%CI 0.11-0.64)
bpCR率
ホルモン受容体陽性患者に比べてホルモン受容体陰性患者で高かった。
- A群 : 61.6%
- B群 : 57.3%
- C群 : 66.2%
ORR
- A群 : 91.8%
- B群 : 94.7%
- C群 : 89.6%
CRを達成した患者の割合
- A群 : 50.7%
- B群 : 28.0%
- C群 : 40.3%
治療前に乳房切除が計画された患者の乳房温存手術の実施率
- A群 21.7% (事前に乳房切除が計画 : 46例)
- B群 16.7% (事前に乳房切除が計画 : 36例)
- C群 27.0% (事前に乳房切除が計画 : 37例)
関連する臨床試験②|APHINITY試験³⁾
根治手術を受け、 組織学的に浸潤性HER2陽性と確認された乳癌患者において、 術後療法におけるペルツズマブ+トラスツズマブ+化学療法の効果を、 プラセボ+トラスツズマブ+化学療法を対照に検証した第Ⅲ相二重盲検無作為化比較試験APHINITYの結果より、 浸潤性疾患のない生存期間 (IDFS) に対する有効性が示された。
IDFS (6年時イベント数)
- ペルツズマブ群:221例 (9.2%)
- プラセボ群:287例 (11.9%)
HR 0.76 (95%CI 0.64-0.91)
初回IDFSイベントの大半は遠隔再発であり、 ペルツズマブ群 (5.9%) ではプラセボ群 (7.7%) よりも遠隔再発が少なかった。
IDFS率 (3年時、 6年時)
- ペルツズマブ群:94.1%、 91.0%
- プラセボ群:93.2%、 88.0%
IDFS率 (6年時) のサブグループ解析
リンパ節転移陽性患者
- ペルツズマブ群:88.0%
- プラセボ群:83.0%
リンパ節転移陰性患者
- ペルツズマブ群:95.0%
- プラセボ群:95.0%
乳癌以外の続発性原発癌をイベントとして含むIDFS率 (3年時)
- ペルツズマブ群:93.5%
(95%CI 92.5-94.5%)
- プラセボ群:92.5%
(95%CI 91.4-93.6%)
HR 0.82 (95%CI 0.68-0.99)、 p=0.043
OS (6年時イベント数)
- ペルツズマブ群:125例 (5.2%)
- プラセボ群:147例 (6.1%)
HR 0.85 (95%CI 0.67-1.07)、 p=0.17
OS率 (6年時)
- ペルツズマブ群:95.0%
- プラセボ群:94.0%
RFS率 (3年時)
- ペルツズマブ群:95.2%
- プラセボ群:94.3%
HR 0.79 (95%CI 0.63-0.99)、 p=0.043
DRFS率 (3年時)
- ペルツズマブ群:95.7%
- プラセボ群:95.1%
HR 0.82 (95%CI 0.64-1.04)、p=0.101
参考文献
- Pertuzumab plus trastuzumab in combination with standard neoadjuvant anthracycline-containing and anthracycline-free chemotherapy regimens in patients with HER2-positive early breast cancer: a randomized phase II cardiac safety study (TRYPHAENA). Ann Oncol. 2013 Sep;24(9):2278-84. PMID: 23704196
- Neoadjuvant trastuzumab, pertuzumab, and chemotherapy versus trastuzumab emtansine plus pertuzumab in patients with HER2-positive breast cancer (KRISTINE): a randomised, open-label, multicentre, phase 3 trial. Lancet Oncol. 2018 Jan;19(1):115-126. PMID: 29175149
- Adjuvant Pertuzumab and Trastuzumab in Early HER2-Positive Breast Cancer. N Engl J Med. 2017 Jul 13;377(2):122-131. PMID: 28581356
最終更新日:2024年3月25日
監修医師:HOKUTO編集部監修医師
執筆:公益財団法人 がん研究会 がん研有明病院 薬剤部 平岡 知子先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。