治療スケジュール
概要
監修医師
Lenvatinib:Lenvatinib(レンビマ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| ≧60kg 12mg/日 分1経口 | 連日服用 | Day1~ |
| <60kg 8mg/日 分1経口 | 連日服用 | Day1~ |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*MSD株式会社の外部サイトへ遷移します
用法用量
REFLECT試験¹⁾のプロトコル

Lancet. 2018 Mar 24;391(10126):1163-1173.より作図
電子添文²⁾の用法および用量
体重にあわせて体重60kg以上の場合は12mg、 体重60kg未満の場合は8mgを1日1回、 経口投与する。
レンビマ®電子添文 (2024年2月改訂 第5版) より引用
投与開始基準
REFLECT試験¹⁾のプロトコル
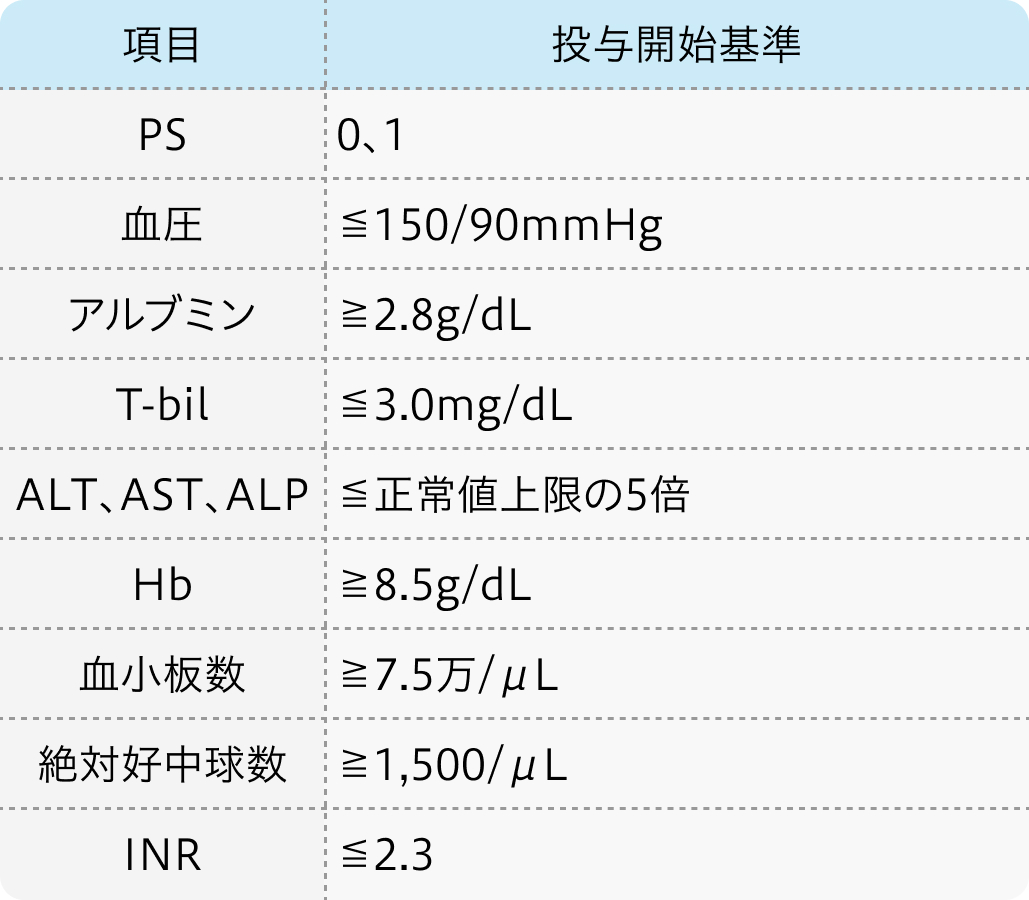
Lancet. 2018 Mar 24;391(10126):1163-1173.より作図
減量・休薬・中止基準
電子添文²⁾の減量・休薬・中止基準

レンビマ®電子添文 (2024年2月改訂 第5版) より作図
初回基準量と減量レベル
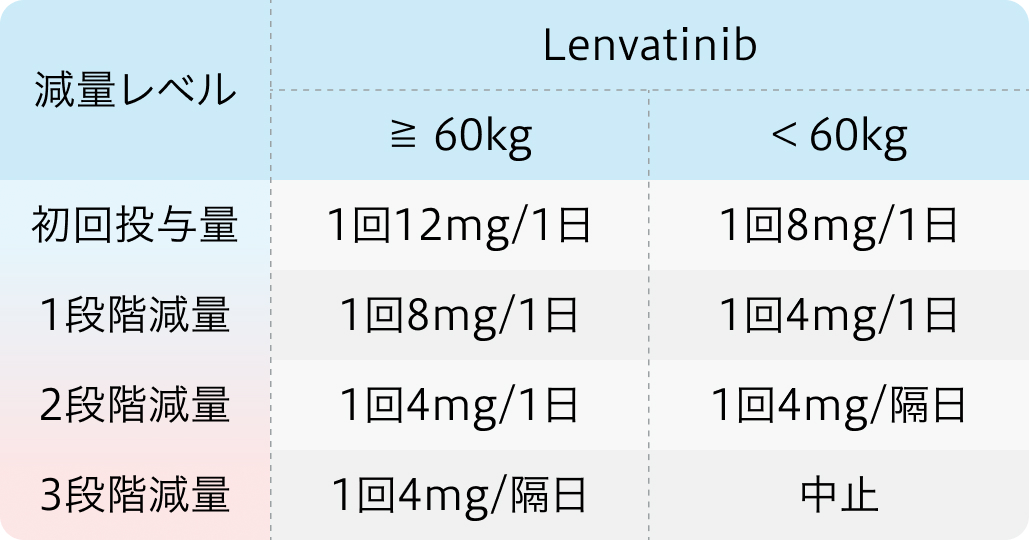
レンビマ®電子添文 (2024年2月改訂 第5版) より作図
主な有害事象
REFLECT試験¹⁾
主な有害事象 (カッコ内はGrade3~4)
- 血小板数減少 28.4% (7.4%)
- 高血圧 49.4% (32.1%)
- 食欲減退 48.1% (7.4%)
- 下痢 37.0% (3.7%)
- 体重減少 19.8% (4.9%)
- 疲労 14.8% (0%)
- 悪心 14.8% (0%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 手掌・足底発赤知覚不全症候群 51.9% (7.4%)
- 蛋白尿 45.7% (8.6%)
レンビマ®適正使用ガイド (2024年2月作成)より引用
上手に使うためのワンポイント
執筆医 : 愛媛県立中央病院 消化器内科主任部長 平岡 淳先生
- REFLECT試験¹⁾のレンバチニブに割り付けられた日本人集団の注意が必要な副作用として高血圧、 蛋白尿、 食欲減退、 疲労、 甲状腺機能低下症などが報告されている。
- 特に高齢者の多い本邦の肝細胞癌患者において食欲減退はQOLの低下だけではなく、 治療中断・中止に直結するため適切な休薬減量介入を要する。
- レンバチニブは休薬基準が尿蛋白3.5g/日とされる。 一方で他レジメンによる逐次治療を考慮する際、 他レジメンは休薬基準が尿蛋白2.0g/日となっていることに注意が必要である。
特徴と注意点
- 本レジメンは免疫療法登場以前に切除不能肝細胞癌に対する一次治療としてREFLECT試験¹⁾でソラフェニブに対する非劣性を証明して承認された。
- 肝予備能がChild-Pugh分類Aの症例に対して使用が推奨されており、 それ以外の肝予備能の症例に対しては有効性・安全性が確立していない。 体重別 (60kg) に用量が設定されている。
- ソラフェニブと異なり手足症候群が少ないものの、 食欲不振、 全身倦怠感が見られやすい。
- 現在の肝癌診療ガイドラインでは複合免疫療法の適応がない症例に対する一次治療と位置づけられており、 複合免疫療法後の症例においてはエビデンスはないが二次治療以降に使用する薬剤とされている。
執筆医 : 愛媛県立中央病院 消化器内科主任部長 平岡 淳先生
関連する臨床試験|REFLECT試験¹⁾
全身化学療法歴のない切除不能な肝細胞癌患者において、 レンバチニブの効果を、 ソラフェニブを対照に検証した第Ⅲ相ランダム化比較試験REFLECTの結果より、 全生存期間 (OS) における非劣性が示された。
OS中央値
- レンバチニブ群 : 13.6ヵ月
(95%CI 12.1-14.9ヵ月)
- ソラフェニブ群 : 12.3ヵ月
(95%CI 10.4-13.9ヵ月)
HR 0.92 (95%CI 0.79-1.06)
OSのサブグループ解析
ベースラインのAFP<200ng/mLの患者は、 両治療群ともAFP≧200ng/mLの患者よりもOSが長かった。
PFS中央値
- レンバチニブ群 : 7.4ヵ月
(95%CI 6.9–8.8ヵ月)
- ソラフェニブ群 : 3.7ヵ月
(95%CI 3.6–4.6ヵ月)
HR 0.66 (95%CI 0.57-0.77)、 p<0.0001
TTP中央値
- レンバチニブ群 : 8.9ヵ月
(95%CI 7.4-9.2ヵ月)
- ソラフェニブ群 : 3.7ヵ月
(95%CI 3.6-5.4ヵ月)
HR 0.63 (95%CI 0.53-0.73)、 p<0.0001
ORR
- レンバチニブ群 : 24.1%
(95%CI 20.2–27.9%)
- ソラフェニブ群 : 9.2%
(95%CI 6.6–11.8%)
オッズ比 3.13 (95%CI 2.15-4.56)、 p<0.0001
QOL
- EORTC QLQ-C30およびEORTC QLQ-HCC18健康質問票のベースラインスコアは両群で同程度であった。
- 治療後、 スコアは両群で低下し、 サマリースコアは治療群間で有意差はなかった。
HR 0.87 (95%CI 0.754-1.013)
出典
- Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial. Lancet. 2018 Mar 24;391(10126):1163-1173. PMID: 29433850
- MSD株式会社. レンビマ®電子添文 (2024年2月改訂 第5版) [最終閲覧 : 2024/04/09]
- MSD株式会社. レンビマ®適正使用ガイド (2024年2月作成) [最終閲覧 : 2024/04/09]
最終更新日 : 2024年4月9日
執筆医 : 愛媛県立中央病院 消化器内科主任部長 平岡 淳先生
監修医 : 神奈川県立がんセンター 消化器内科 上野 誠先生
Lenvatinib
レンバチニブ (レンビマ®)
2024年04月24日更新
Lenvatinib:Lenvatinib(レンビマ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| ≧60kg 12mg/日 分1経口 | 連日服用 | Day1~ |
| <60kg 8mg/日 分1経口 | 連日服用 | Day1~ |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*MSD株式会社の外部サイトへ遷移します
用法用量
REFLECT試験¹⁾のプロトコル

Lancet. 2018 Mar 24;391(10126):1163-1173.より作図
電子添文²⁾の用法および用量
体重にあわせて体重60kg以上の場合は12mg、 体重60kg未満の場合は8mgを1日1回、 経口投与する。
レンビマ®電子添文 (2024年2月改訂 第5版) より引用
投与開始基準
REFLECT試験¹⁾のプロトコル

Lancet. 2018 Mar 24;391(10126):1163-1173.より作図
減量・休薬・中止基準
電子添文²⁾の減量・休薬・中止基準

レンビマ®電子添文 (2024年2月改訂 第5版) より作図
初回基準量と減量レベル

レンビマ®電子添文 (2024年2月改訂 第5版) より作図
主な有害事象
REFLECT試験¹⁾
主な有害事象 (カッコ内はGrade3~4)
- 血小板数減少 28.4% (7.4%)
- 高血圧 49.4% (32.1%)
- 食欲減退 48.1% (7.4%)
- 下痢 37.0% (3.7%)
- 体重減少 19.8% (4.9%)
- 疲労 14.8% (0%)
- 悪心 14.8% (0%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 手掌・足底発赤知覚不全症候群 51.9% (7.4%)
- 蛋白尿 45.7% (8.6%)
レンビマ®適正使用ガイド (2024年2月作成)より引用
上手に使うためのワンポイント
執筆医 : 愛媛県立中央病院 消化器内科主任部長 平岡 淳先生
- REFLECT試験¹⁾のレンバチニブに割り付けられた日本人集団の注意が必要な副作用として高血圧、 蛋白尿、 食欲減退、 疲労、 甲状腺機能低下症などが報告されている。
- 特に高齢者の多い本邦の肝細胞癌患者において食欲減退はQOLの低下だけではなく、 治療中断・中止に直結するため適切な休薬減量介入を要する。
- レンバチニブは休薬基準が尿蛋白3.5g/日とされる。 一方で他レジメンによる逐次治療を考慮する際、 他レジメンは休薬基準が尿蛋白2.0g/日となっていることに注意が必要である。
特徴と注意点
- 本レジメンは免疫療法登場以前に切除不能肝細胞癌に対する一次治療としてREFLECT試験¹⁾でソラフェニブに対する非劣性を証明して承認された。
- 肝予備能がChild-Pugh分類Aの症例に対して使用が推奨されており、 それ以外の肝予備能の症例に対しては有効性・安全性が確立していない。 体重別 (60kg) に用量が設定されている。
- ソラフェニブと異なり手足症候群が少ないものの、 食欲不振、 全身倦怠感が見られやすい。
- 現在の肝癌診療ガイドラインでは複合免疫療法の適応がない症例に対する一次治療と位置づけられており、 複合免疫療法後の症例においてはエビデンスはないが二次治療以降に使用する薬剤とされている。
執筆医 : 愛媛県立中央病院 消化器内科主任部長 平岡 淳先生
関連する臨床試験|REFLECT試験¹⁾
全身化学療法歴のない切除不能な肝細胞癌患者において、 レンバチニブの効果を、 ソラフェニブを対照に検証した第Ⅲ相ランダム化比較試験REFLECTの結果より、 全生存期間 (OS) における非劣性が示された。
OS中央値
- レンバチニブ群 : 13.6ヵ月
(95%CI 12.1-14.9ヵ月)
- ソラフェニブ群 : 12.3ヵ月
(95%CI 10.4-13.9ヵ月)
HR 0.92 (95%CI 0.79-1.06)
OSのサブグループ解析
ベースラインのAFP<200ng/mLの患者は、 両治療群ともAFP≧200ng/mLの患者よりもOSが長かった。
PFS中央値
- レンバチニブ群 : 7.4ヵ月
(95%CI 6.9–8.8ヵ月)
- ソラフェニブ群 : 3.7ヵ月
(95%CI 3.6–4.6ヵ月)
HR 0.66 (95%CI 0.57-0.77)、 p<0.0001
TTP中央値
- レンバチニブ群 : 8.9ヵ月
(95%CI 7.4-9.2ヵ月)
- ソラフェニブ群 : 3.7ヵ月
(95%CI 3.6-5.4ヵ月)
HR 0.63 (95%CI 0.53-0.73)、 p<0.0001
ORR
- レンバチニブ群 : 24.1%
(95%CI 20.2–27.9%)
- ソラフェニブ群 : 9.2%
(95%CI 6.6–11.8%)
オッズ比 3.13 (95%CI 2.15-4.56)、 p<0.0001
QOL
- EORTC QLQ-C30およびEORTC QLQ-HCC18健康質問票のベースラインスコアは両群で同程度であった。
- 治療後、 スコアは両群で低下し、 サマリースコアは治療群間で有意差はなかった。
HR 0.87 (95%CI 0.754-1.013)
出典
- Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial. Lancet. 2018 Mar 24;391(10126):1163-1173. PMID: 29433850
- MSD株式会社. レンビマ®電子添文 (2024年2月改訂 第5版) [最終閲覧 : 2024/04/09]
- MSD株式会社. レンビマ®適正使用ガイド (2024年2月作成) [最終閲覧 : 2024/04/09]
最終更新日 : 2024年4月9日
執筆医 : 愛媛県立中央病院 消化器内科主任部長 平岡 淳先生
監修医 : 神奈川県立がんセンター 消化器内科 上野 誠先生
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(消化器)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
