本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
NTRKチロシンキナーゼ阻害薬 ラロトレクチニブ
*バイエル薬品株式会社の外部サイトへ遷移します
投与スケジュール
電子添文¹⁾の用法および用量
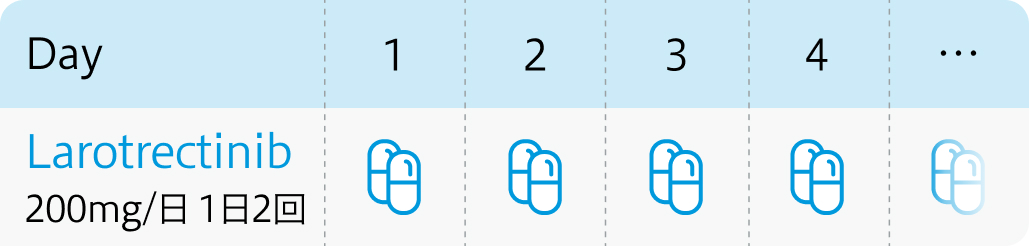
成人は100mg/回、小児は100mg/m²/回を1日2回経口投与 (100mg/回を超えないこと)
ヴァイトラックビ®電子添文 (2024年4月改訂 第9版)¹⁾より作図
特徴と注意点
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
NTRK融合遺伝子陽性大腸癌について
全大腸癌の0.2%であり、 NTRK阻害薬の対象となる症例のスクリーニングが重要である。
大腸癌において、 NTRK融合遺伝子陽性例は、 MSS (0–23.1%) よりもMSI-H (11–76.9%) に多いことが報告されており³⁾⁴⁾、 特にMSI-H例ではがん遺伝子プロファイル検査を検討する。
ガイドラインの記載
大腸癌治療ガイドラインで、EntrectinibとLarotrectinibは、 NTRK融合遺伝子陽性大腸癌既治療例の標準治療である⁵⁾。
コンパニオン診断薬
ENTRはFoundationOneCDx®およびFounadtionOneLiquidCDx®、 LAROは、 FoundationOneCDx®のみとなっている。
EntrectinibとLarotrectinibの比較
稀少な対象であり、 両薬剤の有効性の差について検討した報告はない。 Larotrectinibはカプセルと液剤の剤型がある。
各プロトコル
投与開始基準
NAVIGATE試験³⁾のプロトコル

J Natl Cancer Inst. 2017 Dec 1;109(12)³⁾より作図
減量・休薬・中止基準
電子添文¹⁾の基準
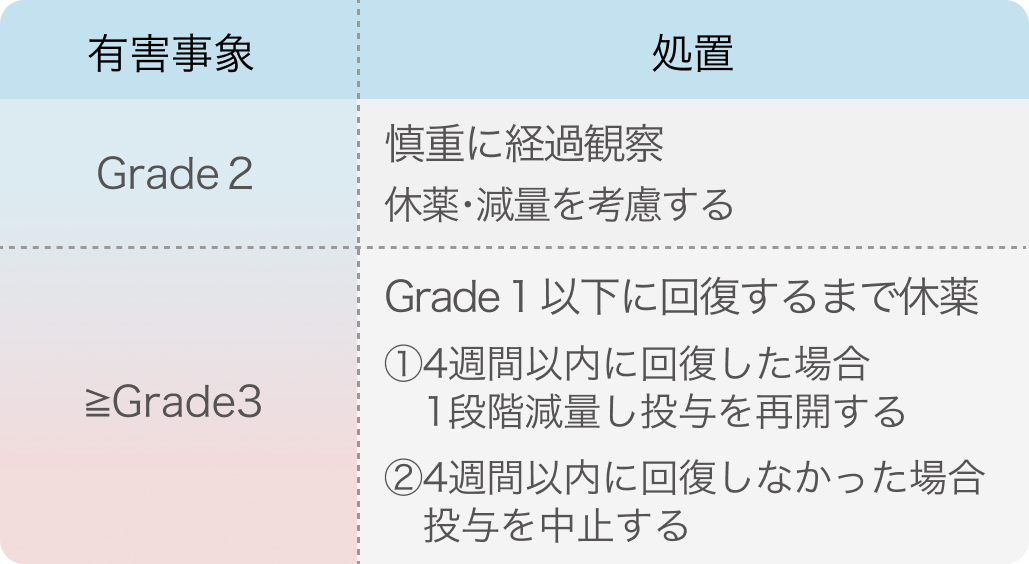
ヴァイトラックビ®電子添文 (2024年4月改訂 第9版)¹⁾より作図
初回基準量と減量レベル
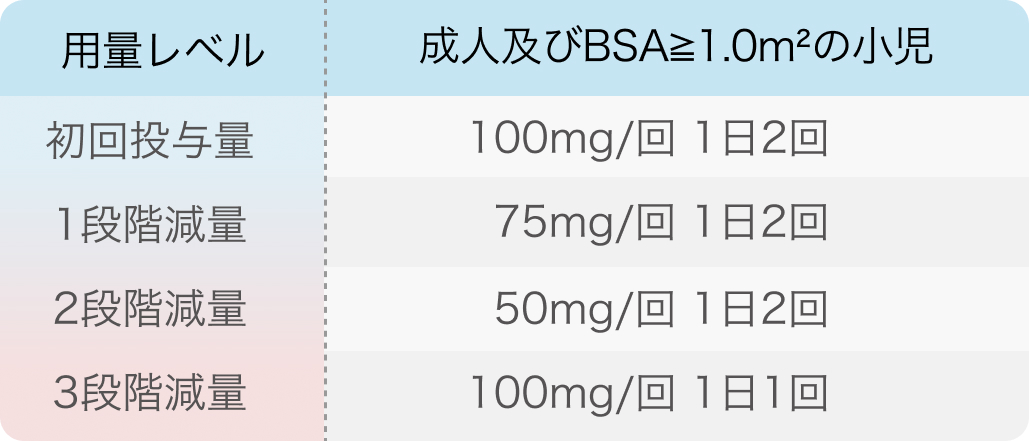
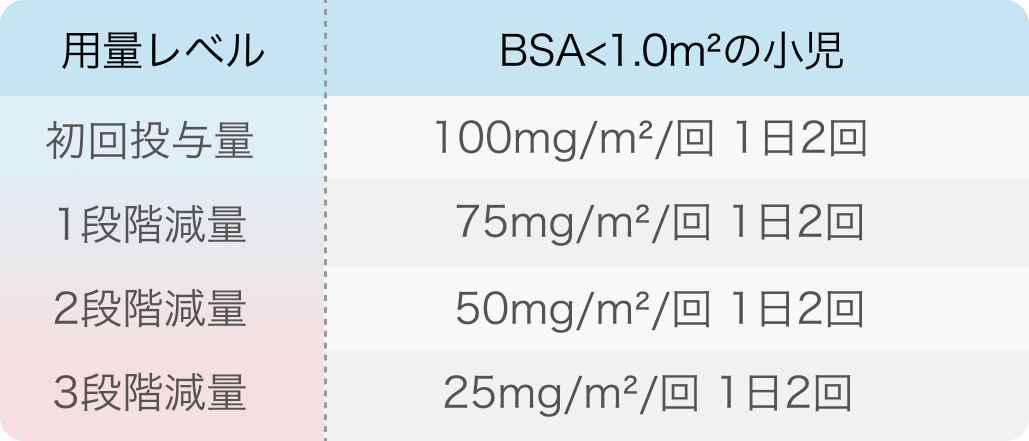
3段階を超えたら投与中止。 また、 3段階減量により25mg/m²/回を1日2回経口投与している小児は、BSAが1.0m²を超えた場合でもこの投与量で継続する。
ヴァイトラックビ®添付文書 (2024年04月改訂第9版)¹⁾より引用
KeyData|臨床試験結果
NAVIGATE試験³⁾
J Natl Cancer Inst. 2017 Dec 1;109(12).
12歳以上のNTRK融合遺伝子陽性の進行・再発の固形癌患者116例を対象に、 ラロトレクチニブの有効性および安全性の評価を目的とした多施設共同、 非盲検、 非対照、 第Ⅱ相試験 (バスケット試験)。
主な有害事象
- 浮動性めまい 27.6% (0%)
- ALT増加 26.7% (4.3%)
- ALT増加 23.3% (1.7%)
- 疲労 19.0% (0%)
- 体重増加 12.1% (0%)
- 筋肉痛 11.2% (0.9%)
- 悪心 10.3% (0.9%)
- 便秘 10.3% (0%)
- 末梢性浮腫 8.6% (0%)
- 関節痛 6.9% (0.9%)
- 頭痛 6.0% (0.9%)
- 味覚異常 6.0% (0%)
- 下痢 6.0% (0%)
- 嘔吐 6.0% (0%)
- 白血球数減少 6.0% (0%)
- 貧血 5.2% (1.7%)
- 筋痙縮 5.2% (0%)
ヴァイトラックビ®適正使用ガイド (2022年5月改訂)²⁾より引用
出典
- バイエル薬品株式会社. ヴァイトラックビ®電子添文 (2024年4月改訂 第9版) [最終閲覧 : 2024/12/6]
- バイエル薬品株式会社. ヴァイトラックビ®適正使用ガイド (2022年5月改訂) [最終閲覧 : 2024/12/6]
- ALK, ROS1, and NTRK Rearrangements in Metastatic Colorectal Cancer. J Natl Cancer Inst. 2017 Dec 1;109(12). PMID: 29370427
- Clinical Sequencing Defines the Genomic Landscape of Metastatic Colorectal Cancer. Cancer Cell. 2018 Jan 8;33(1):125-136.e3. PMID: 29316426
- 金原出版株式会社. 大腸癌治療ガイドライン医師用2024年版. 大腸癌研究会編
最終更新日 : 2024年12月6日
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
Larotrectinib
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
NTRKチロシンキナーゼ阻害薬 ラロトレクチニブ
*バイエル薬品株式会社の外部サイトへ遷移します
投与スケジュール
電子添文¹⁾の用法および用量

成人は100mg/回、小児は100mg/m²/回を1日2回経口投与 (100mg/回を超えないこと)
ヴァイトラックビ®電子添文 (2024年4月改訂 第9版)¹⁾より作図
特徴と注意点
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
NTRK融合遺伝子陽性大腸癌について
全大腸癌の0.2%であり、 NTRK阻害薬の対象となる症例のスクリーニングが重要である。
大腸癌において、 NTRK融合遺伝子陽性例は、 MSS (0–23.1%) よりもMSI-H (11–76.9%) に多いことが報告されており³⁾⁴⁾、 特にMSI-H例ではがん遺伝子プロファイル検査を検討する。
ガイドラインの記載
大腸癌治療ガイドラインで、EntrectinibとLarotrectinibは、 NTRK融合遺伝子陽性大腸癌既治療例の標準治療である⁵⁾。
コンパニオン診断薬
ENTRはFoundationOneCDx®およびFounadtionOneLiquidCDx®、 LAROは、 FoundationOneCDx®のみとなっている。
EntrectinibとLarotrectinibの比較
稀少な対象であり、 両薬剤の有効性の差について検討した報告はない。 Larotrectinibはカプセルと液剤の剤型がある。
各プロトコル
投与開始基準
NAVIGATE試験³⁾のプロトコル

J Natl Cancer Inst. 2017 Dec 1;109(12)³⁾より作図
減量・休薬・中止基準
電子添文¹⁾の基準

ヴァイトラックビ®電子添文 (2024年4月改訂 第9版)¹⁾より作図
初回基準量と減量レベル


3段階を超えたら投与中止。 また、 3段階減量により25mg/m²/回を1日2回経口投与している小児は、BSAが1.0m²を超えた場合でもこの投与量で継続する。
ヴァイトラックビ®添付文書 (2024年04月改訂第9版)¹⁾より引用
KeyData|臨床試験結果
NAVIGATE試験³⁾
J Natl Cancer Inst. 2017 Dec 1;109(12).
12歳以上のNTRK融合遺伝子陽性の進行・再発の固形癌患者116例を対象に、 ラロトレクチニブの有効性および安全性の評価を目的とした多施設共同、 非盲検、 非対照、 第Ⅱ相試験 (バスケット試験)。
主な有害事象
- 浮動性めまい 27.6% (0%)
- ALT増加 26.7% (4.3%)
- ALT増加 23.3% (1.7%)
- 疲労 19.0% (0%)
- 体重増加 12.1% (0%)
- 筋肉痛 11.2% (0.9%)
- 悪心 10.3% (0.9%)
- 便秘 10.3% (0%)
- 末梢性浮腫 8.6% (0%)
- 関節痛 6.9% (0.9%)
- 頭痛 6.0% (0.9%)
- 味覚異常 6.0% (0%)
- 下痢 6.0% (0%)
- 嘔吐 6.0% (0%)
- 白血球数減少 6.0% (0%)
- 貧血 5.2% (1.7%)
- 筋痙縮 5.2% (0%)
ヴァイトラックビ®適正使用ガイド (2022年5月改訂)²⁾より引用
出典
- バイエル薬品株式会社. ヴァイトラックビ®電子添文 (2024年4月改訂 第9版) [最終閲覧 : 2024/12/6]
- バイエル薬品株式会社. ヴァイトラックビ®適正使用ガイド (2022年5月改訂) [最終閲覧 : 2024/12/6]
- ALK, ROS1, and NTRK Rearrangements in Metastatic Colorectal Cancer. J Natl Cancer Inst. 2017 Dec 1;109(12). PMID: 29370427
- Clinical Sequencing Defines the Genomic Landscape of Metastatic Colorectal Cancer. Cancer Cell. 2018 Jan 8;33(1):125-136.e3. PMID: 29316426
- 金原出版株式会社. 大腸癌治療ガイドライン医師用2024年版. 大腸癌研究会編
最終更新日 : 2024年12月6日
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。