治療スケジュール
概要
監修医師
Quizartinib:キザルチニブ(ヴァンフリタ®®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 26.5 mg 経口 | Day1~14 | |
| 53 mg 経口 | Day15~ |
その他
| ・QT間隔延長が用量制限毒性となる. |
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*「第一三共株式会社」 の外部サイトへ遷移します.
主な有害事象
QuANTUM-R試験¹⁾より引用
骨髄抑制
- 白血球数減少 (91%、 ≧Grade3 83%)
- リンパ球数減少 (80%、 ≧Grade3 60%)
- ヘモグロビン減少 (68%、 ≧Grade3 53%)
- 好中球数減少 (62%、 ≧Grade3 59%)
- 血小板数減少 (61%、 ≧Grade3 56%)
- 発熱性好中球減少症 (34%、 ≧Grade3 31%)
- 汎血球減少症 (4%、 ≧Grade3 4%)
主な有害事象
- 感染症 (69%、 ≧Grade3 45%)
- 出血 (49%、 ≧Grade3 10%)
- 嘔気 (48%、 ≧Grade3 2%)
- ALT増加 (44%、 ≧Grade3 4%)
- 倦怠感 (40%、 ≧Grade3 8%)
- 無力症 (39%、 ≧Grade3 8%)
- 発熱 (38%、 ≧Grade3 2%)
- 筋骨格痛 (38%、 ≧Grade3 4%)
- 低K血症 (34%、 ≧Grade3 11%)
- 嘔吐 (33%、 ≧Grade3 3%)
- 下痢 (29%、 ≧Grade3 2%)
- 血中ビリルビン増加 (27%、 ≧Grade3 4%)
- 心電図QT延長 (27%、 ≧Grade3 4%)
- 咳 (24%、 ≧Grade3 1%)
- 発疹 (22%、 ≧Grade3 2%)
- 腹痛 (22%、 ≧Grade3 2%)
- 頭痛 (22%、 ≧Grade3 1%)
- 敗血症および敗血症性ショック (21%、 ≧Grade3 19%)
- 末梢性浮腫 (21%、 ≧Grade3 20%)
- 呼吸困難 (21%、 ≧Grade3 6%)
- 食欲不振 (20%、 ≧Grade3 2%)
- 便秘 (20%、 ≧Grade3 0%)
- 口内炎 (18%、 ≧Grade3 3%)
- 肺炎 (16%、 ≧Grade3 5%)
- 低Mg血症 (15%、 ≧Grade3 0%)
- めまい (15%、 ≧Grade3 0%)
- ALT増加 (14%、 ≧Grade3 4%)
- 低血圧 (14%、 ≧Grade3 4%)
- 低Ca血症 (13%、 ≧Grade3 1%)
- GVHD (12%、 ≧Grade3 5%)
- 体重減少 (12%、 ≧Grade3 1%)
- 咽頭痛 (10%、 ≧Grade3 0%)
- 低リン血症 (10%、 ≧Grade3 5%)
- 低Na血症 (10%、 ≧Grade3 4%)
その他重要な有害事象
- 急性腎障害 (6%、 ≧Grade3 3%)
特徴と注意点
投与開始前
- コンパニオン診断薬である「リューコストラットCDx FLT3変異検査」により、FLT3-ITD変異が確認された患者に投与する.
- コンパニオン診断薬に関する情報は、「医薬品医療機器総合機構 (PMDA)のコンパニオン診断薬等の情報」²⁾ を参照する.
- 尚、 FLT3-TKD変異陽性には効果を認めず、 保険適用でもない.
- 心電図検査および電解質検査を行う.
- 強いCYP阻害剤併用時は17.7 mgから開始.
(例:イトラコナゾール、クラリスロマイシン等)
投与開始後
- QT延長を参照する.
- 最初は2週間は週に1回、その後は月に1回心電図検査を実施.
- QT間隔はFridericia補正式を用いたQTcF値を用いる.
- QTcF値>500msecの場合は休薬する.
- QTcF値450~500msecの場合は減量を行う.
- 電解質異常がある場合は補正を行う.
減量・休薬基準
.png?alt=media&token=9e26d813-838f-4603-8210-3e69a34e6df2)
.png?alt=media&token=b92434f5-9016-452a-950f-ccadd804bb42)
.png?alt=media&token=e7f22f49-a985-452f-a18f-898926b7b785)
.png?alt=media&token=f1251288-868a-4f10-b5de-534196d78968)
関連する臨床試験の結果
QuANTUM-R試験¹⁾
概要
- 国際共同ランダム化非盲検第3相試験
- 対象: FLT3-ITD変異を有する再発または難治性のAML患者367例
- 介入群:キザルチニブ
- 対照群:救援化学療法
(救援化学療法 = LoDAC、 MEC、 FLAG-IDA 等)
- 主要評価項目:OS
- 副次評価項目: EFS
OS:全生存期間、 EFS: 無イベント生存期間
結果
- OS中央値:キザルチニブ群 6.2ヵ月 vs 救援化学療法群 4.7ヵ月.
Lancet Oncol. 2019 Jul;20(7):984-997.より引用
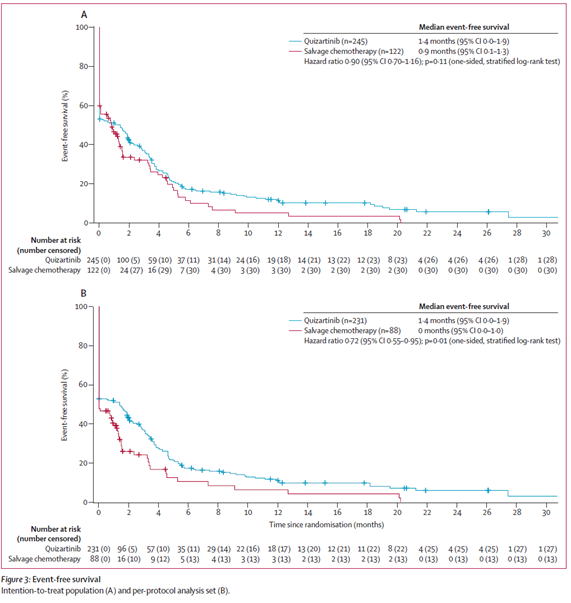
- EFS中央値:キザルチニブ群 6ヵ月 vs 救援化学療法群 3.7ヵ月.
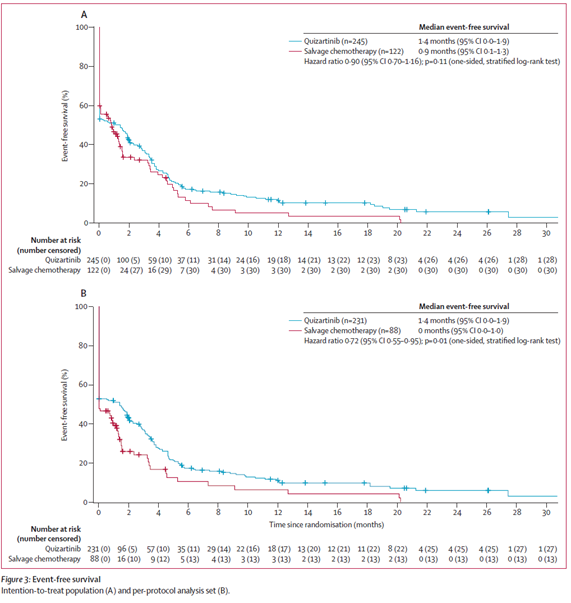
Lancet Oncol. 2019 Jul;20(7):984-997.より引用
参考文献
最終更新:2022年5月2日
監修医師:東海大学血液腫瘍内科 扇屋大輔
Quizartinib
キザルチニブ(ヴァンフリタ®)
2023年10月29日更新
Quizartinib:キザルチニブ(ヴァンフリタ®®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 26.5 mg 経口 | Day1~14 | |
| 53 mg 経口 | Day15~ |
その他
| ・QT間隔延長が用量制限毒性となる. |
概要
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*「第一三共株式会社」 の外部サイトへ遷移します.
主な有害事象
QuANTUM-R試験¹⁾より引用
骨髄抑制
- 白血球数減少 (91%、 ≧Grade3 83%)
- リンパ球数減少 (80%、 ≧Grade3 60%)
- ヘモグロビン減少 (68%、 ≧Grade3 53%)
- 好中球数減少 (62%、 ≧Grade3 59%)
- 血小板数減少 (61%、 ≧Grade3 56%)
- 発熱性好中球減少症 (34%、 ≧Grade3 31%)
- 汎血球減少症 (4%、 ≧Grade3 4%)
主な有害事象
- 感染症 (69%、 ≧Grade3 45%)
- 出血 (49%、 ≧Grade3 10%)
- 嘔気 (48%、 ≧Grade3 2%)
- ALT増加 (44%、 ≧Grade3 4%)
- 倦怠感 (40%、 ≧Grade3 8%)
- 無力症 (39%、 ≧Grade3 8%)
- 発熱 (38%、 ≧Grade3 2%)
- 筋骨格痛 (38%、 ≧Grade3 4%)
- 低K血症 (34%、 ≧Grade3 11%)
- 嘔吐 (33%、 ≧Grade3 3%)
- 下痢 (29%、 ≧Grade3 2%)
- 血中ビリルビン増加 (27%、 ≧Grade3 4%)
- 心電図QT延長 (27%、 ≧Grade3 4%)
- 咳 (24%、 ≧Grade3 1%)
- 発疹 (22%、 ≧Grade3 2%)
- 腹痛 (22%、 ≧Grade3 2%)
- 頭痛 (22%、 ≧Grade3 1%)
- 敗血症および敗血症性ショック (21%、 ≧Grade3 19%)
- 末梢性浮腫 (21%、 ≧Grade3 20%)
- 呼吸困難 (21%、 ≧Grade3 6%)
- 食欲不振 (20%、 ≧Grade3 2%)
- 便秘 (20%、 ≧Grade3 0%)
- 口内炎 (18%、 ≧Grade3 3%)
- 肺炎 (16%、 ≧Grade3 5%)
- 低Mg血症 (15%、 ≧Grade3 0%)
- めまい (15%、 ≧Grade3 0%)
- ALT増加 (14%、 ≧Grade3 4%)
- 低血圧 (14%、 ≧Grade3 4%)
- 低Ca血症 (13%、 ≧Grade3 1%)
- GVHD (12%、 ≧Grade3 5%)
- 体重減少 (12%、 ≧Grade3 1%)
- 咽頭痛 (10%、 ≧Grade3 0%)
- 低リン血症 (10%、 ≧Grade3 5%)
- 低Na血症 (10%、 ≧Grade3 4%)
その他重要な有害事象
- 急性腎障害 (6%、 ≧Grade3 3%)
特徴と注意点
投与開始前
- コンパニオン診断薬である「リューコストラットCDx FLT3変異検査」により、FLT3-ITD変異が確認された患者に投与する.
- コンパニオン診断薬に関する情報は、「医薬品医療機器総合機構 (PMDA)のコンパニオン診断薬等の情報」²⁾ を参照する.
- 尚、 FLT3-TKD変異陽性には効果を認めず、 保険適用でもない.
- 心電図検査および電解質検査を行う.
- 強いCYP阻害剤併用時は17.7 mgから開始.
(例:イトラコナゾール、クラリスロマイシン等)
投与開始後
- QT延長を参照する.
- 最初は2週間は週に1回、その後は月に1回心電図検査を実施.
- QT間隔はFridericia補正式を用いたQTcF値を用いる.
- QTcF値>500msecの場合は休薬する.
- QTcF値450~500msecの場合は減量を行う.
- 電解質異常がある場合は補正を行う.
減量・休薬基準
.png?alt=media&token=9e26d813-838f-4603-8210-3e69a34e6df2)
.png?alt=media&token=b92434f5-9016-452a-950f-ccadd804bb42)
.png?alt=media&token=e7f22f49-a985-452f-a18f-898926b7b785)
.png?alt=media&token=f1251288-868a-4f10-b5de-534196d78968)
関連する臨床試験の結果
QuANTUM-R試験¹⁾
概要
- 国際共同ランダム化非盲検第3相試験
- 対象: FLT3-ITD変異を有する再発または難治性のAML患者367例
- 介入群:キザルチニブ
- 対照群:救援化学療法
(救援化学療法 = LoDAC、 MEC、 FLAG-IDA 等)
- 主要評価項目:OS
- 副次評価項目: EFS
OS:全生存期間、 EFS: 無イベント生存期間
結果
- OS中央値:キザルチニブ群 6.2ヵ月 vs 救援化学療法群 4.7ヵ月.

Lancet Oncol. 2019 Jul;20(7):984-997.より引用
- EFS中央値:キザルチニブ群 6ヵ月 vs 救援化学療法群 3.7ヵ月.

Lancet Oncol. 2019 Jul;20(7):984-997.より引用
参考文献
最終更新:2022年5月2日
監修医師:東海大学血液腫瘍内科 扇屋大輔
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(血液)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。