本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
微小管阻害薬結合抗CD30抗体 ブレンツキシマブ ベドチン
*武田薬品工業株式会社の外部サイトへ遷移します
用法用量
国際第Ⅲ相試験³⁾、 電子添文¹⁾の用法および用量

Lancet. 2017 Aug 5;390(10094):555-566³⁾、 アドセトリス®電子添文 (2023年11月改訂 第4版)¹⁾より作図
投与開始基準
C25001試験³⁾のプロトコル

Lancet. 2017 Aug 5;390(10094):555-566³⁾より作図
減量・休薬・中止基準
電子添文¹⁾の基準
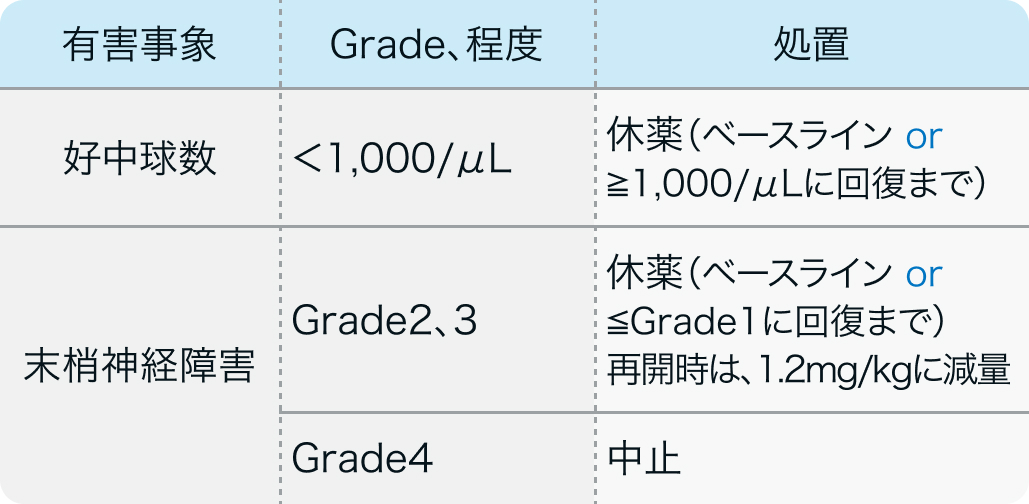
アドセトリス®電子添文 (2023年11月改訂 第4版)¹⁾より作図
主な有害事象
C25001試験³⁾
主な有害事象(カッコ内はGrade3~4)
- 悪心 36.4% (1.5%)
- 下痢 28.8% (3.0%)
- 倦怠感 28.8% (4.5%)
- 嘔吐 16.7% (1.5%)
- 脱毛症 15.2% (0%)
- そう痒症 16.7% (1.5%)
- 発熱 16.7% (0%)
- 食欲不振 15.2% (0%)
- 無力症 10.6% (1.5%)
- 呼吸困難 10.6% (0%)
- 斑状丘疹状皮疹 10.6% (1.5%)
- 末梢浮腫 10.6% (0%)
- 掻痒症 10.6% (1.5%)
- 関節痛 12.1% (0%)
- 筋肉痛 12.1% (0%)
- 頭痛 7.6% (0%)
- 貧血 4.5% (0%)
Lancet. 2017 Aug 5;390(10094):555-566³⁾より引用
エキスパートによるワンポイント
再発または難治性CD30陽性皮膚T細胞リンパ腫の治療選択肢
再発または難治性のCD30陽性の菌状息肉症に対してセカンドラインとして用いられるほか、 全身に多発する原発性皮膚未分化大細胞型リンパ腫に対して、 skin directed therapyが無効である際にファーストラインとして使用される。 前者では同ラインの薬剤としてモガムリズマブがあるが、 腫瘍細胞にCD30が発現している場合や将来的に移植を検討している患者ではブレンツキシマブベドチンが優先される可能性がある。
治療スケジュールと副作用管理
3週間に1回1.8mg/kgを点滴静注する。 好中球数が1,000/µL未満となった場合はベースラインまたは1,000/µL以上に回復するまで休薬する。 この治療に特異的な副作用として末梢神経障害が高頻度で認められる。 Grade2 (機能障害はあるが、 日常生活に支障はない) Grade3 (日常生活に支障がある) の場合はベースラインまたはGrade1 (知覚障害、 反射消失のみ) 以下に回復するまで休薬し、 1.2mg/kgに減量して投与を再開する。 Grade4 (障害をきたす感覚ニューロパチー、 生命を脅かす又は麻痺をきたす運動ニューロパチー) の場合は投与を中止する。 稀ながら重篤で薬剤を中止すべき副作用として進行性多巣性白質脳症,スティーブンス・ジョンソン症候群がある。
国際第Ⅲ相試験³⁾の結果
再発または難治性のCD30陽性CTCL患者 (実際に登録されたのは菌状息肉症および原発性皮膚未分化大細胞型リンパ腫) を対象に海外で実施された本剤とベキサロテンまたメトトレキサートの第III相非盲検ランダム化比較試験 (C25001試験³⁾) では、 primary endpointである4ヵ月以上持続する奏効率 (ORR4) はそれぞれ56.3%,12.5%で、 本剤の方が優れていた。 奏効持続時間及び無増悪生存期間も前者が優れていた。
本邦では日本人に対する有効性および安全性を評価した国内医師主導多施設共同フェーズ2試験 (SGN-35-OU試験) が行われた。 全体のORR4は62.5%であった。 副作用発現頻度は100%で、 主なものとして末梢性ニューロパチー、 発熱、 好酸球増加症などを認めた。
未治療CD30陽性末梢性T細胞リンパ腫への承認用法と注意点
承認用法は本剤単独での投与である。 一方、 未治療のCD30陽性の末梢性T細胞リンパ腫に対しては、 シクロホスファミド、 ドキソルビシン、 プレドニゾロンとの併用で承認されていることに留意が必要である。
出典
- 武田薬品工業株式会社. アドセトリス®電子添文 (2023年11月改訂 第4版) [最終閲覧 : 2024/5/20]
- 武田薬品工業株式会社. アドセトリス®適正使用ガイド (2024年5月作成) [最終閲覧 : 2024/5/20]
- Brentuximab vedotin or physician's choice in CD30-positive cutaneous T-cell lymphoma (ALCANZA): an international, open-label, randomised, phase 3, multicentre trial. Lancet. 2017 Aug 5;390(10094):555-566. PMID: 28600132
最終更新日 : 2024年7月15日
監修医師 : 近畿大学皮膚科 藤井 一恭先生
Brentuximab vedotin
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
微小管阻害薬結合抗CD30抗体 ブレンツキシマブ ベドチン
*武田薬品工業株式会社の外部サイトへ遷移します
用法用量
国際第Ⅲ相試験³⁾、 電子添文¹⁾の用法および用量

Lancet. 2017 Aug 5;390(10094):555-566³⁾、 アドセトリス®電子添文 (2023年11月改訂 第4版)¹⁾より作図
投与開始基準
C25001試験³⁾のプロトコル

Lancet. 2017 Aug 5;390(10094):555-566³⁾より作図
減量・休薬・中止基準
電子添文¹⁾の基準

アドセトリス®電子添文 (2023年11月改訂 第4版)¹⁾より作図
主な有害事象
C25001試験³⁾
主な有害事象(カッコ内はGrade3~4)
- 悪心 36.4% (1.5%)
- 下痢 28.8% (3.0%)
- 倦怠感 28.8% (4.5%)
- 嘔吐 16.7% (1.5%)
- 脱毛症 15.2% (0%)
- そう痒症 16.7% (1.5%)
- 発熱 16.7% (0%)
- 食欲不振 15.2% (0%)
- 無力症 10.6% (1.5%)
- 呼吸困難 10.6% (0%)
- 斑状丘疹状皮疹 10.6% (1.5%)
- 末梢浮腫 10.6% (0%)
- 掻痒症 10.6% (1.5%)
- 関節痛 12.1% (0%)
- 筋肉痛 12.1% (0%)
- 頭痛 7.6% (0%)
- 貧血 4.5% (0%)
Lancet. 2017 Aug 5;390(10094):555-566³⁾より引用
エキスパートによるワンポイント
再発または難治性CD30陽性皮膚T細胞リンパ腫の治療選択肢
再発または難治性のCD30陽性の菌状息肉症に対してセカンドラインとして用いられるほか、 全身に多発する原発性皮膚未分化大細胞型リンパ腫に対して、 skin directed therapyが無効である際にファーストラインとして使用される。 前者では同ラインの薬剤としてモガムリズマブがあるが、 腫瘍細胞にCD30が発現している場合や将来的に移植を検討している患者ではブレンツキシマブベドチンが優先される可能性がある。
治療スケジュールと副作用管理
3週間に1回1.8mg/kgを点滴静注する。 好中球数が1,000/µL未満となった場合はベースラインまたは1,000/µL以上に回復するまで休薬する。 この治療に特異的な副作用として末梢神経障害が高頻度で認められる。 Grade2 (機能障害はあるが、 日常生活に支障はない) Grade3 (日常生活に支障がある) の場合はベースラインまたはGrade1 (知覚障害、 反射消失のみ) 以下に回復するまで休薬し、 1.2mg/kgに減量して投与を再開する。 Grade4 (障害をきたす感覚ニューロパチー、 生命を脅かす又は麻痺をきたす運動ニューロパチー) の場合は投与を中止する。 稀ながら重篤で薬剤を中止すべき副作用として進行性多巣性白質脳症,スティーブンス・ジョンソン症候群がある。
国際第Ⅲ相試験³⁾の結果
再発または難治性のCD30陽性CTCL患者 (実際に登録されたのは菌状息肉症および原発性皮膚未分化大細胞型リンパ腫) を対象に海外で実施された本剤とベキサロテンまたメトトレキサートの第III相非盲検ランダム化比較試験 (C25001試験³⁾) では、 primary endpointである4ヵ月以上持続する奏効率 (ORR4) はそれぞれ56.3%,12.5%で、 本剤の方が優れていた。 奏効持続時間及び無増悪生存期間も前者が優れていた。
本邦では日本人に対する有効性および安全性を評価した国内医師主導多施設共同フェーズ2試験 (SGN-35-OU試験) が行われた。 全体のORR4は62.5%であった。 副作用発現頻度は100%で、 主なものとして末梢性ニューロパチー、 発熱、 好酸球増加症などを認めた。
未治療CD30陽性末梢性T細胞リンパ腫への承認用法と注意点
承認用法は本剤単独での投与である。 一方、 未治療のCD30陽性の末梢性T細胞リンパ腫に対しては、 シクロホスファミド、 ドキソルビシン、 プレドニゾロンとの併用で承認されていることに留意が必要である。
出典
- 武田薬品工業株式会社. アドセトリス®電子添文 (2023年11月改訂 第4版) [最終閲覧 : 2024/5/20]
- 武田薬品工業株式会社. アドセトリス®適正使用ガイド (2024年5月作成) [最終閲覧 : 2024/5/20]
- Brentuximab vedotin or physician's choice in CD30-positive cutaneous T-cell lymphoma (ALCANZA): an international, open-label, randomised, phase 3, multicentre trial. Lancet. 2017 Aug 5;390(10094):555-566. PMID: 28600132
最終更新日 : 2024年7月15日
監修医師 : 近畿大学皮膚科 藤井 一恭先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。