治療スケジュール
概要
監修医師
Acalabrutinib:アカラブルチニブ(カルケンス®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 100mg 経口 | 1~ | day1~ |
その他
| CYP3Aにより代謝される. またpHの上昇により溶解性が低下するため、 併用薬との相互作用に注意する. |
| 他の抗悪性腫瘍薬との併用について、 有効性及び安全性は確立していない. |
| 有害事象発現時の休薬基準と投与量調節の目安は概要欄参照. |
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
- カルケンス®カプセル (添付文書)
*アストラゼネカ株式会社の外部サイトへ遷移します.
主な有害事象
ASCEND試験¹⁾より引用.
骨髄抑制
- 貧血 (≧Grade3 11.7%).
- 好中球減少症 (≧Grade3 15.6%).
- 血小板減少症 (≧Grade3 3.9%).
主な有害事象
- 出血関連事象 (26.0%、 ≧Grade3 1.9%).
- 感染症関連事象 (56.5%、 ≧Grade3 14.9%).
- 二次性悪性腫瘍 (11.7%、 ≧Grade3 3.9%).
その他重要な有害事象
- 発熱性好中球減少症 (0.6%、 ≧Grade3 0.6%).
- 不整脈 (7.8%、 ≧Grade3 1.9%).
- 虚血性心疾患 (0.6%、 ≧Grade3 0.6%).
- 間質性肺炎 (1.9%、 ≧Grade3 1.3%).
特徴と注意点
🧑⚕️カルケンス®は剤形ごとに適応が異なり、 カプセルは慢性リンパ性白血病のみ、 錠剤は慢性リンパ性白血病とマントル細胞リンパ腫に適応となっているため注意が必要です。
東海大学医学部血液腫瘍内科 扇屋大輔先生
特徴
- ブルトン型チロシンキナーゼ阻害薬 (BTK阻害薬).
- KINOMEscanによるキナーゼ阻害プロファイリングの結果、 イブルチニブよりもBTKに対する選択的な阻害作用を示した.²⁾
- 既治療高リスク (17p欠失又は11q欠失) CLLに対してイブルチニブにPFSで非劣性. 心房細動発現率は有意に減少.³⁾
- イブルチニブ不耐容もしくは病勢進行した症例にも効果が期待できる.
- 手術や侵襲的手技を実施する場合は少なくとも前後3日間は休薬を考慮.
- カルケンス®カプセルは、 オレンジジュースやグレープフルーツジュースとの併用で血中濃度が低下する可能性がある.
2025年5月よりカルケンス®錠が販売開始された。 錠剤はカプセルに比べて高脂肪食や胃内pH上昇の影響が少なく、 カプセルで併用注意だったPPI・H₂ブロッカー・制酸剤・オレンジジュースに関する制約が緩和された。
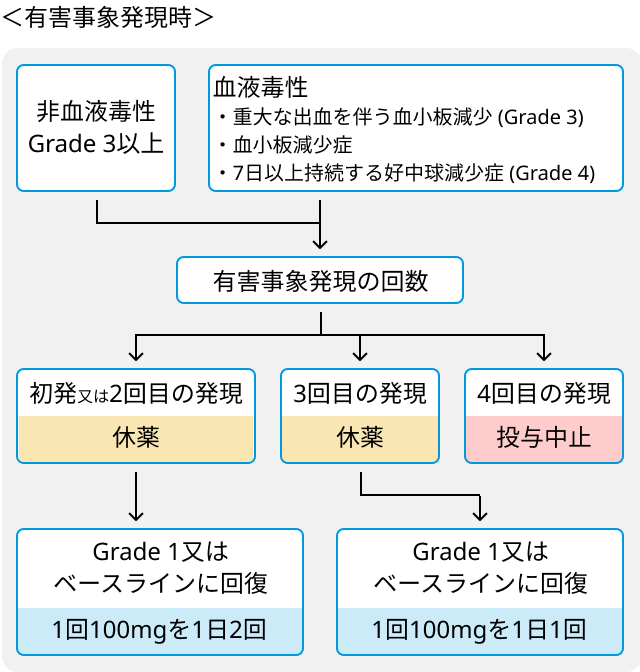
有害事象発現時の休薬基準と投与量調節の目安
関連する臨床試験の結果
IR群: Idelalisib+Rituximab群、 BR群: Bendamustin+Rituximab群、 PFS: Progression Free Survival (無増悪生存)、 ORR: Overall Response Rate (全奏効率)、 OS: Overall Survival (全生存)、 TTNT: Time To Next Treatment (次治療開始までの期間) .
ASCEND試験¹⁾
概要
- 対象 : 再発又は難治性CLL患者.
- アカラブルチニブ単剤療法の有効性を、 IR群もしくはBR群を対象群として検討した海外第III相試験 .
結果
- PFS : アカラブルチニブ群 未到達 vs IR群 15.8ヵ月 vs BR群 16.9ヵ月 (HR 0.29、 95%CI 0.18-0.46、 p<0.0001 / HR 0.36、 95%CI 0.19-0.69、 p<0.0001).
- ORR : アカラブルチニブ群 81.3% vs IR/BR群 75.5% (群間差 5.8、 95%CI -3.3-14.9、 p=0.2248).
- OS中央値 : アカラブルチニブ群 未到達 vs IR/BR群 未到達 (HR 0.84、 95%CI 0.42-1.66、 p=0.6089).
- TTNT中央値 : アカラブルチニブ群 未到達 vs IR/BR群 未到達 (HR 0.35) .
ELEVATE-RR試験 (ACE-CL-006試験)³⁾
概要
- 対象 : 高リスク (17p欠失又は11q欠失) の再発又は難治性CLL患者.
- アカラブルチニブのイブルチニブに対する非劣性を検証した無作為化多施設第III相試験.
結果
- 追跡期間中央値 : 40.9ヵ月.
- PFS中央値 : アカラブルチニブ群 16.5ヵ月 vs イブルチニブ群 16.5ヵ月 (HR 1.00、 95%CI 0.79-1.27).
- OS中央値 : アカラブルチニブ群 未到達 vs イブルチニブ群 未到達 (HR 0.82、 95%CI 0.59-1.15).
- 心房細動発生率 : アカラブルチニブ群 9.4% vs イブルチニブ群 16.0% (HR 0.52、 95%CI 0.32-0.86、 p=0.023).
- 高血圧発生率 : アカラブルチニブ群 9.4% vs イブルチニブ群 23.2% (HR 0.34、 95%CI 0.21-0.54).
ACE-CL-208試験⁴⁾
概要
- 対象 : イブルチニ不耐容かつ病勢進行を認めた再発又は難治性CLL患者.
- 多施設シングルアーム第II相試験.
結果
- ORR (≧PR) : 73% (95%CI 60-84%).
- ORR with del(17p) (≧PR) : 71% (95%CI 44-90%).
多施設第I/II相試験⁵⁾
概要
- 対象 : イブルチニ不耐容のCLL又はSLL患者.
- 多施設シングルアーム第I/II相試験 .
結果
- ORR (≧PR) : 60.6% (95%CI 42.1-77.1%).
参考文献
- J Clin Oncol. 2020 Sep 1;38(25):2849-2861.
- J Pharmacol Exp Ther. 2017 Nov;363(2):240-252.
- J Clin Oncol. 2021 Nov 1;39(31):3441-3452.
- Haematologica. 2021 Sep 1;106(9):2364-2373.
- Blood Adv. 2019 May 14;3(9):1553-1562.
最終更新 : 2025年9月11日
執筆担当 : 北里大学病院薬剤部 宮島律子
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
Acalabrutinib
アカラブルチニブ(カルケンス®)
慢性リンパ性白血病 > 再発難治性
2025年09月11日更新
Acalabrutinib:アカラブルチニブ(カルケンス®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 100mg 経口 | 1~ | day1~ |
その他
| CYP3Aにより代謝される. またpHの上昇により溶解性が低下するため、 併用薬との相互作用に注意する. |
| 他の抗悪性腫瘍薬との併用について、 有効性及び安全性は確立していない. |
| 有害事象発現時の休薬基準と投与量調節の目安は概要欄参照. |
概要
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
- カルケンス®カプセル (添付文書)
*アストラゼネカ株式会社の外部サイトへ遷移します.
主な有害事象
ASCEND試験¹⁾より引用.
骨髄抑制
- 貧血 (≧Grade3 11.7%).
- 好中球減少症 (≧Grade3 15.6%).
- 血小板減少症 (≧Grade3 3.9%).
主な有害事象
- 出血関連事象 (26.0%、 ≧Grade3 1.9%).
- 感染症関連事象 (56.5%、 ≧Grade3 14.9%).
- 二次性悪性腫瘍 (11.7%、 ≧Grade3 3.9%).
その他重要な有害事象
- 発熱性好中球減少症 (0.6%、 ≧Grade3 0.6%).
- 不整脈 (7.8%、 ≧Grade3 1.9%).
- 虚血性心疾患 (0.6%、 ≧Grade3 0.6%).
- 間質性肺炎 (1.9%、 ≧Grade3 1.3%).
特徴と注意点
🧑⚕️カルケンス®は剤形ごとに適応が異なり、 カプセルは慢性リンパ性白血病のみ、 錠剤は慢性リンパ性白血病とマントル細胞リンパ腫に適応となっているため注意が必要です。
東海大学医学部血液腫瘍内科 扇屋大輔先生
特徴
- ブルトン型チロシンキナーゼ阻害薬 (BTK阻害薬).
- KINOMEscanによるキナーゼ阻害プロファイリングの結果、 イブルチニブよりもBTKに対する選択的な阻害作用を示した.²⁾
- 既治療高リスク (17p欠失又は11q欠失) CLLに対してイブルチニブにPFSで非劣性. 心房細動発現率は有意に減少.³⁾
- イブルチニブ不耐容もしくは病勢進行した症例にも効果が期待できる.
- 手術や侵襲的手技を実施する場合は少なくとも前後3日間は休薬を考慮.
- カルケンス®カプセルは、 オレンジジュースやグレープフルーツジュースとの併用で血中濃度が低下する可能性がある.
2025年5月よりカルケンス®錠が販売開始された。 錠剤はカプセルに比べて高脂肪食や胃内pH上昇の影響が少なく、 カプセルで併用注意だったPPI・H₂ブロッカー・制酸剤・オレンジジュースに関する制約が緩和された。
有害事象発現時の休薬基準と投与量調節の目安

関連する臨床試験の結果
IR群: Idelalisib+Rituximab群、 BR群: Bendamustin+Rituximab群、 PFS: Progression Free Survival (無増悪生存)、 ORR: Overall Response Rate (全奏効率)、 OS: Overall Survival (全生存)、 TTNT: Time To Next Treatment (次治療開始までの期間) .
ASCEND試験¹⁾
概要
- 対象 : 再発又は難治性CLL患者.
- アカラブルチニブ単剤療法の有効性を、 IR群もしくはBR群を対象群として検討した海外第III相試験 .
結果
- PFS : アカラブルチニブ群 未到達 vs IR群 15.8ヵ月 vs BR群 16.9ヵ月 (HR 0.29、 95%CI 0.18-0.46、 p<0.0001 / HR 0.36、 95%CI 0.19-0.69、 p<0.0001).
- ORR : アカラブルチニブ群 81.3% vs IR/BR群 75.5% (群間差 5.8、 95%CI -3.3-14.9、 p=0.2248).
- OS中央値 : アカラブルチニブ群 未到達 vs IR/BR群 未到達 (HR 0.84、 95%CI 0.42-1.66、 p=0.6089).
- TTNT中央値 : アカラブルチニブ群 未到達 vs IR/BR群 未到達 (HR 0.35) .
ELEVATE-RR試験 (ACE-CL-006試験)³⁾
概要
- 対象 : 高リスク (17p欠失又は11q欠失) の再発又は難治性CLL患者.
- アカラブルチニブのイブルチニブに対する非劣性を検証した無作為化多施設第III相試験.
結果
- 追跡期間中央値 : 40.9ヵ月.
- PFS中央値 : アカラブルチニブ群 16.5ヵ月 vs イブルチニブ群 16.5ヵ月 (HR 1.00、 95%CI 0.79-1.27).
- OS中央値 : アカラブルチニブ群 未到達 vs イブルチニブ群 未到達 (HR 0.82、 95%CI 0.59-1.15).
- 心房細動発生率 : アカラブルチニブ群 9.4% vs イブルチニブ群 16.0% (HR 0.52、 95%CI 0.32-0.86、 p=0.023).
- 高血圧発生率 : アカラブルチニブ群 9.4% vs イブルチニブ群 23.2% (HR 0.34、 95%CI 0.21-0.54).
ACE-CL-208試験⁴⁾
概要
- 対象 : イブルチニ不耐容かつ病勢進行を認めた再発又は難治性CLL患者.
- 多施設シングルアーム第II相試験.
結果
- ORR (≧PR) : 73% (95%CI 60-84%).
- ORR with del(17p) (≧PR) : 71% (95%CI 44-90%).
多施設第I/II相試験⁵⁾
概要
- 対象 : イブルチニ不耐容のCLL又はSLL患者.
- 多施設シングルアーム第I/II相試験 .
結果
- ORR (≧PR) : 60.6% (95%CI 42.1-77.1%).
参考文献
- J Clin Oncol. 2020 Sep 1;38(25):2849-2861.
- J Pharmacol Exp Ther. 2017 Nov;363(2):240-252.
- J Clin Oncol. 2021 Nov 1;39(31):3441-3452.
- Haematologica. 2021 Sep 1;106(9):2364-2373.
- Blood Adv. 2019 May 14;3(9):1553-1562.
最終更新 : 2025年9月11日
執筆担当 : 北里大学病院薬剤部 宮島律子
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(血液)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。