2024年9月24日に 「根治切除不能な尿路上皮癌に対する一次治療」 としてペムブロリズマブとの併用療法が承認された
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
IgG1κ抗体×MMAEのADC エンホルツマブ ベドチン
*アステラス製薬株式会社の外部サイトへ遷移します
- キイトルーダ® (添付文書³⁾ / 適正使用情報⁴⁾*)
ヒト型抗ヒトPD-1モノクローナル抗体 ペムブロリズマブ
*MSD製薬の外部サイトへ遷移します
投与スケジュール
EV-302試験 (KEYNOTE-A39試験)⁵⁾

ペムブロリズマブは2年間で終了するが、 EVは効果が続き副作用が許容される限り継続
Front Oncol. 2024 Apr 22:14:1326715⁵⁾より作図
エンホルツマブ ベドチン電子添文¹⁾
ペムブロリズマブ と併用する場合は、 通常、 成人には、 エンホルツマブ ベドチンとして1回1.25mg/kg (体重) を30分以上かけて点滴静注し、 週1回投与を2週連続し、 3週目は休薬する。 これを1サイクルとして投与を繰り返す。 ただし、 1回量として125mgを超えないこと。 なお、 患者の状態により適宜減量する。
パドセブ®電子添文 (2024年9月改訂 第8版)¹⁾より引用
KeyData|臨床試験結果
EV-302試験 (KEYNOTE-A39試験)⁵⁾
前治療歴のない局所進行または転移性の尿路上皮癌 (la/mUC) 患者を対象に、 抗Nectin-4標的抗体薬物複合体エンホルツマブ ベドチン (EV) とペムブロリズマブ (Pembro) の併用療法の有効性および安全性について、 従来の化学療法を対照として比較検討した第Ⅲ相ランダム化比較試験
有効性|EV + Pembro群
- mPFS : 12.5ヵ月 (95%CI 10.4-16.6ヵ月)
化学療法群 : 6.3ヵ月 (95%CI 6.2-6.5ヵ月)
HR 0.45 (95%CI 0.38-0.54)、 p<0.00001
- mOS : 31.5ヵ月 (95%CI 25.4ヵ月-NR)
化学療法群 : 16.1ヵ月 (95%CI 13.9-18.3ヵ月)
HR 0.47 (95%CI 0.38-0.58)、 p<0.00001
- ORR : 67.7% (95%CI 63.1-72.1%)
化学療法群 : 44.4% (95%CI 39.7-49.2%) p<0.00001
安全性|EV + Pembro群の主な有害事象
- 皮膚反応 70% (Grade3、 4 : 17%)
- 末梢神経障害 67% (Grade3 : 7%)
- 高血糖/糖尿病 13.0% (Grade3、 4 : 8.9%)
- 肺炎 10% (≧Grade3 : 4%、 致死的 : 0.4%)
- 下痢 38% (≧Grade3 : 3.6%)
- 便秘 26%
- 吐き気 26%
- 味覚障害 21%
- 倦怠感 51% (Grade3、 4 : 6%)
- ドライアイ 24%
Front Oncol. 2024 Apr 22:14:1326715⁵⁾より引用
特徴と注意点
1次治療の代表的レジメン
EV+Pembro療法はGEM+CDDP/CBDCA療法と比較しPFS、 OS、 RRが優れ、 局所進行/転移性尿路上皮がんの1次治療の代表的レジメンである。
EVは3次治療での単剤療法 と異なり、 Day1,8で投与し21日を1サイクルとすることに注意する。
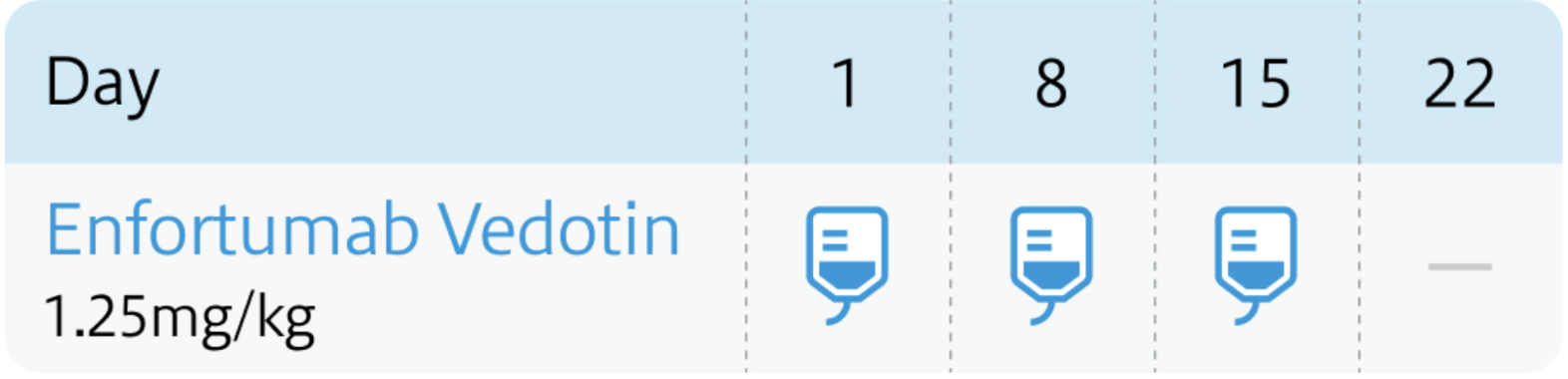
ペムブロリズマブは、 2年間で終了するが、 EVは効果が続き副作用が許容される限り継続する。
監修 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
エンホルツマブ ベドチンの作用機序
エンホルツマブ ベドチンは癌細胞表面に発現するNectin-4を標的とする抗体薬物複合体である。 Nectin-4に結合後、 MMAEが細胞内で遊離し微小管阻害作用により効果を発揮する。
監修 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
各プロトコル
減量・休薬・中止基準
エンホルツマブ ベドチン電子添文¹⁾の基準
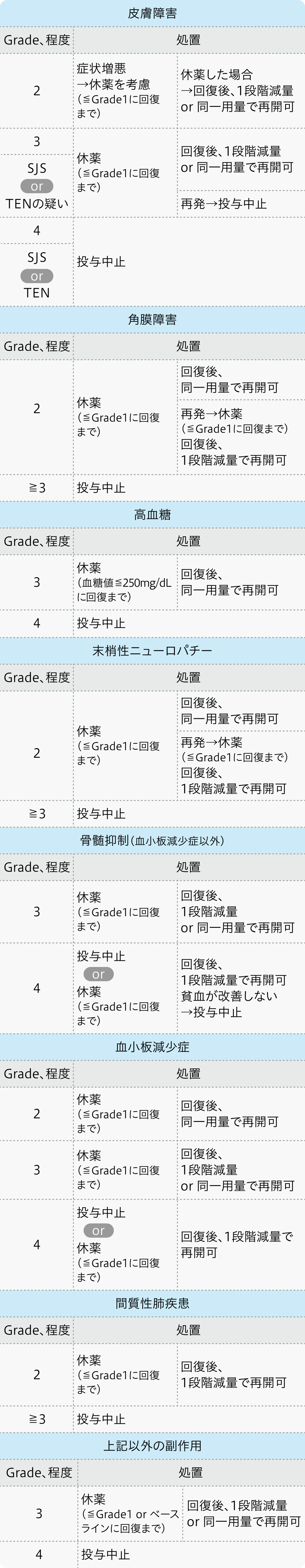
初回基準量と減量レベル

パドセブ®電子添文 (2024年9月改訂 第8版)¹⁾より作図
ペムブロリズマブ電子添文³⁾の基準

キイトルーダ®電子添文 (2024年9月改訂 第20版)³⁾より作図
出典
- アステラス製薬株式会社. パドセブ®電子添文 (2024年9月改訂 第8版) [最終閲覧 : 2024/10/8]
- アステラス製薬株式会社. パドセブ®適正使用ガイド (2024年9月作成) [最終閲覧 : 2024/10/8]
- MSD製薬. キイトルーダ®電子添文 (2024年9月改訂 第20版) [最終閲覧 : 2024/10/8]
- MSD製薬. キイトルーダ®適正使用ガイド (2024年9月作成) [最終閲覧 : 2024/10/8]
- Managing potential adverse events during treatment with enfortumab vedotin + pembrolizumab in patients with advanced urothelial cancer. Front Oncol. 2024 Apr 22:14:1326715. PMID: 38711854
最終更新日 : 2024年11月20日
監修医師 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
EV + Pembrolizumab
2024年9月24日に 「根治切除不能な尿路上皮癌に対する一次治療」 としてペムブロリズマブとの併用療法が承認された
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
IgG1κ抗体×MMAEのADC エンホルツマブ ベドチン
*アステラス製薬株式会社の外部サイトへ遷移します
- キイトルーダ® (添付文書³⁾ / 適正使用情報⁴⁾*)
ヒト型抗ヒトPD-1モノクローナル抗体 ペムブロリズマブ
*MSD製薬の外部サイトへ遷移します
投与スケジュール
EV-302試験 (KEYNOTE-A39試験)⁵⁾

ペムブロリズマブは2年間で終了するが、 EVは効果が続き副作用が許容される限り継続
Front Oncol. 2024 Apr 22:14:1326715⁵⁾より作図
エンホルツマブ ベドチン電子添文¹⁾
ペムブロリズマブ と併用する場合は、 通常、 成人には、 エンホルツマブ ベドチンとして1回1.25mg/kg (体重) を30分以上かけて点滴静注し、 週1回投与を2週連続し、 3週目は休薬する。 これを1サイクルとして投与を繰り返す。 ただし、 1回量として125mgを超えないこと。 なお、 患者の状態により適宜減量する。
パドセブ®電子添文 (2024年9月改訂 第8版)¹⁾より引用
KeyData|臨床試験結果
EV-302試験 (KEYNOTE-A39試験)⁵⁾
前治療歴のない局所進行または転移性の尿路上皮癌 (la/mUC) 患者を対象に、 抗Nectin-4標的抗体薬物複合体エンホルツマブ ベドチン (EV) とペムブロリズマブ (Pembro) の併用療法の有効性および安全性について、 従来の化学療法を対照として比較検討した第Ⅲ相ランダム化比較試験
有効性|EV + Pembro群
- mPFS : 12.5ヵ月 (95%CI 10.4-16.6ヵ月)
化学療法群 : 6.3ヵ月 (95%CI 6.2-6.5ヵ月)
HR 0.45 (95%CI 0.38-0.54)、 p<0.00001
- mOS : 31.5ヵ月 (95%CI 25.4ヵ月-NR)
化学療法群 : 16.1ヵ月 (95%CI 13.9-18.3ヵ月)
HR 0.47 (95%CI 0.38-0.58)、 p<0.00001
- ORR : 67.7% (95%CI 63.1-72.1%)
化学療法群 : 44.4% (95%CI 39.7-49.2%) p<0.00001
安全性|EV + Pembro群の主な有害事象
- 皮膚反応 70% (Grade3、 4 : 17%)
- 末梢神経障害 67% (Grade3 : 7%)
- 高血糖/糖尿病 13.0% (Grade3、 4 : 8.9%)
- 肺炎 10% (≧Grade3 : 4%、 致死的 : 0.4%)
- 下痢 38% (≧Grade3 : 3.6%)
- 便秘 26%
- 吐き気 26%
- 味覚障害 21%
- 倦怠感 51% (Grade3、 4 : 6%)
- ドライアイ 24%
Front Oncol. 2024 Apr 22:14:1326715⁵⁾より引用
特徴と注意点
1次治療の代表的レジメン
EV+Pembro療法はGEM+CDDP/CBDCA療法と比較しPFS、 OS、 RRが優れ、 局所進行/転移性尿路上皮がんの1次治療の代表的レジメンである。
EVは3次治療での単剤療法 と異なり、 Day1,8で投与し21日を1サイクルとすることに注意する。

ペムブロリズマブは、 2年間で終了するが、 EVは効果が続き副作用が許容される限り継続する。
監修 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
エンホルツマブ ベドチンの作用機序
エンホルツマブ ベドチンは癌細胞表面に発現するNectin-4を標的とする抗体薬物複合体である。 Nectin-4に結合後、 MMAEが細胞内で遊離し微小管阻害作用により効果を発揮する。
監修 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
各プロトコル
減量・休薬・中止基準
エンホルツマブ ベドチン電子添文¹⁾の基準

初回基準量と減量レベル

パドセブ®電子添文 (2024年9月改訂 第8版)¹⁾より作図
ペムブロリズマブ電子添文³⁾の基準

キイトルーダ®電子添文 (2024年9月改訂 第20版)³⁾より作図
出典
- アステラス製薬株式会社. パドセブ®電子添文 (2024年9月改訂 第8版) [最終閲覧 : 2024/10/8]
- アステラス製薬株式会社. パドセブ®適正使用ガイド (2024年9月作成) [最終閲覧 : 2024/10/8]
- MSD製薬. キイトルーダ®電子添文 (2024年9月改訂 第20版) [最終閲覧 : 2024/10/8]
- MSD製薬. キイトルーダ®適正使用ガイド (2024年9月作成) [最終閲覧 : 2024/10/8]
- Managing potential adverse events during treatment with enfortumab vedotin + pembrolizumab in patients with advanced urothelial cancer. Front Oncol. 2024 Apr 22:14:1326715. PMID: 38711854
最終更新日 : 2024年11月20日
監修医師 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。