治療スケジュール
概要
監修医師
S-1:Tegafur/Gimeracil/Oteracil(ティーエスワン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 80~120mg/日 経口 分2 朝夕食後 | 1~ | Day1~28 |
その他
| 1コース42日間。 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ティーエスワン® (添付文書¹⁾ / 適正使用ガイド²⁾*)
*大鵬薬品の医療関係者向けサイトへ遷移します
用法用量
ACTS-GC試験³⁾のプロトコル
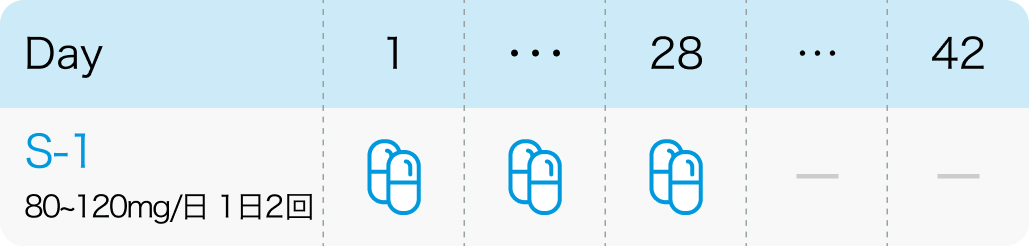
4週内服、2週間休薬を1コースとする。
N Engl J Med. 2007 Nov 1;357(18):1810-20³⁾より作図
投与開始基準
ACTS-GC試験³⁾のプロトコル

N Engl J Med. 2007 Nov 1;357(18):1810-20³⁾より作図
減量・休薬・中止基準
適正使用ガイド²⁾の基準
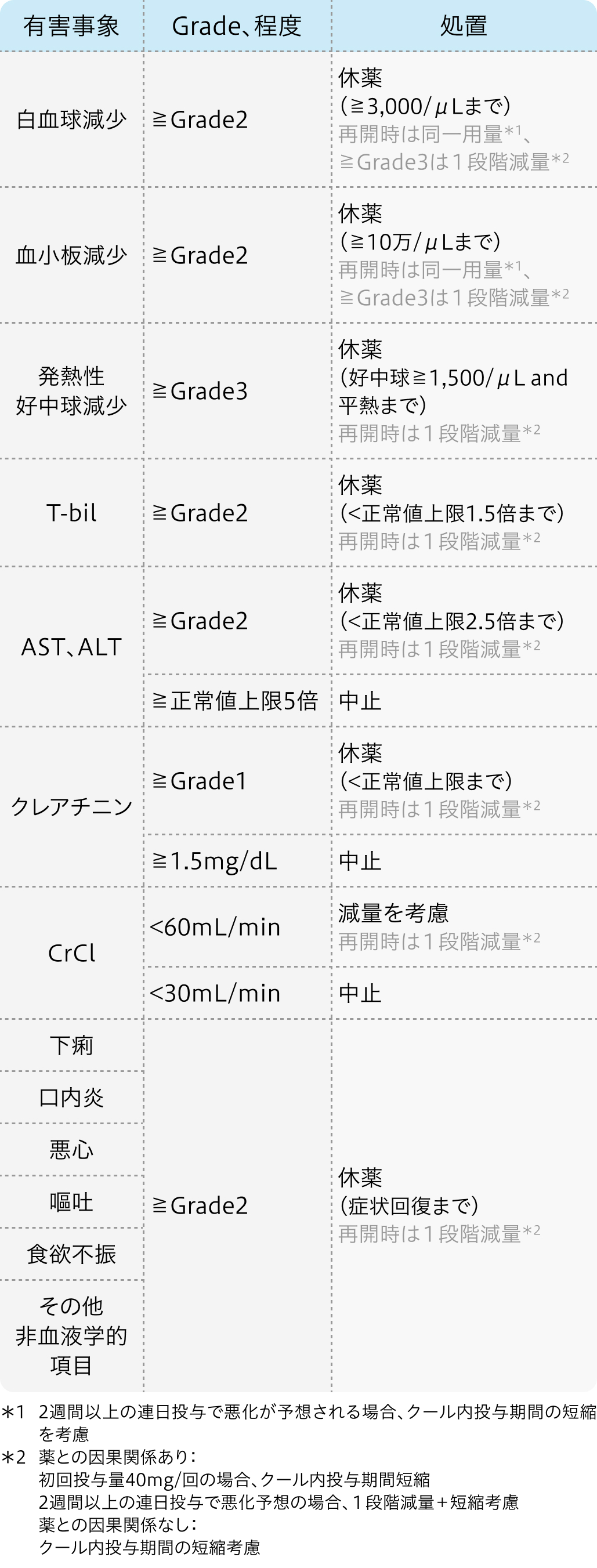
ティーエスワン®適正使用ガイド (2023年10月27日 更新)²⁾より作図
主な有害事象
ACTS-GC試験³⁾⁴⁾
主な有害事象 (カッコ内はGrade3~4)
- 白血球減少 59.4% (1.2%)
- ヘモグロビン減少 90.1% (1.2%)
- 血小板減少 25.9% (0.2%)
- AST上昇 44.9% (1.7%)
- ALT上昇 43.3% (1.2%)
- 血中ビリルビン増加 46.0% (1.5%)
- 食欲不振 61.1% (6.0%)
- 悪心 39.1% (3.7%)
- 嘔吐 22.6% (1.2%)
- 下痢 59.8% (3.1%)
- 疲労 59.0% (0.6%)
- 口内炎 32.1% (0.2%)
ティーエスワン®適正使用ガイド (2023年10月27日 更新)²⁾より引用
上手に使うためのワンポイント
- 基本的なスケジュールは4週内服2週休薬である。 コース開始14日以内に減量・休薬を要する有害事象が出現した場合は、 再開時は減量する。 一方、 コース開始15日以降に出現した場合は、 減量せずスケジュール変更 (2週内服1週休薬)で対応することで用量強度を保てることがある。
- 術後補助化学療法の完遂率と予後は相関することが報告されており⁵⁾⁶⁾ 、 適切な減量・スケジュール変更で完遂を目指すことが重要である。
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
特徴と注意点
- 胃癌治療ガイドラインでは、 pStageII術後補助化学療法の標準治療である⁷⁾。
- pStageIIIであっても、 高齢者などadj. DS療法に忍容性が無い症例はadj. S-1を選択する。
- 治療期間は手術日を起点として1年間の投与が推奨されている⁷⁾。
- S-1特有の有害事象として流涙がある。 流涙の予防には1日5~6回の人工涙液の点眼 (防腐剤フリーの点眼薬が望ましい。 著者の施設ではソフトサンティア®︎を患者さんに購入いただいている) が有効である。 休薬期間中も忘れずに点眼するように指導しておく。
- 稀ではあるが、 角膜障害を生じることがあるため、 視力低下を訴える場合は必ず眼科へコンサルトする。
- S-1はCrCl<30mL/minは禁忌である。
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
関連する臨床試験
ACTS-GC試験³⁾⁴⁾
治癒手術を受けたStageⅡ (ただし、 T1を除く)、 ⅢA又はⅢBの胃癌症例を対象として、 手術単独に対するTS-1を用いた術後補助化学療法の有用性について検証するための臨床比較試験。 主要評価項目は全生存期間 (OS)、 副次評価項目は無再発生存期間 (RFS)、 安全性とされた。
N Engl J Med. 2007 Nov 1;357(18):1810-20.
J Clin Oncol. 2011 Nov 20;29(33):4387-93.
出典
- 大鵬薬品工業株式会社 . ティーエスワン®電子添文 (2023年9月改訂 第3版) [最終閲覧 : 2024/04/01]
- 大鵬薬品工業株式会社 . ティーエスワン®適正使用ガイド (2023年10月27日 更新) [最終閲覧 : 2024/04/01]
- Adjuvant chemotherapy for gastric cancer with S-1, an oral fluoropyrimidine. N Engl J Med. 2007 Nov 1;357(18):1810-20. PMID: 17978289
- Five-year outcomes of a randomized phase III trial comparing adjuvant chemotherapy with S-1 versus surgery alone in stage II or III gastric cancer. J Clin Oncol. 2011 Nov 20;29(33):4387-93. PMID: 22010012
- Time to initiation or duration of S-1 adjuvant chemotherapy; which really impacts on survival in stage II and III gastric cancer?. Gastric Cancer. 2018 May;21(3):446-452. PMID: 28965205
- Four courses versus eight courses of adjuvant S-1 for patients with stage II gastric cancer (JCOG1104 [OPAS-1]): an open-label, phase 3, non-inferiority, randomised trial. Lancet Gastroenterol Hepatol. 2019 Mar;4(3):208-216. PMID: 3067910
- 日本胃癌学会. 胃癌治療ガイドライン医師用2021年7月改訂 第6版
最終更新日 : 2024年6月24日
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
Adj. S-1
テガフール・ギメラシル・オテラシル (ティーエスワン®)
2024年07月01日更新
S-1:Tegafur/Gimeracil/Oteracil(ティーエスワン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 80~120mg/日 経口 分2 朝夕食後 | 1~ | Day1~28 |
その他
| 1コース42日間。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ティーエスワン® (添付文書¹⁾ / 適正使用ガイド²⁾*)
*大鵬薬品の医療関係者向けサイトへ遷移します
用法用量
ACTS-GC試験³⁾のプロトコル

4週内服、2週間休薬を1コースとする。
N Engl J Med. 2007 Nov 1;357(18):1810-20³⁾より作図
投与開始基準
ACTS-GC試験³⁾のプロトコル

N Engl J Med. 2007 Nov 1;357(18):1810-20³⁾より作図
減量・休薬・中止基準
適正使用ガイド²⁾の基準

ティーエスワン®適正使用ガイド (2023年10月27日 更新)²⁾より作図
主な有害事象
ACTS-GC試験³⁾⁴⁾
主な有害事象 (カッコ内はGrade3~4)
- 白血球減少 59.4% (1.2%)
- ヘモグロビン減少 90.1% (1.2%)
- 血小板減少 25.9% (0.2%)
- AST上昇 44.9% (1.7%)
- ALT上昇 43.3% (1.2%)
- 血中ビリルビン増加 46.0% (1.5%)
- 食欲不振 61.1% (6.0%)
- 悪心 39.1% (3.7%)
- 嘔吐 22.6% (1.2%)
- 下痢 59.8% (3.1%)
- 疲労 59.0% (0.6%)
- 口内炎 32.1% (0.2%)
ティーエスワン®適正使用ガイド (2023年10月27日 更新)²⁾より引用
上手に使うためのワンポイント
- 基本的なスケジュールは4週内服2週休薬である。 コース開始14日以内に減量・休薬を要する有害事象が出現した場合は、 再開時は減量する。 一方、 コース開始15日以降に出現した場合は、 減量せずスケジュール変更 (2週内服1週休薬)で対応することで用量強度を保てることがある。
- 術後補助化学療法の完遂率と予後は相関することが報告されており⁵⁾⁶⁾ 、 適切な減量・スケジュール変更で完遂を目指すことが重要である。
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
特徴と注意点
- 胃癌治療ガイドラインでは、 pStageII術後補助化学療法の標準治療である⁷⁾。
- pStageIIIであっても、 高齢者などadj. DS療法に忍容性が無い症例はadj. S-1を選択する。
- 治療期間は手術日を起点として1年間の投与が推奨されている⁷⁾。
- S-1特有の有害事象として流涙がある。 流涙の予防には1日5~6回の人工涙液の点眼 (防腐剤フリーの点眼薬が望ましい。 著者の施設ではソフトサンティア®︎を患者さんに購入いただいている) が有効である。 休薬期間中も忘れずに点眼するように指導しておく。
- 稀ではあるが、 角膜障害を生じることがあるため、 視力低下を訴える場合は必ず眼科へコンサルトする。
- S-1はCrCl<30mL/minは禁忌である。
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
関連する臨床試験
ACTS-GC試験³⁾⁴⁾
治癒手術を受けたStageⅡ (ただし、 T1を除く)、 ⅢA又はⅢBの胃癌症例を対象として、 手術単独に対するTS-1を用いた術後補助化学療法の有用性について検証するための臨床比較試験。 主要評価項目は全生存期間 (OS)、 副次評価項目は無再発生存期間 (RFS)、 安全性とされた。
N Engl J Med. 2007 Nov 1;357(18):1810-20.
J Clin Oncol. 2011 Nov 20;29(33):4387-93.
出典
- 大鵬薬品工業株式会社 . ティーエスワン®電子添文 (2023年9月改訂 第3版) [最終閲覧 : 2024/04/01]
- 大鵬薬品工業株式会社 . ティーエスワン®適正使用ガイド (2023年10月27日 更新) [最終閲覧 : 2024/04/01]
- Adjuvant chemotherapy for gastric cancer with S-1, an oral fluoropyrimidine. N Engl J Med. 2007 Nov 1;357(18):1810-20. PMID: 17978289
- Five-year outcomes of a randomized phase III trial comparing adjuvant chemotherapy with S-1 versus surgery alone in stage II or III gastric cancer. J Clin Oncol. 2011 Nov 20;29(33):4387-93. PMID: 22010012
- Time to initiation or duration of S-1 adjuvant chemotherapy; which really impacts on survival in stage II and III gastric cancer?. Gastric Cancer. 2018 May;21(3):446-452. PMID: 28965205
- Four courses versus eight courses of adjuvant S-1 for patients with stage II gastric cancer (JCOG1104 [OPAS-1]): an open-label, phase 3, non-inferiority, randomised trial. Lancet Gastroenterol Hepatol. 2019 Mar;4(3):208-216. PMID: 3067910
- 日本胃癌学会. 胃癌治療ガイドライン医師用2021年7月改訂 第6版
最終更新日 : 2024年6月24日
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(消化器)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
