治療スケジュール
概要
監修医師
DARA:ダラツムマブ(ダラキューロ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1800mg/body 皮下注 | 1~2 | Day 1、8、15、22 |
| 1800mg/body 皮下注 | 3~6 | Day 1、15 |
| 1800mg/body 皮下注 | 7~ | Day 1 |
CPA:シクロホスファミド(エンドキサン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 300mg/m² 経口 | 1~6 | Day 1、8、15、22 |
| *点滴静注も可 | - | - |
BOR:ボルテゾミブ(ベルケイド®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1.3mg/m² 皮下注 | 1~6 | Day 1、8、15、22 |
DEX:デキサメタゾン(デカドロン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 40mg/body 経口 | 1~6 | Day 1、8、15、22 |
| *点滴静注も可 | - | - |
前投薬
| DARA投与1~3時間前に下記薬剤を投与. |
| ①解熱鎮痛薬、②抗ヒスタミン薬、③ロイコトリエン受容体拮抗薬* (モンテルカスト10mg経口) |
| *ロイコトリエン受容体拮抗薬は1コース目Day1は推奨. 以降は任意. |
その他
| 1コースは28日間. |
| DCyBorDとしては6コースまで継続. |
| 6コース終了後は、DARA単剤のみ4週に1回投与 (PDまで or 最大24コースまで). |
| CPAは300mg/m² 最大量500mg. 50mg単位で最も近い量とする (例: 310mgなら300mg). |
| 年齢>70歳、 BMI<18.5、 循環血液量増加、 コントロール不良な糖尿病、 糖質コルチコイドにより以前に許容できない副作用の経験を有する場合は、 Dex 20mgへ減量可能. |
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
主な有害事象
ANDROMEDA試験¹⁾より引用
骨髄抑制
- 好中球減少症 (10.9%、 ≧Grade3 5.2%)
- 貧血 (24.4%、 ≧Grade3 No data)
- 血小板減少症 (17.1%、 ≧Grade3 No data)
- リンパ球減少症 (18.7%、 ≧Grade3 13.0%)
主な有害事象
- 下痢 (35.8%、 ≧Grade3 5.7%)
- 末梢性浮腫 (35.8%、 ≧Grade3 3.1%)
- 便秘 (34.2%、 ≧Grade3 1.6%)
- 末梢性感覚ニューロパチー (31.1%、 ≧Grade3 2.6%)
- 倦怠感 (26.9%、 ≧Grade3 4.1%)
- 悪心 (26.9%、 ≧Grade3 1.6%)
- 上気道感染 (25.9%、 ≧Grade3 0.5%)
- 低カリウム血症 (12.4%、 ≧Grade3 1.6%)
- 肺炎 (10.9%、 ≧Grade3 7.8%)
- 失神 (7.3%、 ≧Grade3 5.2%)
- 心不全 (9.3%、 ≧Grade3 6.2%)
その他重要な有害事象
- Infusion reaction (7.3%) ※前投薬あり
- 発熱性好中球減少症 (0%)
特徴と注意点
特徴
- DCyBorD (DVCd)療法は全身性ALアミロイドーシスに保険適用.
- ANDROMEDA試験により血液学的完全寛解率 53.3%と良好な結果であった.
ダラツムマブ
- ダラツムマブは抗CD38モノクローナル抗体でALアミロイドの原因である軽鎖を産生する形質細胞への直接作用と免疫調節作用を介した間接作用を有する.
- 全身性ALアミロイドーシスへはダラキューロ®のみ保険適用 (ダラザレックス®は保険適用なし).
- 投与前に不規則抗体スクリーニング検査を含めた一般的な輸血前検査を実施する (投与後約半年間、 間接クームス試験が偽陽性となることがある).
- 呼吸器合併症のリスクが高い症例に対しては気管支拡張薬および、 吸入ステロイド薬の投与を考慮.
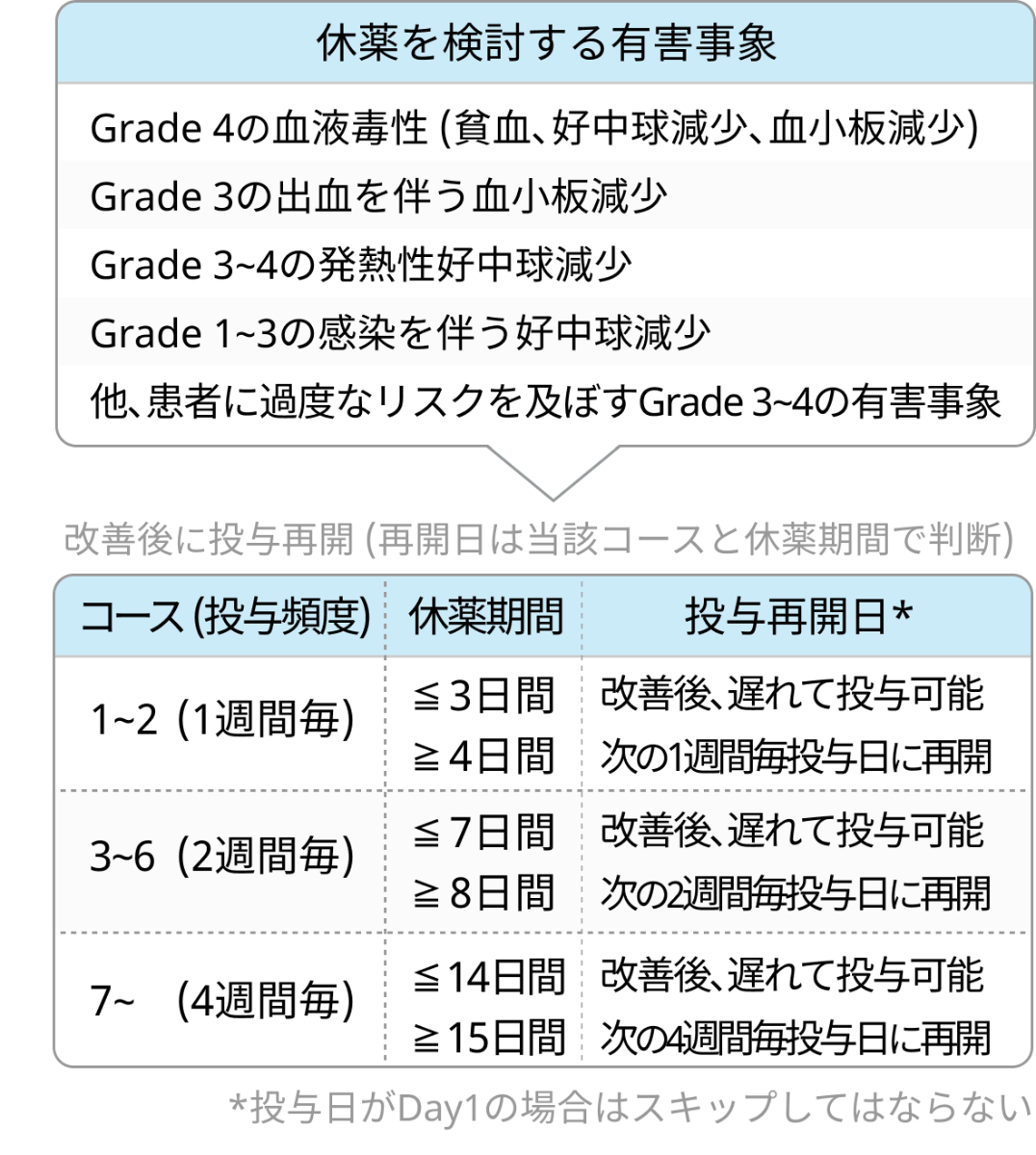
- 用量調整はなく、 以下の有害事象出現時には休薬を検討する.
シクロホスファミド
- 骨髄抑制に注意し、 血球減少の程度に応じて用量調節する.
- 出血性膀胱炎の発症に注意し補液や水分摂取により発症を予防する.

ボルテゾミブ
- ボルテゾミブはプロテアソーム阻害薬.
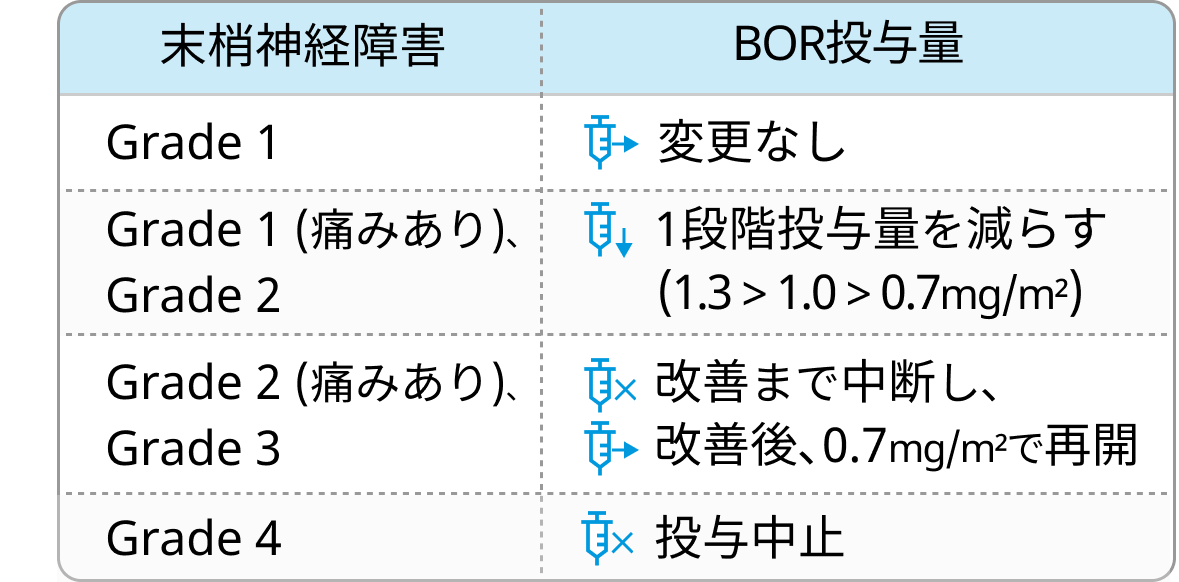
- 末梢神経障害の発生に注意し、 程度に応じて用量調節する.
- 帯状疱疹予防のため、 抗ヘルペスウイルス薬の予防投与を推奨.
関連する臨床試験の結果
ANDROMEDA試験¹⁾

概要
- 国際共同ランダム化非盲検第3相試験.
- 対象:未治療の全身性ALアミロイドーシス.
- 選択基準:ALアミロイドーシス統一基準に合致する臓器病変を1つ以上有する. 心臓病期がⅠ-ⅢA. eGFR≧20mL/min.
※心臓病期 Ⅲb期やeGFR<20mL/minの症例は選択基準に入っていなかった.
- 治療:DCyBorD (DARA群) vs CyBorD (Control群) ※1:1 ランダム化. N=388例.
- 主要評価項目:血液学的完全奏効率 (CR率)
- 副次評価項目:MOD-PFS、 臓器奏効率、 血液学的奏効までの期間、 全生存期間、 安全性
血液学的完全寛解率:血清免疫固定法陰性、 かつFLC比正常
非常に良い部分寛解 (VGPR率):dFLC<40mg/L、
dFLC:involved FLCとuninvolved FLCの差 (κとλの差)
MOD-PFS (major organ deterioration progression-free survival):心 / 腎機能悪化 or 血液学的増悪のない生存率
心奏効:NTPro-BNPの30%以上および300ng/L以上の減少
腎奏効:24時間尿中タンパク量の50%以上の減少.
結果
- 観察期間中央値:11.4ヵ月 (0.03-21.3)
- 血液学的CR率:DARA群 53.3% vs 対照群 18.1% (p<0.001)
- ≧VGPR率:DARA群 78.5% vs 対照群 49.2%
- dFLC<10mg/L:DARA群 63.3% vs 対照群 29.5%
- 心奏効率 (6ヵ月時点):DARA群 41.5% vs 対照群 22.2%
- 腎奏効率 (6ヵ月時点):DARA群 53.0% vs 対照群 23.9%
- MOD-PFS:DARA群において良好 (HR 0.58、 95%CI 0.36-0.93、 p=0.02).
- 血液学的CR率のサブグループ解析では、 年齢、 心ステージ、 心アミロイドーシスの有無、 t(11;14)の有無に関係なくDARA群が有効であった.
参考文献
最終更新:2023年5月7日
監修医師:東海大学血液腫瘍内科 扇屋大輔
DCyBorD(DARA-VCD)
ダラツムマブ、ボルテゾミブ、シクロフォスファミド、デキサメタゾン
2025年08月19日更新
DARA:ダラツムマブ(ダラキューロ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1800mg/body 皮下注 | 1~2 | Day 1、8、15、22 |
| 1800mg/body 皮下注 | 3~6 | Day 1、15 |
| 1800mg/body 皮下注 | 7~ | Day 1 |
CPA:シクロホスファミド(エンドキサン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 300mg/m² 経口 | 1~6 | Day 1、8、15、22 |
| *点滴静注も可 | - | - |
BOR:ボルテゾミブ(ベルケイド®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1.3mg/m² 皮下注 | 1~6 | Day 1、8、15、22 |
DEX:デキサメタゾン(デカドロン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 40mg/body 経口 | 1~6 | Day 1、8、15、22 |
| *点滴静注も可 | - | - |
前投薬
| DARA投与1~3時間前に下記薬剤を投与. |
| ①解熱鎮痛薬、②抗ヒスタミン薬、③ロイコトリエン受容体拮抗薬* (モンテルカスト10mg経口) |
| *ロイコトリエン受容体拮抗薬は1コース目Day1は推奨. 以降は任意. |
その他
| 1コースは28日間. |
| DCyBorDとしては6コースまで継続. |
| 6コース終了後は、DARA単剤のみ4週に1回投与 (PDまで or 最大24コースまで). |
| CPAは300mg/m² 最大量500mg. 50mg単位で最も近い量とする (例: 310mgなら300mg). |
| 年齢>70歳、 BMI<18.5、 循環血液量増加、 コントロール不良な糖尿病、 糖質コルチコイドにより以前に許容できない副作用の経験を有する場合は、 Dex 20mgへ減量可能. |
概要
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
主な有害事象
ANDROMEDA試験¹⁾より引用
骨髄抑制
- 好中球減少症 (10.9%、 ≧Grade3 5.2%)
- 貧血 (24.4%、 ≧Grade3 No data)
- 血小板減少症 (17.1%、 ≧Grade3 No data)
- リンパ球減少症 (18.7%、 ≧Grade3 13.0%)
主な有害事象
- 下痢 (35.8%、 ≧Grade3 5.7%)
- 末梢性浮腫 (35.8%、 ≧Grade3 3.1%)
- 便秘 (34.2%、 ≧Grade3 1.6%)
- 末梢性感覚ニューロパチー (31.1%、 ≧Grade3 2.6%)
- 倦怠感 (26.9%、 ≧Grade3 4.1%)
- 悪心 (26.9%、 ≧Grade3 1.6%)
- 上気道感染 (25.9%、 ≧Grade3 0.5%)
- 低カリウム血症 (12.4%、 ≧Grade3 1.6%)
- 肺炎 (10.9%、 ≧Grade3 7.8%)
- 失神 (7.3%、 ≧Grade3 5.2%)
- 心不全 (9.3%、 ≧Grade3 6.2%)
その他重要な有害事象
- Infusion reaction (7.3%) ※前投薬あり
- 発熱性好中球減少症 (0%)
特徴と注意点
特徴
- DCyBorD (DVCd)療法は全身性ALアミロイドーシスに保険適用.
- ANDROMEDA試験により血液学的完全寛解率 53.3%と良好な結果であった.
ダラツムマブ
- ダラツムマブは抗CD38モノクローナル抗体でALアミロイドの原因である軽鎖を産生する形質細胞への直接作用と免疫調節作用を介した間接作用を有する.
- 全身性ALアミロイドーシスへはダラキューロ®のみ保険適用 (ダラザレックス®は保険適用なし).
- 投与前に不規則抗体スクリーニング検査を含めた一般的な輸血前検査を実施する (投与後約半年間、 間接クームス試験が偽陽性となることがある).
- 呼吸器合併症のリスクが高い症例に対しては気管支拡張薬および、 吸入ステロイド薬の投与を考慮.
- 用量調整はなく、 以下の有害事象出現時には休薬を検討する.

シクロホスファミド
- 骨髄抑制に注意し、 血球減少の程度に応じて用量調節する.
- 出血性膀胱炎の発症に注意し補液や水分摂取により発症を予防する.

ボルテゾミブ
- ボルテゾミブはプロテアソーム阻害薬.
- 末梢神経障害の発生に注意し、 程度に応じて用量調節する.
- 帯状疱疹予防のため、 抗ヘルペスウイルス薬の予防投与を推奨.

関連する臨床試験の結果
ANDROMEDA試験¹⁾

概要
- 国際共同ランダム化非盲検第3相試験.
- 対象:未治療の全身性ALアミロイドーシス.
- 選択基準:ALアミロイドーシス統一基準に合致する臓器病変を1つ以上有する. 心臓病期がⅠ-ⅢA. eGFR≧20mL/min.
※心臓病期 Ⅲb期やeGFR<20mL/minの症例は選択基準に入っていなかった.
- 治療:DCyBorD (DARA群) vs CyBorD (Control群) ※1:1 ランダム化. N=388例.
- 主要評価項目:血液学的完全奏効率 (CR率)
- 副次評価項目:MOD-PFS、 臓器奏効率、 血液学的奏効までの期間、 全生存期間、 安全性
血液学的完全寛解率:血清免疫固定法陰性、 かつFLC比正常
非常に良い部分寛解 (VGPR率):dFLC<40mg/L、
dFLC:involved FLCとuninvolved FLCの差 (κとλの差)
MOD-PFS (major organ deterioration progression-free survival):心 / 腎機能悪化 or 血液学的増悪のない生存率
心奏効:NTPro-BNPの30%以上および300ng/L以上の減少
腎奏効:24時間尿中タンパク量の50%以上の減少.
結果
- 観察期間中央値:11.4ヵ月 (0.03-21.3)
- 血液学的CR率:DARA群 53.3% vs 対照群 18.1% (p<0.001)
- ≧VGPR率:DARA群 78.5% vs 対照群 49.2%
- dFLC<10mg/L:DARA群 63.3% vs 対照群 29.5%
- 心奏効率 (6ヵ月時点):DARA群 41.5% vs 対照群 22.2%
- 腎奏効率 (6ヵ月時点):DARA群 53.0% vs 対照群 23.9%
- MOD-PFS:DARA群において良好 (HR 0.58、 95%CI 0.36-0.93、 p=0.02).
- 血液学的CR率のサブグループ解析では、 年齢、 心ステージ、 心アミロイドーシスの有無、 t(11;14)の有無に関係なくDARA群が有効であった.
参考文献
最終更新:2023年5月7日
監修医師:東海大学血液腫瘍内科 扇屋大輔
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(血液)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。