治療スケジュール
概要
監修医師
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
FGFR阻害剤 フチバチニブ
*大鵬薬品工業株式会社の外部サイトへ遷移します
用法用量
電子添文¹⁾の用法および用量
空腹時に投与
リトゴビ®電子添文 (2023年6月改訂 第1版)¹⁾より作図
投与開始基準
TAS-120-101試験³⁾のプロトコル
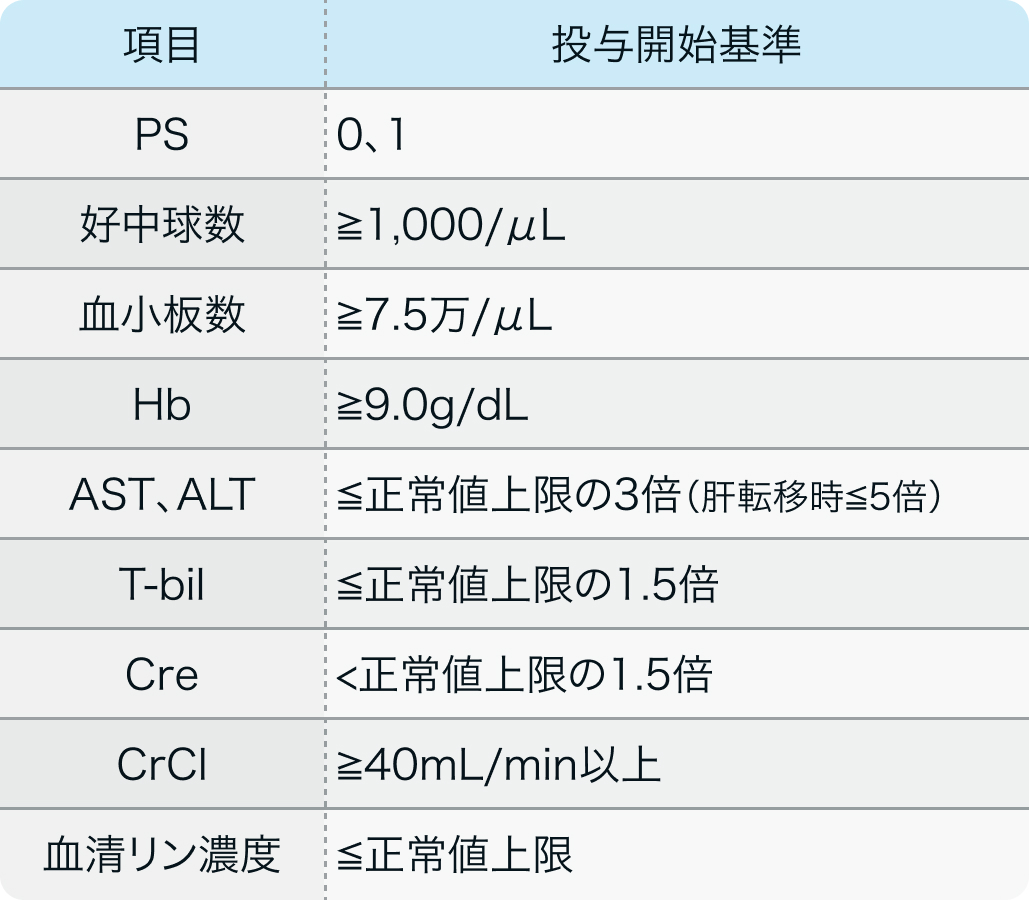
N Engl J Med. 2023 Jan 19;388(3):228-239³⁾より作図
減量・休薬・中止基準
電子添文¹⁾の基準

リトゴビ®電子添文 (2023年6月改訂 第1版)¹⁾より作図
初回基準量と減量レベル

リトゴビ®電子添文 (2023年6月改訂 第1版)¹⁾より作図
主な有害事象
TAS-120-101試験³⁾
主な有害事象 (カッコ内はGrade3~4)
- 高リン酸塩血症 85.4% (30.1%)
- 下痢 28.2% (0%)
- 疲労 25.2% (5.8%)
- 口内炎 20.4% (5.8%)
- AST増加 18.4% (6.8%)
- 便秘 16.5% (0%)
- ALT増加 14.6% (4.9%)
- 食欲減退 12.6% (0%)
- 悪心 11.7% (1.9%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 脱毛症 33.0% (0%)
- 手掌・足底発赤知覚不全症候群 21.4% (4.9%)
N Engl J Med. 2023 Jan 19;388(3):228-239³⁾より引用
出典
- 大鵬薬品工業株式会社. リトゴビ®電子添文 (2023年6月改訂 第1版) [最終閲覧 : 2024/6/10]
- 大鵬薬品工業株式会社. リトゴビ®適正使用ガイド (2024年3月改訂) [最終閲覧 : 2024/6/10]
- Futibatinib for FGFR2-Rearranged Intrahepatic Cholangiocarcinoma. N Engl J Med. 2023 Jan 19;388(3):228-239. PMID: 36652354
最終更新日:2024年6月18日
監修医師:HOKUTO編集部監修医師
Futibatinib
フチバチニブ (リトゴビ®)
2024年11月25日更新
Futibatinib:Futibatinib(リトゴビ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 20mg 1日1回 経口投与(空腹時) | 連日投与 | 連日投与 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
FGFR阻害剤 フチバチニブ
*大鵬薬品工業株式会社の外部サイトへ遷移します
用法用量
電子添文¹⁾の用法および用量

空腹時に投与
リトゴビ®電子添文 (2023年6月改訂 第1版)¹⁾より作図
投与開始基準
TAS-120-101試験³⁾のプロトコル

N Engl J Med. 2023 Jan 19;388(3):228-239³⁾より作図
減量・休薬・中止基準
電子添文¹⁾の基準

リトゴビ®電子添文 (2023年6月改訂 第1版)¹⁾より作図
初回基準量と減量レベル

リトゴビ®電子添文 (2023年6月改訂 第1版)¹⁾より作図
主な有害事象
TAS-120-101試験³⁾
主な有害事象 (カッコ内はGrade3~4)
- 高リン酸塩血症 85.4% (30.1%)
- 下痢 28.2% (0%)
- 疲労 25.2% (5.8%)
- 口内炎 20.4% (5.8%)
- AST増加 18.4% (6.8%)
- 便秘 16.5% (0%)
- ALT増加 14.6% (4.9%)
- 食欲減退 12.6% (0%)
- 悪心 11.7% (1.9%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 脱毛症 33.0% (0%)
- 手掌・足底発赤知覚不全症候群 21.4% (4.9%)
N Engl J Med. 2023 Jan 19;388(3):228-239³⁾より引用
出典
- 大鵬薬品工業株式会社. リトゴビ®電子添文 (2023年6月改訂 第1版) [最終閲覧 : 2024/6/10]
- 大鵬薬品工業株式会社. リトゴビ®適正使用ガイド (2024年3月改訂) [最終閲覧 : 2024/6/10]
- Futibatinib for FGFR2-Rearranged Intrahepatic Cholangiocarcinoma. N Engl J Med. 2023 Jan 19;388(3):228-239. PMID: 36652354
最終更新日:2024年6月18日
監修医師:HOKUTO編集部監修医師
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(消化器)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
