本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
マルチキナーゼ阻害薬 レゴラフェニブ
*バイエル薬品株式会社の外部サイトへ遷移します
投与スケジュール
電子添文¹⁾の用法および用量
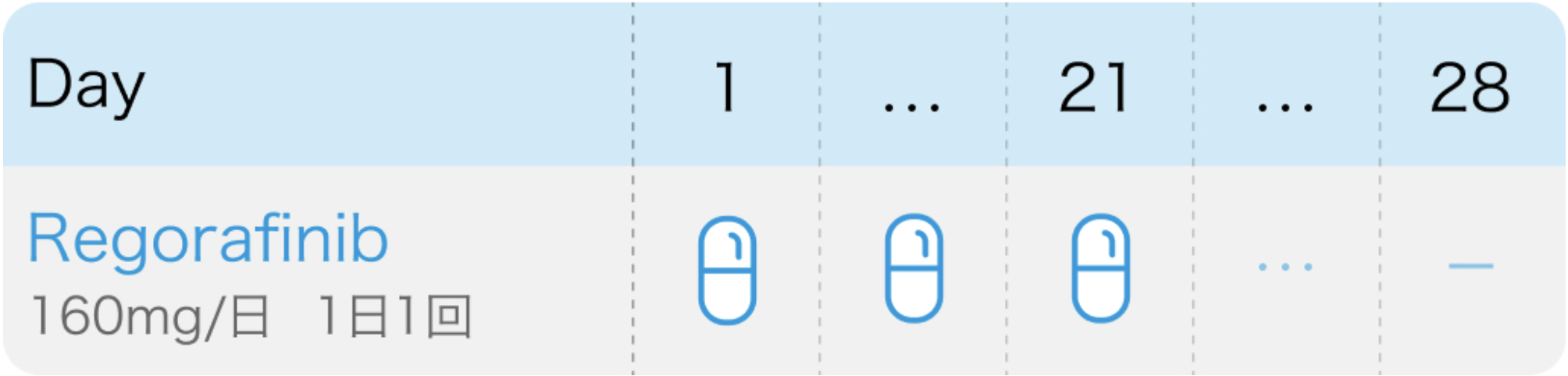
スチバーガ®電子添文 (2024年7月改訂 第4版)¹⁾より作図
レゴラフェニブ1日1回160mgを食後に3週間連日経口投与し、 その後1週間休薬する。 これを1サイクルとして投与を繰り返す。
特徴と注意点
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
初回投与量と減量について
ReDOS試験⁴⁾などのように初回減量開始で、 週ごとに毒性をみて増量する治療戦略は、 有効であるとする報告が国内外問わず存在しており積極的に検討できる選択肢である。
副作用マネジメントについて
肝機能障害について
肝機能障害の出現を考慮し1-2コースは原則、 毎週血液検査結果をチェックして処方する。
手足皮膚症候群について
手足皮膚症候群の頻度が高いことから、 保湿剤等処方や患者指導を行う。
尿蛋白について
尿蛋白1+出現時は、 次のVISITからのUPCR事前測定を考慮する。 リアルワールドでは、 尿蛋白2+でもUPCR<2.0で投与可能とする医師はいる。
KeyData|臨床試験結果
(1) CORRECT試験³⁾
標準治療後に進行した転移性大腸癌において、 マルチキナーゼ阻害薬レゴラフェニブの効果を、 プラセボを対象に検証した第Ⅲ相ランダム化比較試験CORRECTの結果より、 全生存期間 (OS) および無増悪生存期間 (PFS) の有意な改善が示された。
主な有害事象 (カッコ内はGrade3~4)
- 疲労 47% (10%)
- 下痢 34% (7%)
- 食欲不振 30% (3%)
- 高血圧 28% (7%)
- 発疹/落屑 26% (6%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 手足症候群 47% (17%)
Lancet. 2013 Jan 26;381(9863):303-12³⁾より引用
OS中央値
- レゴラフェニブ群 : 6.4ヵ月
- プラセボ群 : 5.0ヵ月
HR 0.77 (95%CI 0.64-0.94)、 p=0.0052
PFS中央値
- レゴラフェニブ群 : 1.9ヵ月
- プラセボ群 : 1.7ヵ月
HR 0.49 (95%CI 0.42–0.58;)、 p<0·0001
部分奏効 (PR)
- レゴラフェニブ群 : 1.0%
- プラセボ群 : 0.4%
完全奏効 (CR) はなし
p=0.19
病勢コントロール率
- レゴラフェニブ群 : 41%
- プラセボ群 : 15%
p<0.0001
(2) ReDOS試験⁴⁾
標準用量群と低用量で開始後1週間毎に漸増する群との忍容性を比較する多施設共同第II相無作為化非盲検化試験で、 癌研究ネットワークACCRU (Academic and Community Cancer Research United) によって行われた。 18歳以上、 ECOG PS 0/1、 余命3ヵ月以上、 組織学的/細胞学的に結腸/直腸の腺癌と認められ、 標準化学療法 (フッ化ピリミジン系薬剤、 Oxaliplatin、 Irinotecan、 抗VEGF抗体薬、 抗EGFR抗体薬が適格の患者においては抗EGFR抗体薬) 不応となった症例が対象となった。
各プロトコル
投与開始基準
CORRECT試験のプロトコル
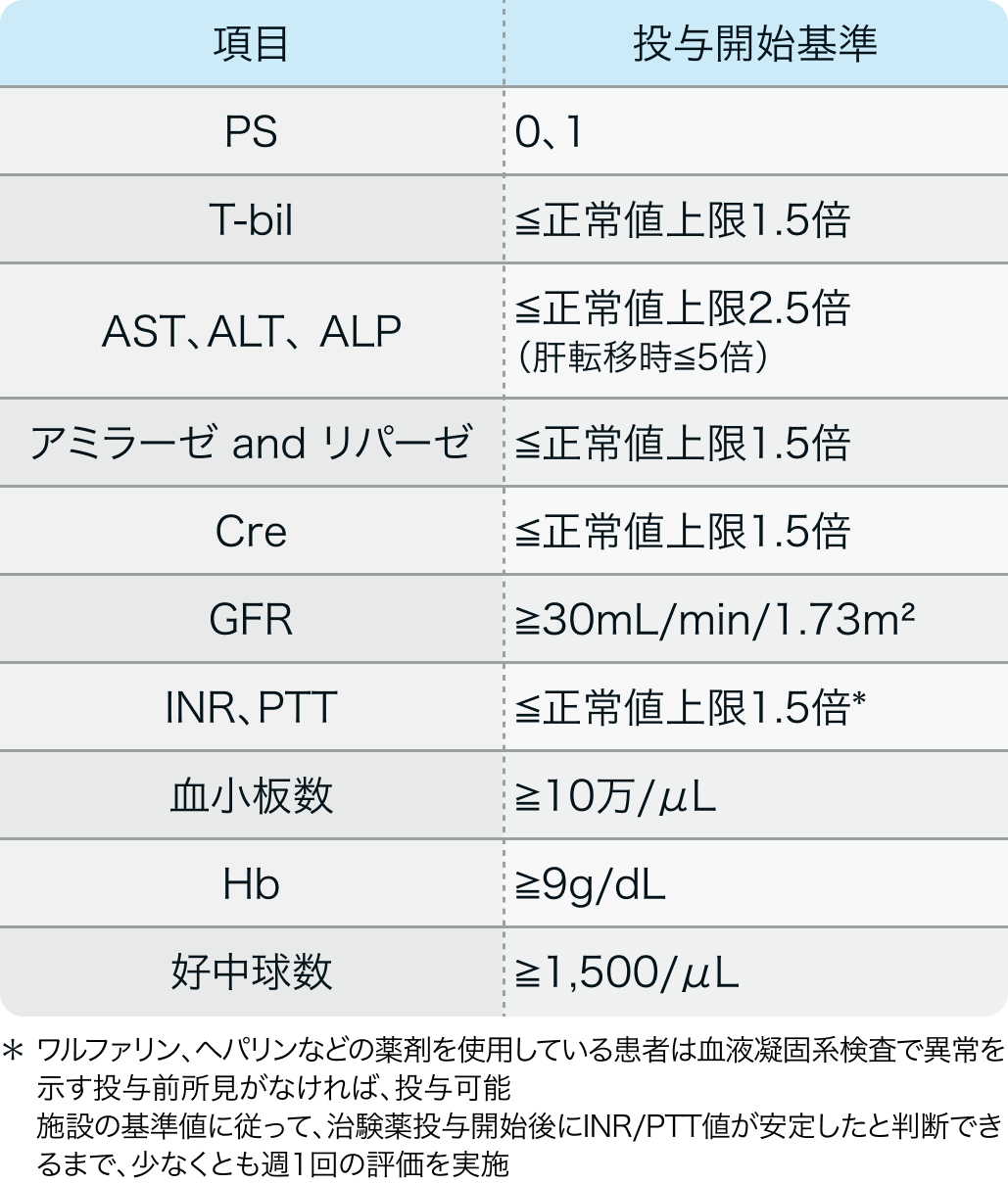
スチバーガ®適正使用ガイド (2020年3月作成)²⁾より作図
減量・休薬・中止基準
電子添文¹⁾の基準

レゴラフェニブはUGT1A1によるグルクロン酸抱合を阻害する。
そのため、 ジルベール症候群の患者においては間接型ビリルビンが上昇することがあり、 ASTまたはALTの上昇を認めた場合はビリルビン値の基準によらず、 上図で規定するASTまたはALTの基準に従う
スチバーガ®適正使用ガイド (2020年3月作成)²⁾より作図
初回基準量と減量レベル

スチバーガ®適正使用ガイド (2020年3月作成)²⁾より作図
出典
- バイエル薬品株式会社. スチバーガ®電子添文 (2024年7月改訂 第4版) [最終閲覧 : 2024/11/29]
- バイエル薬品株式会社. スチバーガ®適正使用ガイド (2024年4月作成 題10版) [最終閲覧 : 2024/11/29]
- Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet. 2013 Jan 26;381(9863):303-12.PMID: 23177514
- Regorafenib dose optimization study (ReDOS): Randomized phase II trial to evaluate dosing strategies for regorafenib in refractory metastatic colorectal cancer (mCRC)—An ACCRU Network study. ASCO-GI2018
最終更新日 : 2024年11月29日
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
Regorafinib
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
マルチキナーゼ阻害薬 レゴラフェニブ
*バイエル薬品株式会社の外部サイトへ遷移します
投与スケジュール
電子添文¹⁾の用法および用量

スチバーガ®電子添文 (2024年7月改訂 第4版)¹⁾より作図
レゴラフェニブ1日1回160mgを食後に3週間連日経口投与し、 その後1週間休薬する。 これを1サイクルとして投与を繰り返す。
特徴と注意点
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
初回投与量と減量について
ReDOS試験⁴⁾などのように初回減量開始で、 週ごとに毒性をみて増量する治療戦略は、 有効であるとする報告が国内外問わず存在しており積極的に検討できる選択肢である。
副作用マネジメントについて
肝機能障害について
肝機能障害の出現を考慮し1-2コースは原則、 毎週血液検査結果をチェックして処方する。
手足皮膚症候群について
手足皮膚症候群の頻度が高いことから、 保湿剤等処方や患者指導を行う。
尿蛋白について
尿蛋白1+出現時は、 次のVISITからのUPCR事前測定を考慮する。 リアルワールドでは、 尿蛋白2+でもUPCR<2.0で投与可能とする医師はいる。
KeyData|臨床試験結果
(1) CORRECT試験³⁾
標準治療後に進行した転移性大腸癌において、 マルチキナーゼ阻害薬レゴラフェニブの効果を、 プラセボを対象に検証した第Ⅲ相ランダム化比較試験CORRECTの結果より、 全生存期間 (OS) および無増悪生存期間 (PFS) の有意な改善が示された。
主な有害事象 (カッコ内はGrade3~4)
- 疲労 47% (10%)
- 下痢 34% (7%)
- 食欲不振 30% (3%)
- 高血圧 28% (7%)
- 発疹/落屑 26% (6%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 手足症候群 47% (17%)
Lancet. 2013 Jan 26;381(9863):303-12³⁾より引用
OS中央値
- レゴラフェニブ群 : 6.4ヵ月
- プラセボ群 : 5.0ヵ月
HR 0.77 (95%CI 0.64-0.94)、 p=0.0052
PFS中央値
- レゴラフェニブ群 : 1.9ヵ月
- プラセボ群 : 1.7ヵ月
HR 0.49 (95%CI 0.42–0.58;)、 p<0·0001
部分奏効 (PR)
- レゴラフェニブ群 : 1.0%
- プラセボ群 : 0.4%
完全奏効 (CR) はなし
p=0.19
病勢コントロール率
- レゴラフェニブ群 : 41%
- プラセボ群 : 15%
p<0.0001
(2) ReDOS試験⁴⁾
標準用量群と低用量で開始後1週間毎に漸増する群との忍容性を比較する多施設共同第II相無作為化非盲検化試験で、 癌研究ネットワークACCRU (Academic and Community Cancer Research United) によって行われた。 18歳以上、 ECOG PS 0/1、 余命3ヵ月以上、 組織学的/細胞学的に結腸/直腸の腺癌と認められ、 標準化学療法 (フッ化ピリミジン系薬剤、 Oxaliplatin、 Irinotecan、 抗VEGF抗体薬、 抗EGFR抗体薬が適格の患者においては抗EGFR抗体薬) 不応となった症例が対象となった。
各プロトコル
投与開始基準
CORRECT試験のプロトコル

スチバーガ®適正使用ガイド (2020年3月作成)²⁾より作図
減量・休薬・中止基準
電子添文¹⁾の基準

レゴラフェニブはUGT1A1によるグルクロン酸抱合を阻害する。
そのため、 ジルベール症候群の患者においては間接型ビリルビンが上昇することがあり、 ASTまたはALTの上昇を認めた場合はビリルビン値の基準によらず、 上図で規定するASTまたはALTの基準に従う
スチバーガ®適正使用ガイド (2020年3月作成)²⁾より作図
初回基準量と減量レベル

スチバーガ®適正使用ガイド (2020年3月作成)²⁾より作図
出典
- バイエル薬品株式会社. スチバーガ®電子添文 (2024年7月改訂 第4版) [最終閲覧 : 2024/11/29]
- バイエル薬品株式会社. スチバーガ®適正使用ガイド (2024年4月作成 題10版) [最終閲覧 : 2024/11/29]
- Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet. 2013 Jan 26;381(9863):303-12.PMID: 23177514
- Regorafenib dose optimization study (ReDOS): Randomized phase II trial to evaluate dosing strategies for regorafenib in refractory metastatic colorectal cancer (mCRC)—An ACCRU Network study. ASCO-GI2018
最終更新日 : 2024年11月29日
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。