2024年9月24日に 「化学療法歴のあるホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌」 を対象として承認、 2024年11月20日薬価収載 (200mg1瓶 18万7195円 /1日 4万4570円)
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
サシツズマブ ゴビテカン (トロデルビ®)
*ギリアド・サイエンシズ株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】21日間
【催吐性】 高度*
【FN発症】中等度 (発症率10~20%)**
*NCCN Guideline Ver 2.2024. Antiemesis
**NCCN Guidelines Ver1.2025. Hematopoietic Growth Factors

1回10mg/kgを21日間で1サイクルとし、 各サイクルの1・8日目に3時間かけて点滴静注
初回投与の忍容性が良好であれば2回目以降は投与時間を1~2時間に短縮可能
タキサン系抗悪性腫瘍剤による治療歴のある患者が投与対象となる。
Key Data|臨床試験結果
📊 ASCENT試験
N Engl J Med. 2021;384(16):1529-1541.
化学療法歴を有するホルモン受容体陰性かつHER2陰性の切除不能または再発乳癌患者529例を対象とした第III相無作為化比較試験。 サシツズマブ ゴビテカン (SG) 群267例と医師選択治療群262例 (エリブリン、 カペシタビン、 ゲムシタビン、 またはビノレルビン) に1:1に割り付け、 主要評価項目は脳転移を認めない患者集団におけるPFSとされた。
【有効性】SG群 (vs 医師選択治療群)
脳転移なし集団 :
- PFS中央値 5.6ヵ月 (vs 1.7ヵ月)
- HR 0.41 (95%CI 0.32–0.52、 p<0.001)
- OS中央値 12.1ヵ月 (vs 6.7ヵ月)
- HR 0.48 (95%CI 0.38–0.59、 p<0.001)
- 奏効率 35% (vs 5%)
- 奏効期間中央値 6.3ヵ月 (vs 3.6ヵ月)
全体集団 :
PFS中央値 4.8ヵ月 (vs 1.7ヵ月)
- HR 0.43 (95%CI 0.35–0.54)
- OS中央値 11.8ヵ月 (vs 6.9ヵ月)
- HR 0.51 (95%CI 0.41–0.62)
- 奏効率 31% (vs 4%)
- 奏効期間中央値 6.3ヵ月 (vs 3.6ヵ月)
【安全性】主な有害事象 : 全Grade (Grade≧3)
- 好中球減少 63% (50%)
- 貧血 34% (8%)
- 白血球減少 16% (10%)
- 血小板減少 5% (1%)
- 発熱性好中球減少 6% (6%)
- 下痢 59% (10%)
- 悪心 57% (2%)
- 嘔吐 29% (1%)
- 便秘 17% (0%)
- 腹痛 11% (1%)
- 脱毛 46% (0%)
- 倦怠感 45% (3%)
- 食欲減退 20% (2%)
- 感染症 12% (2%)
- 神経障害 25% (<1%)
- 呼吸器・縦隔障害 16% (2%)
- 筋骨格・結合組織障害 12% (0%)
各プロトコル
適格基準
ASCENT試験³⁾の主な適格基準
- 18歳以上
- ECOG PS 0–1
- 前治療レジメン数が2以上
- タキサン系薬剤による治療歴あり
- 好中球数≧1,500/mm³
- 血小板数 ≧10万/mm³
- ヘモグロビン≧9.0g/dL
- 腎機能 : CrCl>60mL/min
- 肝機能 : T-Bil≦1.5×ULN、 AST/ALT≦3×ULN
用量レベル
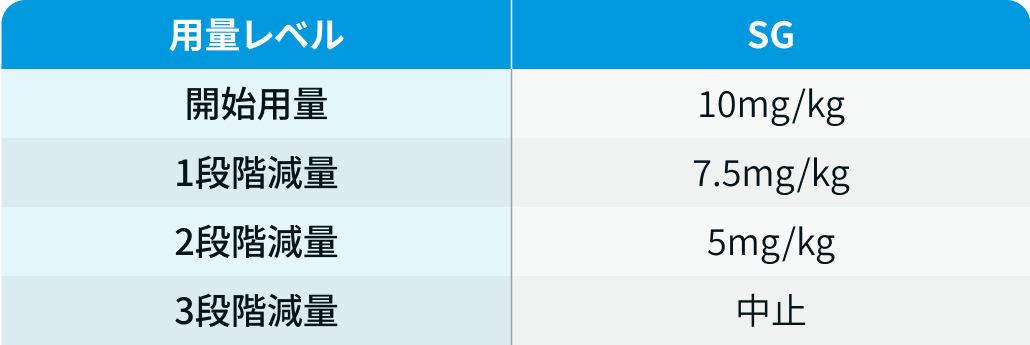
トロデルビ®電子添文情報¹⁾を基に編集部作成
投与開始基準

有害事象発現時の減量・休薬・中止基準
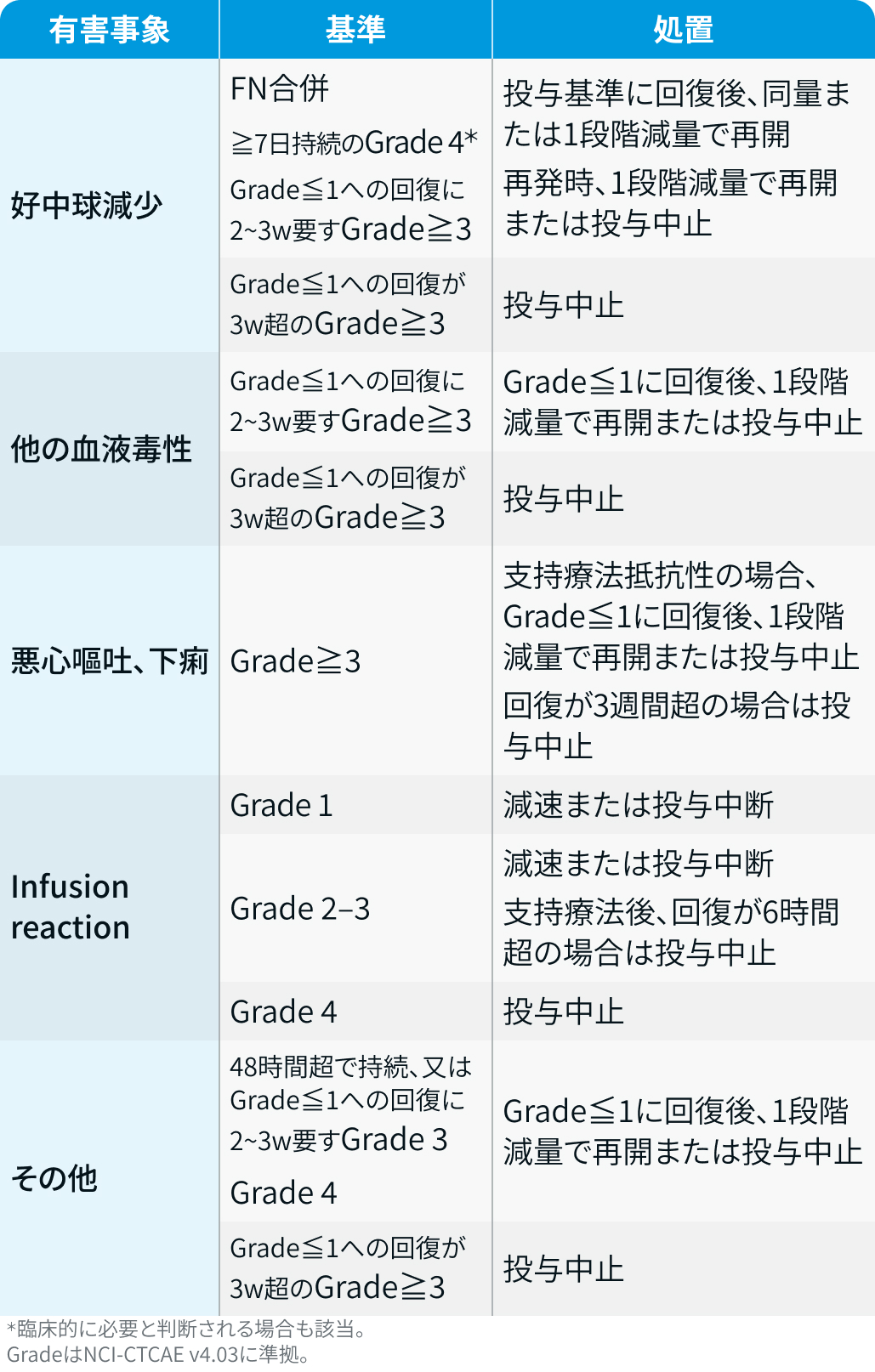
トロデルビ®電子添文情報¹⁾を基に編集部作成
レジメンの特徴と注意点
本レジメンは、 化学療法歴があり、 タキサン系抗悪性腫瘍剤による治療歴を有するホルモン受容体陰性かつHER2陰性の手術不能または再発乳癌に適用される。
作用機序
サシツズマブ ゴビテカンは、 TROP-2に対するヒト化モノクローナル抗体に、 トポイソメラーゼI阻害薬SN-38をリンカーで結合させた抗体薬物複合体である。 TROP-2陽性腫瘍細胞に取り込まれた後、 SN-38が細胞内で遊離し、 DNA合成を阻害して抗腫瘍効果を発揮する。
UGT1A1遺伝子多型を有する患者
UGT1A1 (本剤を構成するSN-38の主な代謝酵素) によるSN-38の代謝が減少し、 重篤な副作用が発現する可能性がある。 以下に臨床試験の報告例を示す。
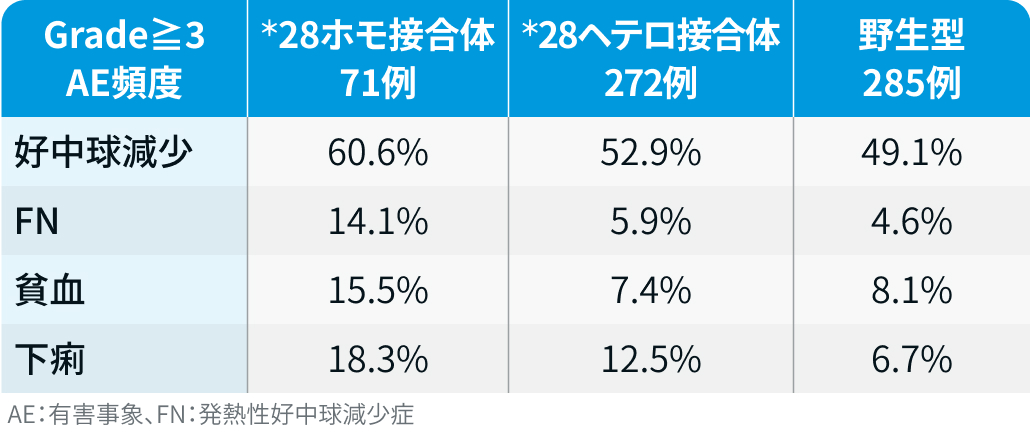
UGT1A1*6または*28のホモ接合体、 あるいは両アレルの複合ヘテロ接合体を有する患者では、 SN-38の代謝が低下し、 骨髄抑制や下痢などの重篤な副作用のリスクがあるため、 十分に注意すること。
トロデルビ®電子添文情報¹⁾を基に編集部作成
薬剤師からのワンポイントアドバイス
NTT東日本関東病院薬剤部 兼平暖先生
2025年5月現在、 ホルモン受容体陽性/HER2陰性乳癌に対しても承認申請中であり (TROPiCS-02試験、 ASCENTJ02試験)、 進行トリプルネガティブ乳癌における1次治療としては、 PD-L1発現陽性例に対するペムブロリズマブ併用 (ASCENT-04/KEYNOTE-D19試験) およびPD-L1陰性例に対する単剤投与 (ASCENT-03試験) でPFS延長が報告されている。
催吐性リスクは、 日本の制吐薬ガイドライン (2023年版) では中等度、 NCCNガイドラインでは高度に分類されている。
発熱性好中球減少症はASCENT試験で5.8%に認められ、 G-CSF製剤の使用はリスク因子や好中球減少症の発現状況に応じて検討される。
UGT1A1*28/*28型患者ではGrade≧3の好中球減少症、 発熱性好中球減少症、 貧血、 下痢などの発現率が高い傾向にあるが、 有害事象発現との明確な関連は確立しておらず、 遺伝子多型検査は必須とはされていない。
レジメン適用時の注意事項
骨髄抑制・感染症 : 投与前後に定期的な血液検査を行い、 必要に応じてG-CSF製剤の使用を検討する。 以下の患者では初回から1次予防投与を考慮する。
- 65歳以上
- 好中球減少症の既往
- PS不良
- 腎・肝・心機能障害
- 複数の合併症
トロデルビ®電子添文情報¹⁾を基に編集部作成
Infusion reaction : 重度の反応に備え緊急対応体制下で投与し、 予防のために解熱鎮痛剤・抗ヒスタミン薬・H₂受容体拮抗薬の前投与を考慮。
治験時には、 必要に応じてコルチコステロイドの前投与も許容されていた。
間質性肺疾患 : 投与時は呼吸困難・咳嗽・発熱などの初期症状に留意し、 定期的に胸部画像検査を実施。
RMP【重要な特定されたリスク】
トロデルビ® 医薬品リスク管理計画書 (RMP)
- 骨髄抑制
- 感染症
- 重度の下痢・腸炎
- Infusion reaction
- 間質性肺疾患
出典
1) ギリアド・サイエンシズ株式会社. トロデルビ®添付文書 2025年11月作成 第2版
2) ギリアド・サイエンシズ株式会社. トロデルビ®適正使用ガイド 2024年11月作成
3) N Engl J Med. 2021;384(16):1529-1541.
最終更新 : 2025年11月11日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : HOKUTO編集部監修医師
SG (Sacituzumab govitecan)
2024年9月24日に 「化学療法歴のあるホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌」 を対象として承認、 2024年11月20日薬価収載 (200mg1瓶 18万7195円 /1日 4万4570円)
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
サシツズマブ ゴビテカン (トロデルビ®)
*ギリアド・サイエンシズ株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】21日間
【催吐性】 高度*
【FN発症】中等度 (発症率10~20%)**
*NCCN Guideline Ver 2.2024. Antiemesis
**NCCN Guidelines Ver1.2025. Hematopoietic Growth Factors

1回10mg/kgを21日間で1サイクルとし、 各サイクルの1・8日目に3時間かけて点滴静注
初回投与の忍容性が良好であれば2回目以降は投与時間を1~2時間に短縮可能
タキサン系抗悪性腫瘍剤による治療歴のある患者が投与対象となる。
Key Data|臨床試験結果
📊 ASCENT試験
N Engl J Med. 2021;384(16):1529-1541.
化学療法歴を有するホルモン受容体陰性かつHER2陰性の切除不能または再発乳癌患者529例を対象とした第III相無作為化比較試験。 サシツズマブ ゴビテカン (SG) 群267例と医師選択治療群262例 (エリブリン、 カペシタビン、 ゲムシタビン、 またはビノレルビン) に1:1に割り付け、 主要評価項目は脳転移を認めない患者集団におけるPFSとされた。
【有効性】SG群 (vs 医師選択治療群)
脳転移なし集団 :
- PFS中央値 5.6ヵ月 (vs 1.7ヵ月)
- HR 0.41 (95%CI 0.32–0.52、 p<0.001)
- OS中央値 12.1ヵ月 (vs 6.7ヵ月)
- HR 0.48 (95%CI 0.38–0.59、 p<0.001)
- 奏効率 35% (vs 5%)
- 奏効期間中央値 6.3ヵ月 (vs 3.6ヵ月)
全体集団 :
PFS中央値 4.8ヵ月 (vs 1.7ヵ月)
- HR 0.43 (95%CI 0.35–0.54)
- OS中央値 11.8ヵ月 (vs 6.9ヵ月)
- HR 0.51 (95%CI 0.41–0.62)
- 奏効率 31% (vs 4%)
- 奏効期間中央値 6.3ヵ月 (vs 3.6ヵ月)
【安全性】主な有害事象 : 全Grade (Grade≧3)
- 好中球減少 63% (50%)
- 貧血 34% (8%)
- 白血球減少 16% (10%)
- 血小板減少 5% (1%)
- 発熱性好中球減少 6% (6%)
- 下痢 59% (10%)
- 悪心 57% (2%)
- 嘔吐 29% (1%)
- 便秘 17% (0%)
- 腹痛 11% (1%)
- 脱毛 46% (0%)
- 倦怠感 45% (3%)
- 食欲減退 20% (2%)
- 感染症 12% (2%)
- 神経障害 25% (<1%)
- 呼吸器・縦隔障害 16% (2%)
- 筋骨格・結合組織障害 12% (0%)
各プロトコル
適格基準
ASCENT試験³⁾の主な適格基準
- 18歳以上
- ECOG PS 0–1
- 前治療レジメン数が2以上
- タキサン系薬剤による治療歴あり
- 好中球数≧1,500/mm³
- 血小板数 ≧10万/mm³
- ヘモグロビン≧9.0g/dL
- 腎機能 : CrCl>60mL/min
- 肝機能 : T-Bil≦1.5×ULN、 AST/ALT≦3×ULN
用量レベル

トロデルビ®電子添文情報¹⁾を基に編集部作成
投与開始基準

有害事象発現時の減量・休薬・中止基準

トロデルビ®電子添文情報¹⁾を基に編集部作成
レジメンの特徴と注意点
本レジメンは、 化学療法歴があり、 タキサン系抗悪性腫瘍剤による治療歴を有するホルモン受容体陰性かつHER2陰性の手術不能または再発乳癌に適用される。
作用機序
サシツズマブ ゴビテカンは、 TROP-2に対するヒト化モノクローナル抗体に、 トポイソメラーゼI阻害薬SN-38をリンカーで結合させた抗体薬物複合体である。 TROP-2陽性腫瘍細胞に取り込まれた後、 SN-38が細胞内で遊離し、 DNA合成を阻害して抗腫瘍効果を発揮する。
UGT1A1遺伝子多型を有する患者
UGT1A1 (本剤を構成するSN-38の主な代謝酵素) によるSN-38の代謝が減少し、 重篤な副作用が発現する可能性がある。 以下に臨床試験の報告例を示す。

UGT1A1*6または*28のホモ接合体、 あるいは両アレルの複合ヘテロ接合体を有する患者では、 SN-38の代謝が低下し、 骨髄抑制や下痢などの重篤な副作用のリスクがあるため、 十分に注意すること。
トロデルビ®電子添文情報¹⁾を基に編集部作成
薬剤師からのワンポイントアドバイス
NTT東日本関東病院薬剤部 兼平暖先生
2025年5月現在、 ホルモン受容体陽性/HER2陰性乳癌に対しても承認申請中であり (TROPiCS-02試験、 ASCENTJ02試験)、 進行トリプルネガティブ乳癌における1次治療としては、 PD-L1発現陽性例に対するペムブロリズマブ併用 (ASCENT-04/KEYNOTE-D19試験) およびPD-L1陰性例に対する単剤投与 (ASCENT-03試験) でPFS延長が報告されている。
催吐性リスクは、 日本の制吐薬ガイドライン (2023年版) では中等度、 NCCNガイドラインでは高度に分類されている。
発熱性好中球減少症はASCENT試験で5.8%に認められ、 G-CSF製剤の使用はリスク因子や好中球減少症の発現状況に応じて検討される。
UGT1A1*28/*28型患者ではGrade≧3の好中球減少症、 発熱性好中球減少症、 貧血、 下痢などの発現率が高い傾向にあるが、 有害事象発現との明確な関連は確立しておらず、 遺伝子多型検査は必須とはされていない。
レジメン適用時の注意事項
骨髄抑制・感染症 : 投与前後に定期的な血液検査を行い、 必要に応じてG-CSF製剤の使用を検討する。 以下の患者では初回から1次予防投与を考慮する。
- 65歳以上
- 好中球減少症の既往
- PS不良
- 腎・肝・心機能障害
- 複数の合併症
トロデルビ®電子添文情報¹⁾を基に編集部作成
Infusion reaction : 重度の反応に備え緊急対応体制下で投与し、 予防のために解熱鎮痛剤・抗ヒスタミン薬・H₂受容体拮抗薬の前投与を考慮。
治験時には、 必要に応じてコルチコステロイドの前投与も許容されていた。
間質性肺疾患 : 投与時は呼吸困難・咳嗽・発熱などの初期症状に留意し、 定期的に胸部画像検査を実施。
RMP【重要な特定されたリスク】
トロデルビ® 医薬品リスク管理計画書 (RMP)
- 骨髄抑制
- 感染症
- 重度の下痢・腸炎
- Infusion reaction
- 間質性肺疾患
出典
1) ギリアド・サイエンシズ株式会社. トロデルビ®添付文書 2025年11月作成 第2版
2) ギリアド・サイエンシズ株式会社. トロデルビ®適正使用ガイド 2024年11月作成
3) N Engl J Med. 2021;384(16):1529-1541.
最終更新 : 2025年11月11日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : HOKUTO編集部監修医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。