Bmab:ベバシズマブ(アバスチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 5mg/kg 点滴 | 1~ | Day1 |
CPT-11:イリノテカン塩酸塩水和物(トポテシン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 150~180mg/m² 点滴 | 1~ | Day1 |
l-LV:レボホリナートカルシウム(アイソボリン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg/m² 点滴 | 1~ | Day1 |
5-FU:フルオロウラシル(フルオロウラシル®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 400mg/m² 急速静注 | 1~ | Day1 |
| 2400mg/m² 持続静注 | 1~ | Day1~3 |
その他
| 1コース14日間。 |
| CPT-11+l-LV+5-FUをFOLFIRIと呼ぶ。 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
- 5-FU® (添付文書¹⁾)
代謝拮抗薬 フルオロウラシル
- アイソボリン®など (添付文書²⁾)
活性型葉酸製剤 レボホリナート
- トポテシン®など (添付文書³⁾)
DNAトポイソメラーゼ1阻害薬 イリノテカン
抗VEGFヒト化モノクローナル抗体 ベバシズマブ
*中外製薬の外部サイトへ遷移します
投与スケジュール
WJOG4407G試験⁶⁾のプロトコル
【1コース】14日間
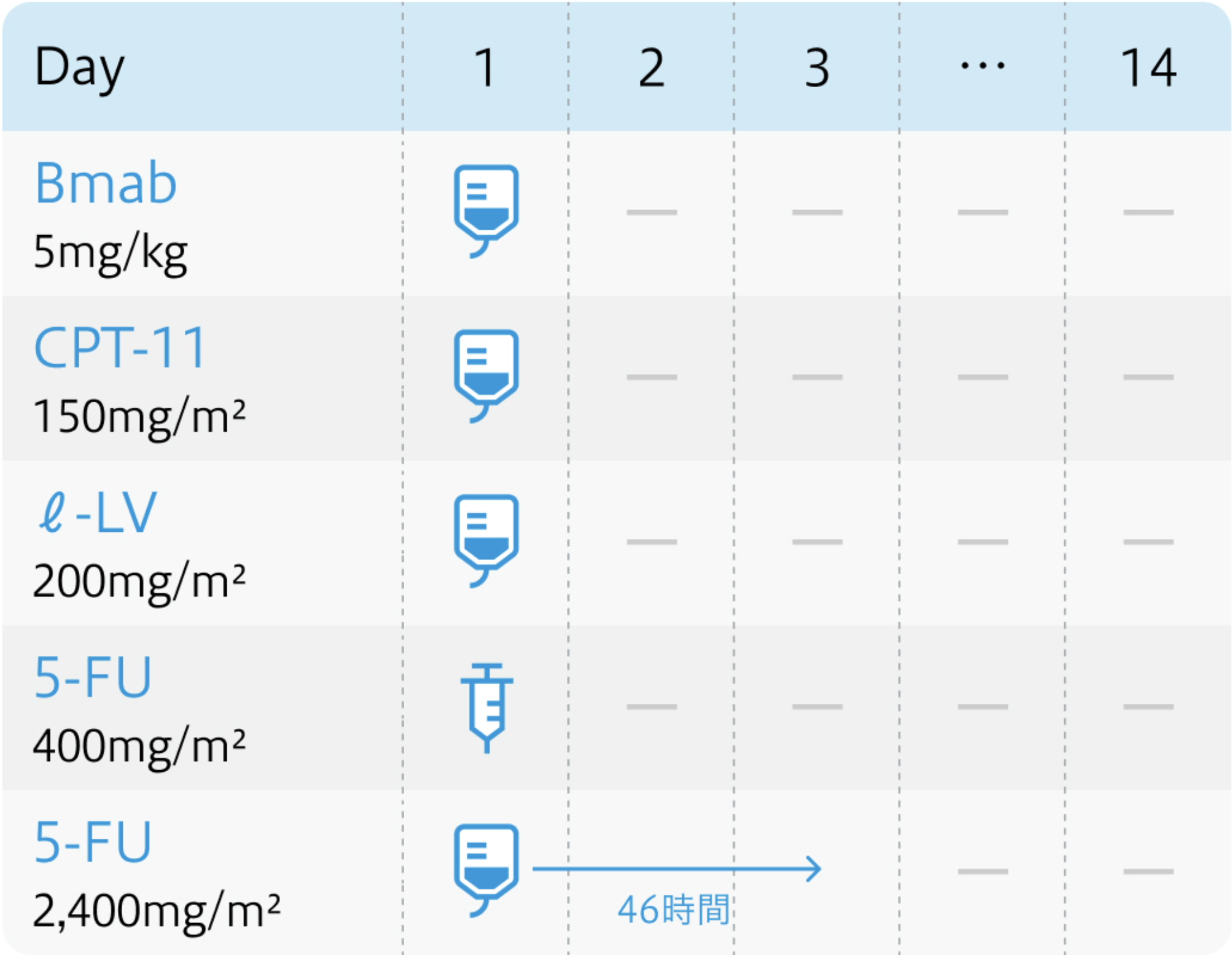
※イリノテカンや5-FU用量については次項参照
Ann Oncol. 2016 Aug;27(8):1539-46⁶⁾より作図
特徴と注意点
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
開始基準について
一般的には好中球数≧1,500/μLが投与開始基準となっているが、 前治療の骨髄抑制が軽微だった場合など、 毒性が軽度だろうと予想できる場合には好中球数1,200/μL前後でも投与可能とする医師はいる。
5-FUの用量について
前治療でフッ化ピリミジンを含んだレジメンを使用後の2次治療として使用する際には、 必ずしも5-FUは必要ではない。 そのため、 毒性による減量を考慮する場合には5-FUを優先して減量・中止することを考慮する。
イリノテカンの用量について
イリノテカン180mg/m²でレジメン登録をされている施設もあると考えられるためオーダーする際には体表面積あたりの設定用量を確認すること。 国内試験の結果から実際は150mg/m²で投与されることが多い。 180mg/m²で使用する場合にはUGT1A1遺伝子多型検査の結果を確認すること。
治療ラインについて
一般的に2次治療で用いられることが多い。 術後補助化学療法CAPOX/FOLFOX後の早期再発例や、 再発時にCIPN残存例でも第一選択となる。 2次治療として用いる場合は、 前治療における毒性と減量薬剤を考慮した初回用量設定を行う。
制吐薬について
若年・女性など、 悪心リスクが高い患者には、 初回投与時から選択的NK1受容体拮抗型制吐剤を前投薬として用いることを検討する。
尿蛋白について
ベバシズマブによる尿蛋白1+出現時には、 次コースからのUPCRの事前測定を考慮する。 リアルワールドでは、 尿蛋白2+でもUPCR<2.0で投与可能とする医師はいる。
各プロトコル
投与開始基準
WJOG4407G試験⁶⁾のプロトコル
FOLFIRI療法の投与開始基準

Bmabの投与開始基準

Ann Oncol. 2016 Aug;27(8):1539-46⁶⁾より作図
FOLFIRI療法の投与開始基準を満たさない場合 : FOLFIRI、 Bmabとも投与延期
Bmabの投与開始基準を満たさない場合 : FOLFIRIのみ投与。 次回のBmab投与はFOLFIRI療法に合わせ、 Bmab単独投与はしない
Ann Oncol. 2016 Aug;27(8):1539-46⁶⁾より引用
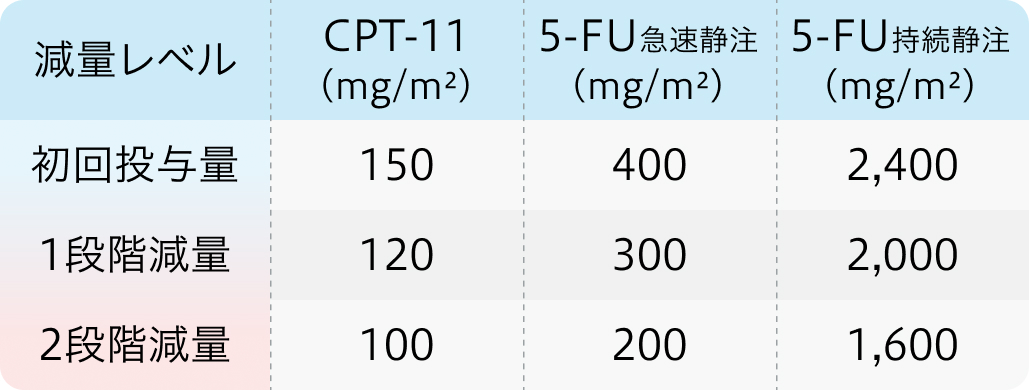
減量・中止基準
WJOG4407G試験⁶⁾のプロトコル
CPT-11、 5-FUの減量基準

初回基準量と減量レベル
Bmabの中止基準

Ann Oncol. 2016 Aug;27(8):1539-46⁶⁾より作図
関連する臨床試験
WJOG4407G試験⁶⁾
Ann Oncol. 2016 Aug;27(8):1539-46.
切除不能進行・再発大腸癌に対する1st-lineとして、 FOLFIRI+BevのmFOLFOX6+Bevに対する無増悪生存期間 (PFS) における非劣性及び長期QOLを検討する第III相試験。 主要評価項目はPFS、 副次評価項目は全生存期間 (OS)、 TTF (time to treatment failure)、 奏効率、 治癒切除を受けた患者の割合、 有害事象、 QOLである。
主な有害事象 (カッコ内はGrade3~4)
- 白血球減少症 80.5% (11.3%)
- 好中球減少症 88.2% (45.6%)
- 発熱性好中球減少症 5.1% (5.1%)
- 血小板減少症 3.6% (0.5%)
- 貧血 78.5% (45.1%)
- 倦怠感 74.9% (5.6%)
- 悪心 73.3% (6.7%)
- 粘膜炎 55.9% (2.6%)
- 下痢 54.4% (8.7%)
- 嘔吐 42.1% (4.6%)
- 発熱 17.9% (1.0%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 脱毛症 65.1% (0%)
- 高血圧 43.1% (3.1%)
- 蛋白尿 39.5% (0%)
- 手足症候群 23.6% (0.5%)
- 感覚神経障害 21.5% (0%)
Ann Oncol. 2016 Aug;27(8):1539-46⁶⁾より引用
出典
- 協和キリン株式会社. 5-FU®電子添文 (2024年6月改訂 第4版) [最終閲覧 : 2024/12/06]
- ファイザー・ファーマ株式会社. アイソボリン®電子添文 (2023年3月改訂 第1版) [最終閲覧 : 2024/12/06]
- アルフレッサ ファーマ株式会社. トポテシン®電子添文 (2023年8月改訂 第1版) [最終閲覧 : 2024/12/06]
- 中外製薬株式会社. アバスチン®電子添文 (2024年3月改訂 第5版) [最終閲覧 : 2024/12/06]
- 中外製薬株式会社. アバスチン®適正使用ガイド 結腸・直腸癌 (2023年11月改訂) [最終閲覧 : 2024/12/06]
- Randomized phase III study of bevacizumab plus FOLFIRI and bevacizumab plus mFOLFOX6 as first-line treatment for patients with metastatic colorectal cancer (WJOG4407G). Ann Oncol. 2016 Aug;27(8):1539-46. PMID: 27177863
最終更新日 : 2024年12月6日
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
FOLFIRI + Bmab
Bmab:ベバシズマブ(アバスチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 5mg/kg 点滴 | 1~ | Day1 |
CPT-11:イリノテカン塩酸塩水和物(トポテシン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 150~180mg/m² 点滴 | 1~ | Day1 |
l-LV:レボホリナートカルシウム(アイソボリン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg/m² 点滴 | 1~ | Day1 |
5-FU:フルオロウラシル(フルオロウラシル®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 400mg/m² 急速静注 | 1~ | Day1 |
| 2400mg/m² 持続静注 | 1~ | Day1~3 |
その他
| 1コース14日間。 |
| CPT-11+l-LV+5-FUをFOLFIRIと呼ぶ。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
- 5-FU® (添付文書¹⁾)
代謝拮抗薬 フルオロウラシル
- アイソボリン®など (添付文書²⁾)
活性型葉酸製剤 レボホリナート
- トポテシン®など (添付文書³⁾)
DNAトポイソメラーゼ1阻害薬 イリノテカン
抗VEGFヒト化モノクローナル抗体 ベバシズマブ
*中外製薬の外部サイトへ遷移します
投与スケジュール
WJOG4407G試験⁶⁾のプロトコル
【1コース】14日間

※イリノテカンや5-FU用量については次項参照
Ann Oncol. 2016 Aug;27(8):1539-46⁶⁾より作図
特徴と注意点
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
開始基準について
一般的には好中球数≧1,500/μLが投与開始基準となっているが、 前治療の骨髄抑制が軽微だった場合など、 毒性が軽度だろうと予想できる場合には好中球数1,200/μL前後でも投与可能とする医師はいる。
5-FUの用量について
前治療でフッ化ピリミジンを含んだレジメンを使用後の2次治療として使用する際には、 必ずしも5-FUは必要ではない。 そのため、 毒性による減量を考慮する場合には5-FUを優先して減量・中止することを考慮する。
イリノテカンの用量について
イリノテカン180mg/m²でレジメン登録をされている施設もあると考えられるためオーダーする際には体表面積あたりの設定用量を確認すること。 国内試験の結果から実際は150mg/m²で投与されることが多い。 180mg/m²で使用する場合にはUGT1A1遺伝子多型検査の結果を確認すること。
治療ラインについて
一般的に2次治療で用いられることが多い。 術後補助化学療法CAPOX/FOLFOX後の早期再発例や、 再発時にCIPN残存例でも第一選択となる。 2次治療として用いる場合は、 前治療における毒性と減量薬剤を考慮した初回用量設定を行う。
制吐薬について
若年・女性など、 悪心リスクが高い患者には、 初回投与時から選択的NK1受容体拮抗型制吐剤を前投薬として用いることを検討する。
尿蛋白について
ベバシズマブによる尿蛋白1+出現時には、 次コースからのUPCRの事前測定を考慮する。 リアルワールドでは、 尿蛋白2+でもUPCR<2.0で投与可能とする医師はいる。
各プロトコル
投与開始基準
WJOG4407G試験⁶⁾のプロトコル
FOLFIRI療法の投与開始基準

Bmabの投与開始基準

Ann Oncol. 2016 Aug;27(8):1539-46⁶⁾より作図
FOLFIRI療法の投与開始基準を満たさない場合 : FOLFIRI、 Bmabとも投与延期
Bmabの投与開始基準を満たさない場合 : FOLFIRIのみ投与。 次回のBmab投与はFOLFIRI療法に合わせ、 Bmab単独投与はしない
Ann Oncol. 2016 Aug;27(8):1539-46⁶⁾より引用
減量・中止基準
WJOG4407G試験⁶⁾のプロトコル
CPT-11、 5-FUの減量基準

初回基準量と減量レベル

Bmabの中止基準

Ann Oncol. 2016 Aug;27(8):1539-46⁶⁾より作図
関連する臨床試験
WJOG4407G試験⁶⁾
Ann Oncol. 2016 Aug;27(8):1539-46.
切除不能進行・再発大腸癌に対する1st-lineとして、 FOLFIRI+BevのmFOLFOX6+Bevに対する無増悪生存期間 (PFS) における非劣性及び長期QOLを検討する第III相試験。 主要評価項目はPFS、 副次評価項目は全生存期間 (OS)、 TTF (time to treatment failure)、 奏効率、 治癒切除を受けた患者の割合、 有害事象、 QOLである。
主な有害事象 (カッコ内はGrade3~4)
- 白血球減少症 80.5% (11.3%)
- 好中球減少症 88.2% (45.6%)
- 発熱性好中球減少症 5.1% (5.1%)
- 血小板減少症 3.6% (0.5%)
- 貧血 78.5% (45.1%)
- 倦怠感 74.9% (5.6%)
- 悪心 73.3% (6.7%)
- 粘膜炎 55.9% (2.6%)
- 下痢 54.4% (8.7%)
- 嘔吐 42.1% (4.6%)
- 発熱 17.9% (1.0%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 脱毛症 65.1% (0%)
- 高血圧 43.1% (3.1%)
- 蛋白尿 39.5% (0%)
- 手足症候群 23.6% (0.5%)
- 感覚神経障害 21.5% (0%)
Ann Oncol. 2016 Aug;27(8):1539-46⁶⁾より引用
出典
- 協和キリン株式会社. 5-FU®電子添文 (2024年6月改訂 第4版) [最終閲覧 : 2024/12/06]
- ファイザー・ファーマ株式会社. アイソボリン®電子添文 (2023年3月改訂 第1版) [最終閲覧 : 2024/12/06]
- アルフレッサ ファーマ株式会社. トポテシン®電子添文 (2023年8月改訂 第1版) [最終閲覧 : 2024/12/06]
- 中外製薬株式会社. アバスチン®電子添文 (2024年3月改訂 第5版) [最終閲覧 : 2024/12/06]
- 中外製薬株式会社. アバスチン®適正使用ガイド 結腸・直腸癌 (2023年11月改訂) [最終閲覧 : 2024/12/06]
- Randomized phase III study of bevacizumab plus FOLFIRI and bevacizumab plus mFOLFOX6 as first-line treatment for patients with metastatic colorectal cancer (WJOG4407G). Ann Oncol. 2016 Aug;27(8):1539-46. PMID: 27177863
最終更新日 : 2024年12月6日
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
