本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
BRAF阻害薬 ダブラフェニブ
MEK阻害薬 トラメチニブ
*ノバルティス ファーマ株式会社の外部サイトへ遷移します
用法用量
電子添文¹⁾³⁾の用法および用量
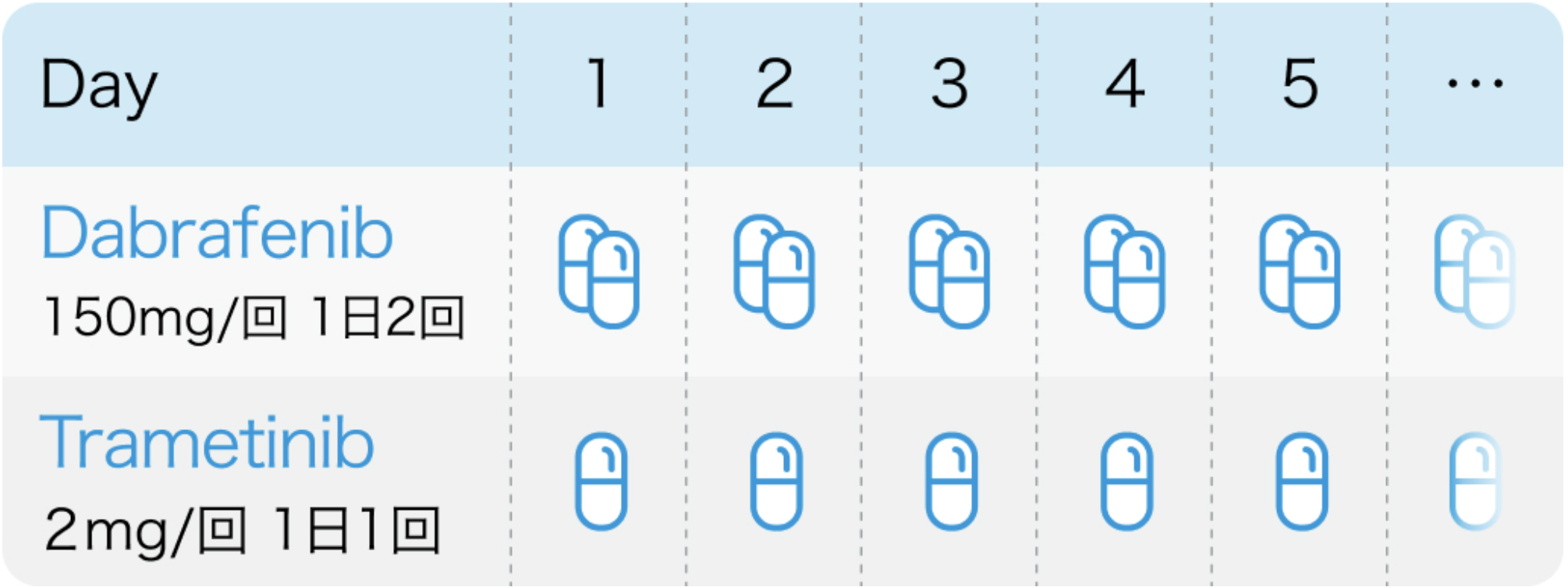
タフィンラー®電子添文 (2024年11月改訂 第6版)¹⁾、メキニスト®電子添文 (2024年11月改訂 第6版)³⁾より作図
※術後補助療法の場合、 投与は12ヵ月まで
※食事1時間前~食後2時間までの服用は避ける
食後投与で、 Cmax及びAUCが低下するとの報告あり
減量・休薬・中止基準
ダブラフェニブ、トラメチニブ電子添文¹⁾³⁾の基準

ただし、 有棘細胞癌 (皮膚の扁平上皮癌) 又は新たな原発性悪性黒色腫が発現した場合には、 外科的切除等の適切な処置を行った上で、 休薬、 減量することなく治療を継続することができる。
タフィンラー®、メキニスト®電子添文¹⁾³⁾より作図、引用
用量調節の目安
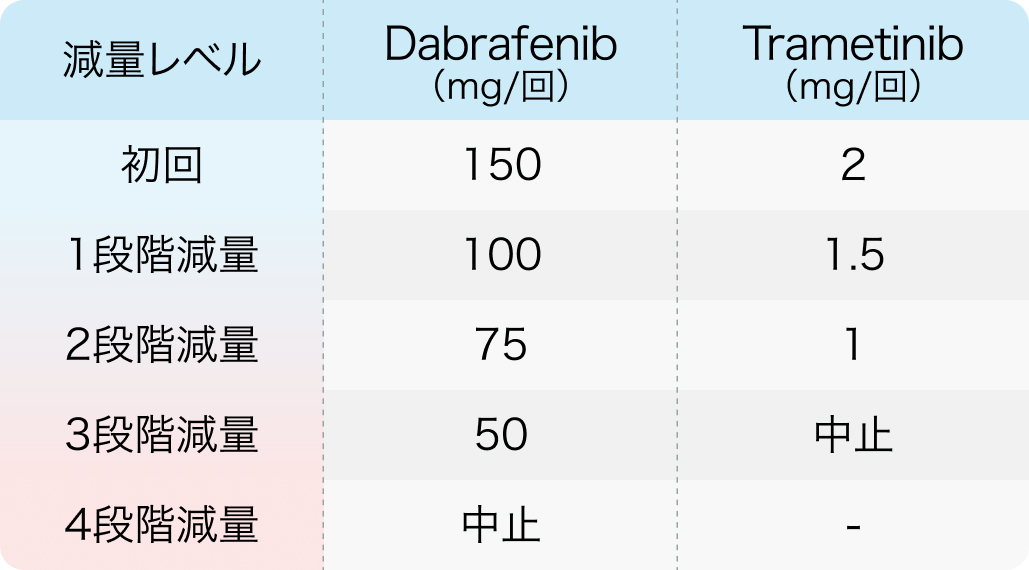
タフィンラー®、メキニスト®電子添文¹⁾³⁾より作図
エキスパートによるワンポイント
悪性黒色腫患者に対する適応と機序
BRAFV600遺伝子変異を有する根治切除不能な悪性黒色腫患者に用いられる。
💊 ダブラフェニブ
BRAF変異型のキナーゼ活性を阻害し、 BRAF V600変異を有する腫瘍の増殖を抑制する。 一方シグナル伝達がBRAFを介さない迂回経路になることでMEK、 ERKを再活性化しシグナル伝達が急速に回復するという薬剤耐性獲得機序が知られている。
ダブラフェニブ1回150㎎を1日2回内服。食事1時間前~食後2時間までの間の服用は避ける。
💊 トラメチニブ
MEK1と2の活性化とキナーゼ活性を阻害しBRAF V600変異を有す腫瘍の増殖を抑制する。
トラメチニブ1回2㎎を1日1回内服。 食事1時間前~食後2時間までの間の服用は避ける。
これら2剤の併用療法によってBRAF、 MEKという二つの作用点を阻害することで強力に腫瘍増殖を阻害し、 薬剤耐性発現を遅らせると考えられている。 このような理由で、 通常は単剤ではなく2剤の併用療法が行われる。
国際第III相試験 (COMBI-v試験)⁵⁾の結果
BRAFV600遺伝子変異陽性根治切除不能Ⅲ期/Ⅳ期悪性黒色腫を対象に、 ベムラフェニブ単剤群と比較して、 ダブラフェニブ・トラメチニブ併用群は全生存期間 (OS) および無増悪生存期間 (PFS) を有意に延長し、 有意に高い奏効率 (ORR)、 奏功期間中央値 (mDOR) を示した。
併用療法群 vs ベムラフェニブ単剤群
- mOS :25.6ヵ月 vs 18.0ヵ月
- mPFS :11.4ヵ月 vs 7.3ヵ月
- ORR :64% vs 51%
- mDOR:13.8ヵ月 vs 7.5ヵ月
国際第III相試験 (COMBI-d試験)⁶⁾の結果
BRAFV600遺伝子変異陽性根治切除不能Ⅲ期/Ⅳ期悪性黒色腫を対象にダブラフェニブ単剤群と比較してダブラフェニブ・トラメチニブ併用群はOSおよびPFSを有意に延長し、 有意に高いORRとmDORを示した。
併用療法群 vs ダブラフェニブ単剤群
- mOS :25.1ヵ月 vs 18.7ヵ月
- mPFS :11.0ヵ月 vs 8.8ヵ月
- ORR :69% vs 53%
- mDOR:12.9ヵ月 vs 10.6ヵ月
COMBI-d+v併合解析の有害事象と対処法
有害事象
ダブラフェニブ・トラメチニブ併用療法群の98% (548/559例) に認められた。 主なものは、 発熱325例 (58%)、 悪心207例 (37%)、 下痢199例 (36%) 等であった。 本試験において副作用による死亡例は認められなかった⁶⁾。
重篤な有害事象
ダブラフェニブ・トラメチニブ併用療法群の271例 (48%) に認められた。 主なものは、 発熱91例、 駆出率減少44例、 寒気24例等であった⁷⁾。
投与中止に至った有害事象
ダブラフェニブ・トラメチニブ併用療法群の99例 (18%) に認められた。 主なものは、 発熱23例、 駆出率減少21例、 ALT上昇7例等であった⁷⁾。
N Engl J Med. 2019 Aug 15;381(7):626-636⁶⁾より引用
このことから、 定期的な心電図検査、 心臓超音波検査が必要である。
その他の注意点と対応
ダブラフェニブの特殊な有害事象として有棘細胞癌が20%にみられたがトラメチニブとの併用で3%に減少した。 皮膚所見に注意を要する⁷⁾。
N Engl J Med. 2012 Nov 1;367(18):1694-703⁷⁾より引用
副作用発現時には各薬剤の電子添文に記載の基準を参考に休薬、 減量、 中止する。 ただし有棘細胞癌など皮膚悪性腫瘍が発生した場合には切除など適切な処置を行った上で休薬、 減量を行わず治療を継続することができる。
副作用の中でも特に発熱で治療の継続が困難になることが知られており、 発熱のコントロールに関するガイドラインが存在する。
監修 : 国立がん研究センター中央病院皮膚腫瘍科長 山崎直也先生
主な有害事象
COMBI-v試験⁶⁾
主な有害事象 (カッコ内はGrade3)
- 発熱 52.6% (4.3%)
- 悪心 34.6% (0.3%)
- 下痢 32.0% (1.1%)
- 悪寒 31.4% (0.9%)
- 嘔吐 28.9% (1.1%)
- 関節痛 24.0% (0.9%)
- 発疹 21.7% (1.1 %)
- 脱毛 5.7% (0%)
- 手足症候群 4.0% (0%)
- 角化症 4.3% (0%)
- 皮膚乳頭腫 1.7% (0%)
- 光線過敏症反応 3.7% (0%)
- 皮膚扁平上皮癌 1.4% (1.4 %)
- 駆出率低下 8.3% (3.7%)
- 脈絡膜網膜症 0.6% (0%)
- 座瘡様皮膚炎 6.3% (0%)
N Engl J Med. 2015 Jan 1;372(1):30-9⁵⁾より引用
出典
- ノバルティスファーマ株式会社. タフィンラー®電子添文 (2024年11月改訂 第6版) [最終閲覧 : 2024/6/17]
- ノバルティスファーマ株式会社. タフィンラー®適正使用ガイド (2024年9月作成) [最終閲覧 : 2025/1/3]
- ノバルティスファーマ株式会社. メキニスト®電子添文 (2024年11月改訂 第6版) [最終閲覧 : 2024/6/17]
- ノバルティスファーマ株式会社. メキニスト®適正使用ガイド (2024年9月作成) [最終閲覧 : 2024/1/3]
- Improved overall survival in melanoma with combined dabrafenib and trametinib. N Engl J Med. 2015 Jan 1;372(1):30-9. PMID: 25399551
- Dabrafenib and trametinib versus dabrafenib and placebo for Val600 BRAF-mutant melanoma: a multicentre, double-blind, phase 3 randomised controlled trial. Lancet. 2015 Aug 1;386(9992):444-51. PMID: 26037941
- Five-Year Outcomes with Dabrafenib plus Trametinib in Metastatic Melanoma. N Engl J Med. 2019 Aug 15;381(7):626-636. PMID: 31166680
- Combined BRAF and MEK inhibition in melanoma with BRAF V600 mutations. N Engl J Med. 2012 Nov 1;367(18):1694-703. PMID: 23020132
最終更新日 : 2025年1月3日
監修医師 : 国立がん研究センター中央病院皮膚腫瘍科長 山崎直也先生
Dabrafenib + Trametinib
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
BRAF阻害薬 ダブラフェニブ
MEK阻害薬 トラメチニブ
*ノバルティス ファーマ株式会社の外部サイトへ遷移します
用法用量
電子添文¹⁾³⁾の用法および用量

タフィンラー®電子添文 (2024年11月改訂 第6版)¹⁾、メキニスト®電子添文 (2024年11月改訂 第6版)³⁾より作図
※術後補助療法の場合、 投与は12ヵ月まで
※食事1時間前~食後2時間までの服用は避ける
食後投与で、 Cmax及びAUCが低下するとの報告あり
減量・休薬・中止基準
ダブラフェニブ、トラメチニブ電子添文¹⁾³⁾の基準

ただし、 有棘細胞癌 (皮膚の扁平上皮癌) 又は新たな原発性悪性黒色腫が発現した場合には、 外科的切除等の適切な処置を行った上で、 休薬、 減量することなく治療を継続することができる。
タフィンラー®、メキニスト®電子添文¹⁾³⁾より作図、引用
用量調節の目安

タフィンラー®、メキニスト®電子添文¹⁾³⁾より作図
エキスパートによるワンポイント
悪性黒色腫患者に対する適応と機序
BRAFV600遺伝子変異を有する根治切除不能な悪性黒色腫患者に用いられる。
💊 ダブラフェニブ
BRAF変異型のキナーゼ活性を阻害し、 BRAF V600変異を有する腫瘍の増殖を抑制する。 一方シグナル伝達がBRAFを介さない迂回経路になることでMEK、 ERKを再活性化しシグナル伝達が急速に回復するという薬剤耐性獲得機序が知られている。
ダブラフェニブ1回150㎎を1日2回内服。食事1時間前~食後2時間までの間の服用は避ける。
💊 トラメチニブ
MEK1と2の活性化とキナーゼ活性を阻害しBRAF V600変異を有す腫瘍の増殖を抑制する。
トラメチニブ1回2㎎を1日1回内服。 食事1時間前~食後2時間までの間の服用は避ける。
これら2剤の併用療法によってBRAF、 MEKという二つの作用点を阻害することで強力に腫瘍増殖を阻害し、 薬剤耐性発現を遅らせると考えられている。 このような理由で、 通常は単剤ではなく2剤の併用療法が行われる。
国際第III相試験 (COMBI-v試験)⁵⁾の結果
BRAFV600遺伝子変異陽性根治切除不能Ⅲ期/Ⅳ期悪性黒色腫を対象に、 ベムラフェニブ単剤群と比較して、 ダブラフェニブ・トラメチニブ併用群は全生存期間 (OS) および無増悪生存期間 (PFS) を有意に延長し、 有意に高い奏効率 (ORR)、 奏功期間中央値 (mDOR) を示した。
併用療法群 vs ベムラフェニブ単剤群
- mOS :25.6ヵ月 vs 18.0ヵ月
- mPFS :11.4ヵ月 vs 7.3ヵ月
- ORR :64% vs 51%
- mDOR:13.8ヵ月 vs 7.5ヵ月
国際第III相試験 (COMBI-d試験)⁶⁾の結果
BRAFV600遺伝子変異陽性根治切除不能Ⅲ期/Ⅳ期悪性黒色腫を対象にダブラフェニブ単剤群と比較してダブラフェニブ・トラメチニブ併用群はOSおよびPFSを有意に延長し、 有意に高いORRとmDORを示した。
併用療法群 vs ダブラフェニブ単剤群
- mOS :25.1ヵ月 vs 18.7ヵ月
- mPFS :11.0ヵ月 vs 8.8ヵ月
- ORR :69% vs 53%
- mDOR:12.9ヵ月 vs 10.6ヵ月
COMBI-d+v併合解析の有害事象と対処法
有害事象
ダブラフェニブ・トラメチニブ併用療法群の98% (548/559例) に認められた。 主なものは、 発熱325例 (58%)、 悪心207例 (37%)、 下痢199例 (36%) 等であった。 本試験において副作用による死亡例は認められなかった⁶⁾。
重篤な有害事象
ダブラフェニブ・トラメチニブ併用療法群の271例 (48%) に認められた。 主なものは、 発熱91例、 駆出率減少44例、 寒気24例等であった⁷⁾。
投与中止に至った有害事象
ダブラフェニブ・トラメチニブ併用療法群の99例 (18%) に認められた。 主なものは、 発熱23例、 駆出率減少21例、 ALT上昇7例等であった⁷⁾。
N Engl J Med. 2019 Aug 15;381(7):626-636⁶⁾より引用
このことから、 定期的な心電図検査、 心臓超音波検査が必要である。
その他の注意点と対応
ダブラフェニブの特殊な有害事象として有棘細胞癌が20%にみられたがトラメチニブとの併用で3%に減少した。 皮膚所見に注意を要する⁷⁾。
N Engl J Med. 2012 Nov 1;367(18):1694-703⁷⁾より引用
副作用発現時には各薬剤の電子添文に記載の基準を参考に休薬、 減量、 中止する。 ただし有棘細胞癌など皮膚悪性腫瘍が発生した場合には切除など適切な処置を行った上で休薬、 減量を行わず治療を継続することができる。
副作用の中でも特に発熱で治療の継続が困難になることが知られており、 発熱のコントロールに関するガイドラインが存在する。
監修 : 国立がん研究センター中央病院皮膚腫瘍科長 山崎直也先生
主な有害事象
COMBI-v試験⁶⁾
主な有害事象 (カッコ内はGrade3)
- 発熱 52.6% (4.3%)
- 悪心 34.6% (0.3%)
- 下痢 32.0% (1.1%)
- 悪寒 31.4% (0.9%)
- 嘔吐 28.9% (1.1%)
- 関節痛 24.0% (0.9%)
- 発疹 21.7% (1.1 %)
- 脱毛 5.7% (0%)
- 手足症候群 4.0% (0%)
- 角化症 4.3% (0%)
- 皮膚乳頭腫 1.7% (0%)
- 光線過敏症反応 3.7% (0%)
- 皮膚扁平上皮癌 1.4% (1.4 %)
- 駆出率低下 8.3% (3.7%)
- 脈絡膜網膜症 0.6% (0%)
- 座瘡様皮膚炎 6.3% (0%)
N Engl J Med. 2015 Jan 1;372(1):30-9⁵⁾より引用
出典
- ノバルティスファーマ株式会社. タフィンラー®電子添文 (2024年11月改訂 第6版) [最終閲覧 : 2024/6/17]
- ノバルティスファーマ株式会社. タフィンラー®適正使用ガイド (2024年9月作成) [最終閲覧 : 2025/1/3]
- ノバルティスファーマ株式会社. メキニスト®電子添文 (2024年11月改訂 第6版) [最終閲覧 : 2024/6/17]
- ノバルティスファーマ株式会社. メキニスト®適正使用ガイド (2024年9月作成) [最終閲覧 : 2024/1/3]
- Improved overall survival in melanoma with combined dabrafenib and trametinib. N Engl J Med. 2015 Jan 1;372(1):30-9. PMID: 25399551
- Dabrafenib and trametinib versus dabrafenib and placebo for Val600 BRAF-mutant melanoma: a multicentre, double-blind, phase 3 randomised controlled trial. Lancet. 2015 Aug 1;386(9992):444-51. PMID: 26037941
- Five-Year Outcomes with Dabrafenib plus Trametinib in Metastatic Melanoma. N Engl J Med. 2019 Aug 15;381(7):626-636. PMID: 31166680
- Combined BRAF and MEK inhibition in melanoma with BRAF V600 mutations. N Engl J Med. 2012 Nov 1;367(18):1694-703. PMID: 23020132
最終更新日 : 2025年1月3日
監修医師 : 国立がん研究センター中央病院皮膚腫瘍科長 山崎直也先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。