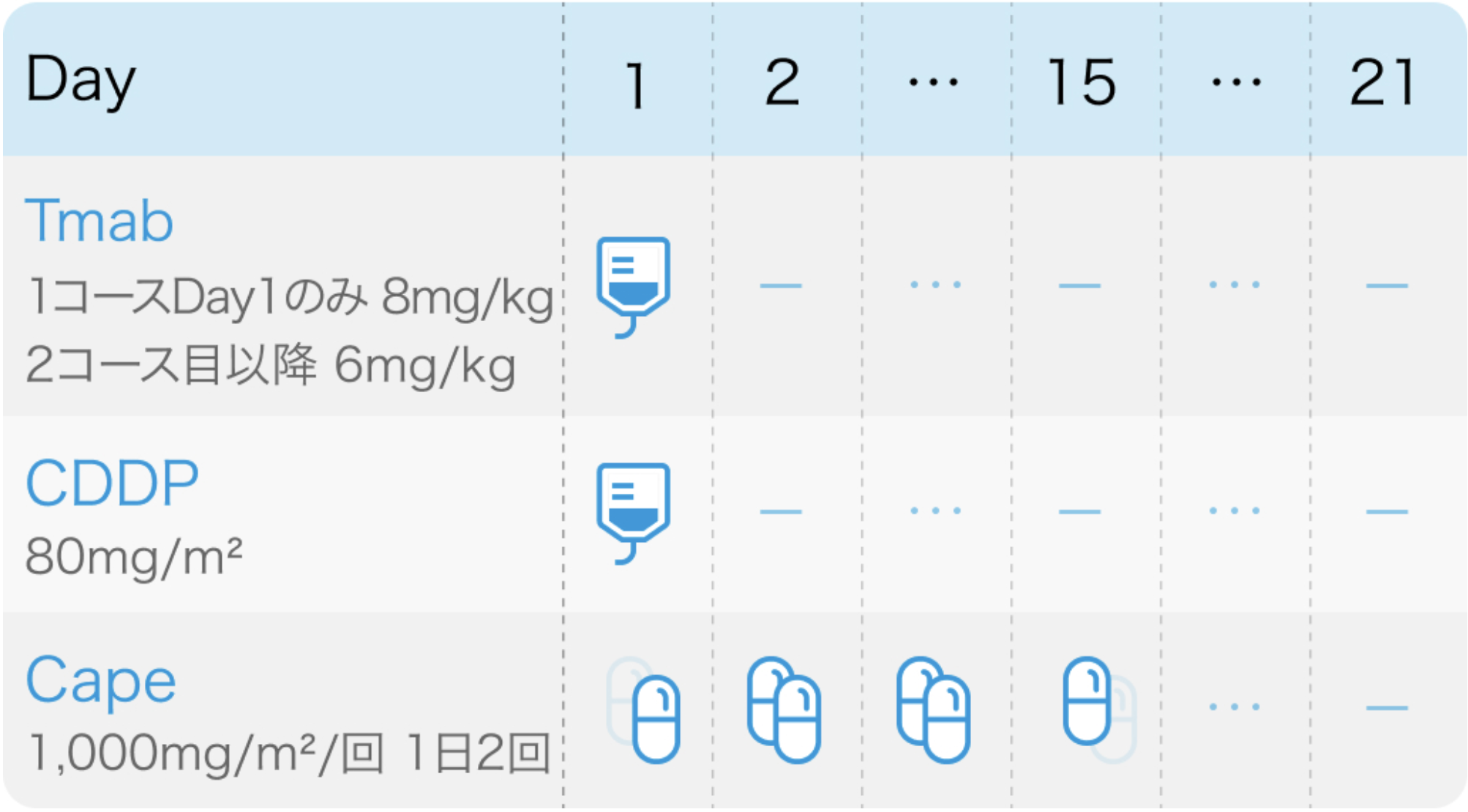
Tmab:Trastuzumab(ハーセプチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 8mg/kg 点滴 | 1 | Day1 |
| 6mg/kg 点滴 | 2~ | Day1 |
CDDP:Cisplatin(ランダ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 80mg/m² 点滴 2時間 | 1~ | Day1 |
Cape:Capecitabine(ゼローダ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1,200-2,100mg/回 経口 1日2回朝夕食後 | 1~ | Day1(夕)~15(朝) |
その他
| 1コース21日間。 |
| CDDP+CapeをXPと呼ぶ。 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*中外製薬株式会社の外部サイトへ遷移します
*日本化薬の外部サイトへ遷移します
*チェプラファームの外部サイトへ遷移します
用法用量
適正使用ガイド²⁾の基準
ハーセプチン®適正使用ガイド (2023年12月改訂)²⁾より作図
体表面積
<1.36m² : 1,200mg/回
1.36m²-<1.66m² : 1,500mg/回
1.66m²-<1.96m² : 1,800mg/回
≧1.96m² : 2,100mg/回
投与開始基準
適正使用ガイド²⁾⁶⁾の基準

心エコー又はMUGAスキャンで測定した投与前のLVEFが50%以上であること
ハーセプチン®適正使用ガイド (2023年12月改訂)²⁾、 ゼローダ®適正使用ガイド (2024年2月改訂)より作図、 引用
休薬・減量・再開基準
血液毒性発現時の休薬・減量・再開基準 (XP療法)
各コースの投与開始前に副作用のGradeを確認し、 Grade3以上の項目があるときは休薬
Grade1以下に軽快したことを確認後、 以下の基準に従って、 投与再開

※好中球数1,000~1,500/μL、 血小板数≧10万/μLの場合、 下記に従って投与可能
Cape : 1段階減量
CDDP:60mg/m²
規定の投与量での治療継続には好中球数≧1,500/μLに回復するまで投与延期
ゼローダ®適正使用ガイド (2024年2月改訂)⁶⁾より作図
非血液毒性発現時の休薬・減量・再開基準 (XP療法)
各コースの投与開始前に副作用のGradeを確認し、 Grade2以上の項目があるときは休薬
Grade1以下に軽快したことを確認後、 以下の基準に従って、 投与再開

ゼローダ®適正使用ガイド (2024年2月改訂)⁶⁾より作図
腎障害発現時の休薬・減量・再開基準 (XP療法)
Cape : CrClが≦30ml/minに低下した場合、 中止
CDDP : CrClが<60ml/minに低下した場合、 下図を参照し減量・中止

ゼローダ®適正使用ガイド (2024年2月改訂)⁶⁾より作図
心障害発現時の休薬・減量・再開基準 (トラスツマブ)
中止
胸部X線所見及びMUGAスキャン又は心エコーによりLVEF低下の確定診断されたうっ血性心不全を示唆する臨床徴候及び症状を示した患者
再開
- LVEFが50%以上に改善
- 下記に当てはまる患者で、 治療上のベネフィットがリスクを上回ると判断される場合にのみ投与再開を検討
- LVEFが39%以下の場合
- 40%≦LVEF<45%で初回投与前値よりも10以上低下した場合
ハーセプチン®適正使用ガイド (2023年12月改訂)²⁾より引用
初回基準量と減量レベル(ゼローダ)
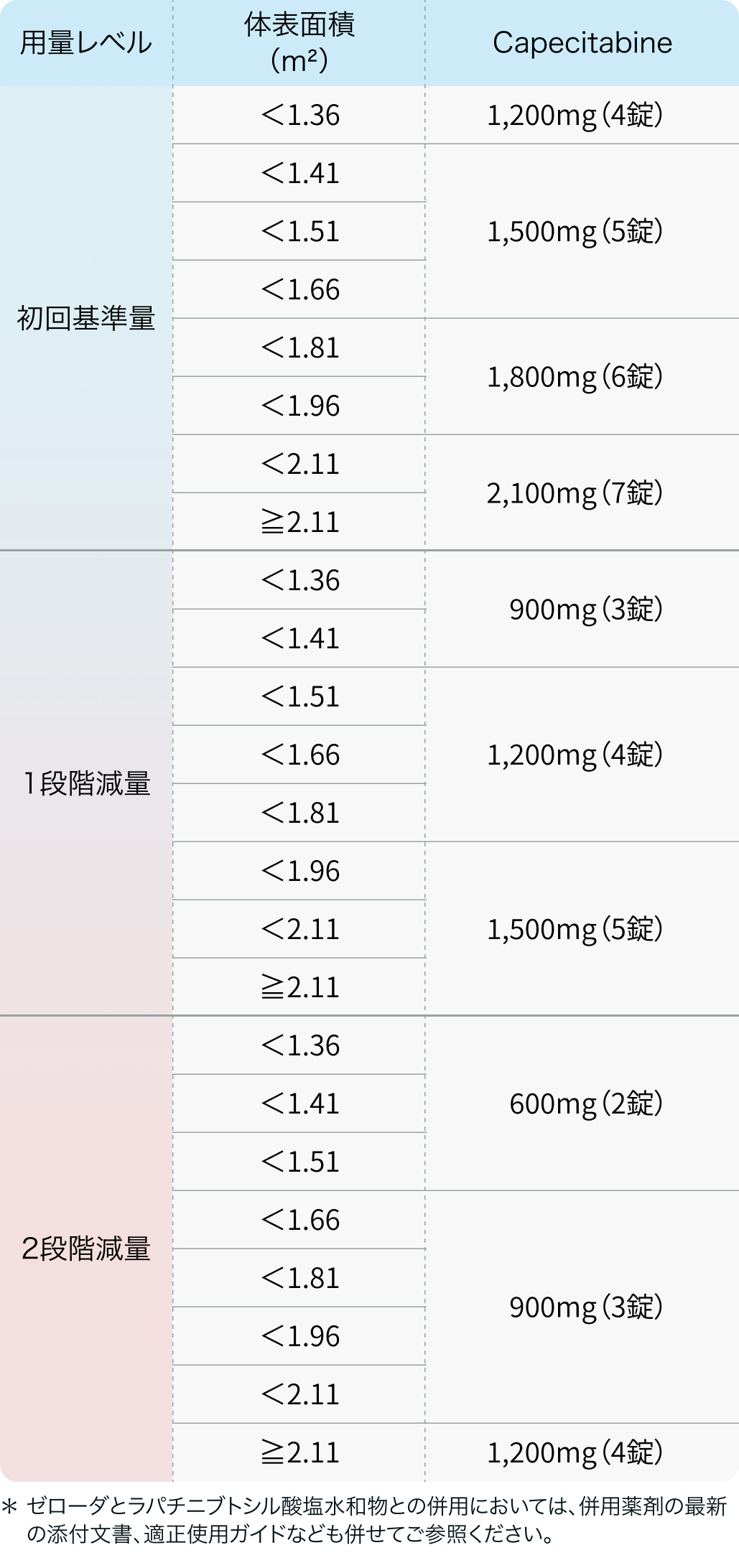
ゼローダ®適正使用ガイド (2024年2月改訂)⁶⁾より作図
主な有害事象
ToGA試験⁷⁾
主な有害事象 (カッコ内はGrade3~4)
- 悪心 67.0% (7.5%)
- 嘔吐 50.0% (6.1%)
- 下痢 37.1% (9.2%)
- 便秘 25.5% (0.7%)
- 口内炎 24.5% (0.7%)
- 好中球数減少 53.4% (26.9%)
- 貧血 27.6% (12.2%)
- 血小板数減少 16.0% (4.8%)
- 発熱性好中球減少症 5.1% (5.1%)
- 倦怠感 34.7% (4.1%)
- 体重減少 23.5% (2.0%)
- 発熱 18.4% (1.0%)
- 粘膜炎症 12.6% (2.0%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 手足症候群 25.5% (1.4%)
Lancet. 2010 Aug 28;376(9742):687-97⁷⁾より引用
上手に使うためのワンポイント
- 末梢神経障害を回避したい症例には良い適応であるが、 CDDPも漫然と投与するとオキサリプラチン同様、 末梢神経障害が生じるため注意が必要。
- 腎保護のため、 大量補液を要するため、 大量腹水を有する症例には不向きである。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
特徴と注意点
- ガイドラインでは、 HER2陽性胃癌1次治療において 「推奨される化学療法レジメン」 である。 S-1レジメンとの使い分けとして術後補助療法S-1に不応となった早期再発例に対するXParTS試験⁸⁾の結果から、 早期再発例の第一選択とする医師もいる。
- ToGA試験⁷⁾ではシスプラチンは6コースまでと規定されていた。
- シスプラチンの腎毒性のため、 CrCl<50mL/minは禁忌である。
- トラスツズマブは心毒性を有する。 治療開始前に心エコーを実施し、 LVEF<50%の症例には投与しない。 おおよそ3ヵ月程度の間隔で、 心エコーで心機能のスクリーニングを行う。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
関連する臨床試験①|ToGA試験⁷⁾
化学療法未治療の進行胃・胃食道接合部癌患者において、 トラスツズマブ+化学療法の併用の効果を、 化学療法単独を対照に検証した第Ⅲ相ランダム化比較試験ToGAの結果より、 HER2陽性患者の全生存期間 (OS) に対する有効性が示された。
OS中央値
- トラスツズマブ+化学療法群 : 13.8ヵ月
(95%CI 12-16ヵ月)
- 化学療法単独群 : 11.1ヵ月
(95%CI 10-13ヵ月)
HR 0.74 (95%CI 0.60-0.91)、 p=0.0046
HER2高発現患者
- トラスツズマブ+化学療法群 : 16.0ヵ月
- 化学療法単独群 : 11.8ヵ月
HR 0.65 (95%CI 0.51-0.83)
HER2低発現患者
- トラスツズマブ+化学療法群 : 10.0ヵ月
- 化学療法単独群 : 8.7ヵ月
HR 1.07 (95%CI 0.70-1.62)
OSのサブグループ解析
トラスツズマブ使用の有無と、 HER2高発現・低発現の2つのグループ間に有意な相互作用を認めた (p=0.036)。
PFS中央値
- トラスツズマブ+化学療法群 : 6.7ヵ月
(95%CI 6-8ヵ月)
- 化学療法単独群 : 5.5ヵ月
(95%CI 5-6ヵ月)
HR 0.71 (95%CI 0.59-0.85)、 p=0.0002
TTP中央値
- トラスツズマブ+化学療法群 : 7.1ヵ月
(95%CI 6-8ヵ月)
- 化学療法単独群 : 5.6ヵ月
(95%CI 5-6ヵ月)
HR 0.70 (95%CI 0.58-0.85)、 p=0.0003
ORR
- トラスツズマブ+化学療法群 : 47%
- 化学療法単独群 : 35%
DOR中央値
- トラスツズマブ+化学療法群 : 6.9ヵ月
(95%CI 6-8ヵ月)
- 化学療法単独群 : 4.8ヵ月
(95%CI 4-6ヵ月)
HR 0.54 (95%CI 0.40-0.73)、 p<0.0001
関連する臨床試験②|J-CLASSIC-PⅡ試験⁹⁾
R0切除後のStage II/III胃がん症例を対象にXELOX (カペシタビン+オキサリプラチン) による補助化学療法の忍容性、 安全性及び有効性を検討した第Ⅱ相試験。 主要評価項目は用量強度 (DI)、 副次評価項目は安全性、 治療完了患者の割合、 1年無病生存率 (DFS)とされた。
Gastric Cancer. 2017 Mar;20(2):332-340.
出典
- 中外製薬株式会社. ハーセプチン®電子添文 (2022年12月改訂 第5版) [最終閲覧 : 2024/7/11]
- 中外製薬株式会社. ハーセプチン®適正使用ガイド (2023年12月改訂) [最終閲覧 : 2024/7/11]
- 日本化薬. ランダ®電子添文 (2021年4月改訂 第1版) [最終閲覧 : 2024/7/11]
- 日本化薬. ランダ®安全性情報 (2021年6月作成) [最終閲覧 : 2024/7/11]
- チェプラファーム. ゼローダ®電子添文 (2024年2月改訂 第3版) [最終閲覧 : 2024/7/11]
- チェプラファーム. ゼローダ®適正使用ガイド (2024年2月改訂) [最終閲覧 : 2024/7/11]
- Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet. 2010 Aug 28;376(9742):687-97. PMID: 20728210
- A randomised phase II trial of capecitabine plus cisplatin versus S-1 plus cisplatin as a first-line treatment for advanced gastric cancer: Capecitabine plus cisplatin ascertainment versus S-1 plus cisplatin randomised PII trial (XParTS II) . Eur J Cancer. 2018 Sep:101:220-228. PMID: 30096702
- Adjuvant capecitabine plus oxaliplatin after D2 gastrectomy in Japanese patients with gastric cancer: a phase II study. Gastric Cancer. 2017 Mar;20(2):332-340. PMID: 26956689
最終更新日 : 2024年8月21日
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
XP + T-mab
Tmab:Trastuzumab(ハーセプチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 8mg/kg 点滴 | 1 | Day1 |
| 6mg/kg 点滴 | 2~ | Day1 |
CDDP:Cisplatin(ランダ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 80mg/m² 点滴 2時間 | 1~ | Day1 |
Cape:Capecitabine(ゼローダ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1,200-2,100mg/回 経口 1日2回朝夕食後 | 1~ | Day1(夕)~15(朝) |
その他
| 1コース21日間。 |
| CDDP+CapeをXPと呼ぶ。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*中外製薬株式会社の外部サイトへ遷移します
*日本化薬の外部サイトへ遷移します
*チェプラファームの外部サイトへ遷移します
用法用量
適正使用ガイド²⁾の基準

ハーセプチン®適正使用ガイド (2023年12月改訂)²⁾より作図
体表面積
<1.36m² : 1,200mg/回
1.36m²-<1.66m² : 1,500mg/回
1.66m²-<1.96m² : 1,800mg/回
≧1.96m² : 2,100mg/回
投与開始基準
適正使用ガイド²⁾⁶⁾の基準

心エコー又はMUGAスキャンで測定した投与前のLVEFが50%以上であること
ハーセプチン®適正使用ガイド (2023年12月改訂)²⁾、 ゼローダ®適正使用ガイド (2024年2月改訂)より作図、 引用
休薬・減量・再開基準
血液毒性発現時の休薬・減量・再開基準 (XP療法)
各コースの投与開始前に副作用のGradeを確認し、 Grade3以上の項目があるときは休薬
Grade1以下に軽快したことを確認後、 以下の基準に従って、 投与再開

※好中球数1,000~1,500/μL、 血小板数≧10万/μLの場合、 下記に従って投与可能
Cape : 1段階減量
CDDP:60mg/m²
規定の投与量での治療継続には好中球数≧1,500/μLに回復するまで投与延期
ゼローダ®適正使用ガイド (2024年2月改訂)⁶⁾より作図
非血液毒性発現時の休薬・減量・再開基準 (XP療法)
各コースの投与開始前に副作用のGradeを確認し、 Grade2以上の項目があるときは休薬
Grade1以下に軽快したことを確認後、 以下の基準に従って、 投与再開

ゼローダ®適正使用ガイド (2024年2月改訂)⁶⁾より作図
腎障害発現時の休薬・減量・再開基準 (XP療法)
Cape : CrClが≦30ml/minに低下した場合、 中止
CDDP : CrClが<60ml/minに低下した場合、 下図を参照し減量・中止

ゼローダ®適正使用ガイド (2024年2月改訂)⁶⁾より作図
心障害発現時の休薬・減量・再開基準 (トラスツマブ)
中止
胸部X線所見及びMUGAスキャン又は心エコーによりLVEF低下の確定診断されたうっ血性心不全を示唆する臨床徴候及び症状を示した患者
再開
- LVEFが50%以上に改善
- 下記に当てはまる患者で、 治療上のベネフィットがリスクを上回ると判断される場合にのみ投与再開を検討
- LVEFが39%以下の場合
- 40%≦LVEF<45%で初回投与前値よりも10以上低下した場合
ハーセプチン®適正使用ガイド (2023年12月改訂)²⁾より引用
初回基準量と減量レベル(ゼローダ)

ゼローダ®適正使用ガイド (2024年2月改訂)⁶⁾より作図
主な有害事象
ToGA試験⁷⁾
主な有害事象 (カッコ内はGrade3~4)
- 悪心 67.0% (7.5%)
- 嘔吐 50.0% (6.1%)
- 下痢 37.1% (9.2%)
- 便秘 25.5% (0.7%)
- 口内炎 24.5% (0.7%)
- 好中球数減少 53.4% (26.9%)
- 貧血 27.6% (12.2%)
- 血小板数減少 16.0% (4.8%)
- 発熱性好中球減少症 5.1% (5.1%)
- 倦怠感 34.7% (4.1%)
- 体重減少 23.5% (2.0%)
- 発熱 18.4% (1.0%)
- 粘膜炎症 12.6% (2.0%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 手足症候群 25.5% (1.4%)
Lancet. 2010 Aug 28;376(9742):687-97⁷⁾より引用
上手に使うためのワンポイント
- 末梢神経障害を回避したい症例には良い適応であるが、 CDDPも漫然と投与するとオキサリプラチン同様、 末梢神経障害が生じるため注意が必要。
- 腎保護のため、 大量補液を要するため、 大量腹水を有する症例には不向きである。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
特徴と注意点
- ガイドラインでは、 HER2陽性胃癌1次治療において 「推奨される化学療法レジメン」 である。 S-1レジメンとの使い分けとして術後補助療法S-1に不応となった早期再発例に対するXParTS試験⁸⁾の結果から、 早期再発例の第一選択とする医師もいる。
- ToGA試験⁷⁾ではシスプラチンは6コースまでと規定されていた。
- シスプラチンの腎毒性のため、 CrCl<50mL/minは禁忌である。
- トラスツズマブは心毒性を有する。 治療開始前に心エコーを実施し、 LVEF<50%の症例には投与しない。 おおよそ3ヵ月程度の間隔で、 心エコーで心機能のスクリーニングを行う。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
関連する臨床試験①|ToGA試験⁷⁾
化学療法未治療の進行胃・胃食道接合部癌患者において、 トラスツズマブ+化学療法の併用の効果を、 化学療法単独を対照に検証した第Ⅲ相ランダム化比較試験ToGAの結果より、 HER2陽性患者の全生存期間 (OS) に対する有効性が示された。
OS中央値
- トラスツズマブ+化学療法群 : 13.8ヵ月
(95%CI 12-16ヵ月)
- 化学療法単独群 : 11.1ヵ月
(95%CI 10-13ヵ月)
HR 0.74 (95%CI 0.60-0.91)、 p=0.0046
HER2高発現患者
- トラスツズマブ+化学療法群 : 16.0ヵ月
- 化学療法単独群 : 11.8ヵ月
HR 0.65 (95%CI 0.51-0.83)
HER2低発現患者
- トラスツズマブ+化学療法群 : 10.0ヵ月
- 化学療法単独群 : 8.7ヵ月
HR 1.07 (95%CI 0.70-1.62)
OSのサブグループ解析
トラスツズマブ使用の有無と、 HER2高発現・低発現の2つのグループ間に有意な相互作用を認めた (p=0.036)。
PFS中央値
- トラスツズマブ+化学療法群 : 6.7ヵ月
(95%CI 6-8ヵ月)
- 化学療法単独群 : 5.5ヵ月
(95%CI 5-6ヵ月)
HR 0.71 (95%CI 0.59-0.85)、 p=0.0002
TTP中央値
- トラスツズマブ+化学療法群 : 7.1ヵ月
(95%CI 6-8ヵ月)
- 化学療法単独群 : 5.6ヵ月
(95%CI 5-6ヵ月)
HR 0.70 (95%CI 0.58-0.85)、 p=0.0003
ORR
- トラスツズマブ+化学療法群 : 47%
- 化学療法単独群 : 35%
DOR中央値
- トラスツズマブ+化学療法群 : 6.9ヵ月
(95%CI 6-8ヵ月)
- 化学療法単独群 : 4.8ヵ月
(95%CI 4-6ヵ月)
HR 0.54 (95%CI 0.40-0.73)、 p<0.0001
関連する臨床試験②|J-CLASSIC-PⅡ試験⁹⁾
R0切除後のStage II/III胃がん症例を対象にXELOX (カペシタビン+オキサリプラチン) による補助化学療法の忍容性、 安全性及び有効性を検討した第Ⅱ相試験。 主要評価項目は用量強度 (DI)、 副次評価項目は安全性、 治療完了患者の割合、 1年無病生存率 (DFS)とされた。
Gastric Cancer. 2017 Mar;20(2):332-340.
出典
- 中外製薬株式会社. ハーセプチン®電子添文 (2022年12月改訂 第5版) [最終閲覧 : 2024/7/11]
- 中外製薬株式会社. ハーセプチン®適正使用ガイド (2023年12月改訂) [最終閲覧 : 2024/7/11]
- 日本化薬. ランダ®電子添文 (2021年4月改訂 第1版) [最終閲覧 : 2024/7/11]
- 日本化薬. ランダ®安全性情報 (2021年6月作成) [最終閲覧 : 2024/7/11]
- チェプラファーム. ゼローダ®電子添文 (2024年2月改訂 第3版) [最終閲覧 : 2024/7/11]
- チェプラファーム. ゼローダ®適正使用ガイド (2024年2月改訂) [最終閲覧 : 2024/7/11]
- Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet. 2010 Aug 28;376(9742):687-97. PMID: 20728210
- A randomised phase II trial of capecitabine plus cisplatin versus S-1 plus cisplatin as a first-line treatment for advanced gastric cancer: Capecitabine plus cisplatin ascertainment versus S-1 plus cisplatin randomised PII trial (XParTS II) . Eur J Cancer. 2018 Sep:101:220-228. PMID: 30096702
- Adjuvant capecitabine plus oxaliplatin after D2 gastrectomy in Japanese patients with gastric cancer: a phase II study. Gastric Cancer. 2017 Mar;20(2):332-340. PMID: 26956689
最終更新日 : 2024年8月21日
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
