Bmab:Bevacizumab(アバスチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 5mg/kg 点滴 | 1~ | Day1 |
L-OHP:Oxaliplatin(エルプラット®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 85mg/m² 点滴 | 1~ | Day1 |
l-LV:Levofolinate(アイソボリン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg/m² 点滴 | 1~ | Day1 |
5-FU:Fluorouracil(5-FU®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 400mg/m² 急速静注 | 1~ | Day1 |
| 2400mg/m² 持続静注 | 1~ | Day1~3 |
その他
| 1コース14日間。 |
| L-OHP+l-LV+5-FUをFOLFOX療法と呼ぶ。 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*中外製薬株式会社の外部サイトへ遷移します
- エルプラット® (添付文書³⁾)
- アイソボリン® (添付文書⁴⁾)
- 5-FU® (添付文書⁵⁾)
用法用量
WJOG4407G試験⁶⁾のプロトコル

Ann Oncol. 2016 Aug;27(8):1539-46⁶⁾より作図
投与開始基準
WJOG4407G試験⁶⁾のプロトコル
①FOLFOX療法の投与開始基準

Ann Oncol. 2016 Aug;27(8):1539-46⁶⁾より作図
②Bmabの投与開始基準

Ann Oncol. 2016 Aug;27(8):1539-46⁶⁾より作図
その他の対応について
- ①を満たさないが ②を満たす場合 : FOLFOX+Bmab併用療法の投与延期 (Bmabのみの投与は行わない)
- ①は満たすが ②を満たさない場合 : FOLFOX療法の投与のみ (Bmabスキップ)
Ann Oncol. 2016 Aug;27(8):1539-46⁶⁾より引用
減量・中止基準
WJOG4407G試験⁶⁾のプロトコル
同時に複数の有害事象を認めた場合、 各種薬剤の減量は1段階ずつ行う。
L-OHPやBmabが中止になった場合、 残りの薬剤は継続する。
L-OHP、 5-FUの減量・中止基準
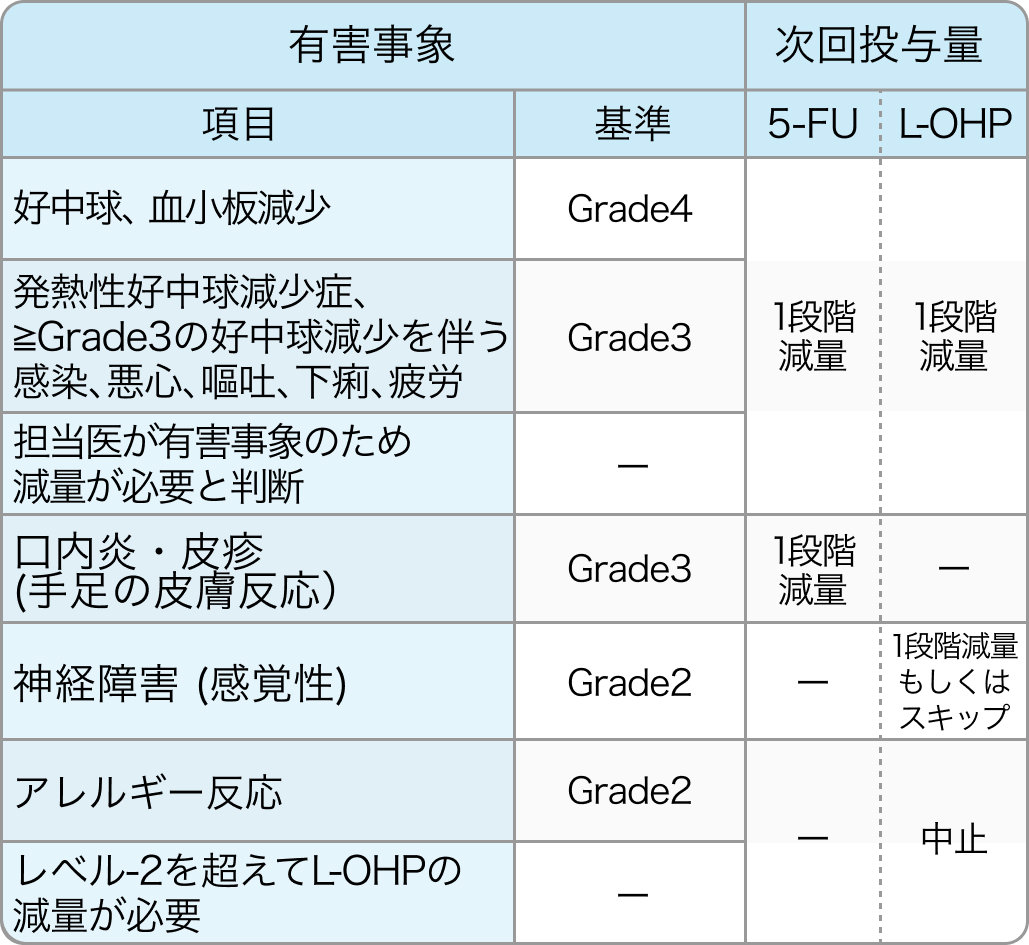
Ann Oncol. 2016 Aug;27(8):1539-46⁶⁾より作図
初回基準量と減量レベル

Ann Oncol. 2016 Aug;27(8):1539-46⁶⁾より作図
Bmabの中止基準
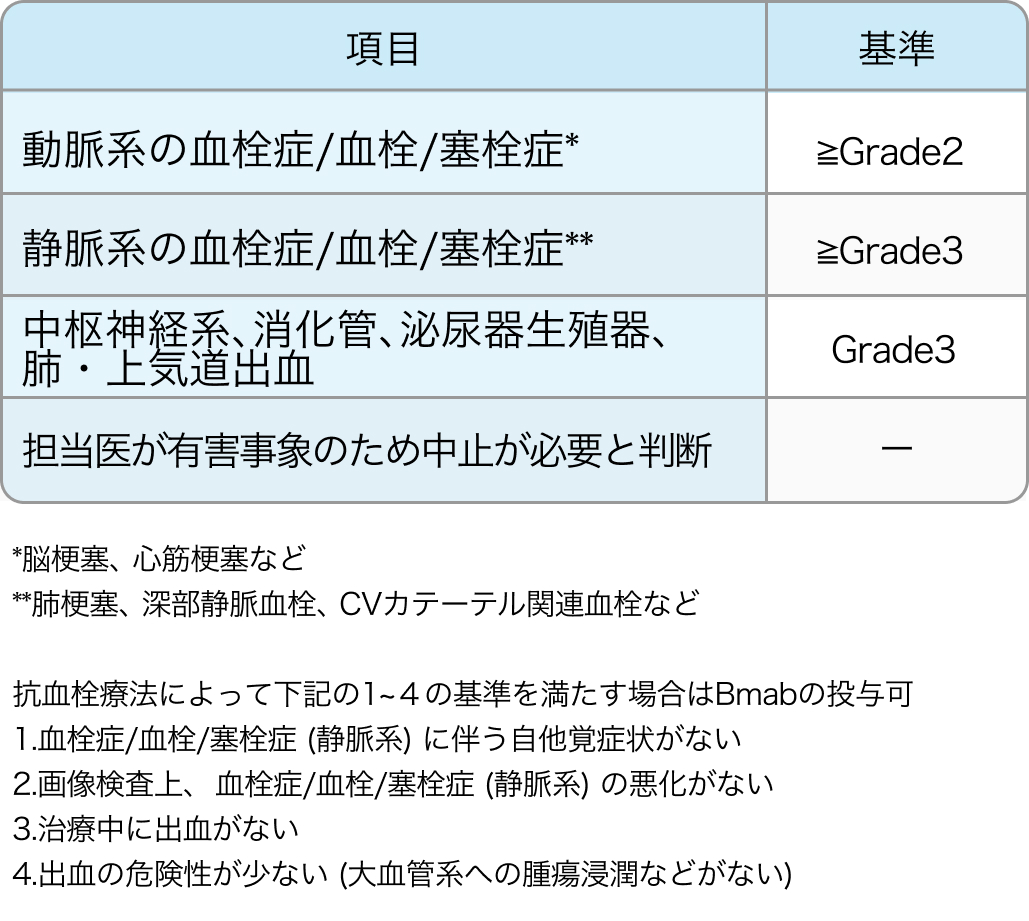
Ann Oncol. 2016 Aug;27(8):1539-46⁶⁾より作図
主な有害事象
WJOG4407G試験⁶⁾
主な有害事象 (カッコ内はGrade3~4)
- 好中球減少 80% (35%)
- 白血球減少 74% (5%)
- 貧血 33% (3%)
- 血小板減少 17% (1%)
- 食思不振 73% (6%)
- 倦怠感 71% (3%)
- 悪心 65% (5%)
- 粘膜炎 57% (3%)
- 下痢 37% (5%)
- 嘔吐 29% (5%)
- 発熱性好中球減少 2% (2%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 感覚ニューロパチー 85% (22%)
- 蛋白尿 43% (0%)
- 高血圧 40% (6%)
- 脱毛症 34% (0%)
- 手足症候群 30% (3%)
Ann Oncol. 2016 Aug;27(8):1539-46⁶⁾より引用
特徴と注意点
抗がん剤による末梢神経障害 (CIPN)
実臨床では、 末梢神経障害 (CIPN) の評価に、 CTCAEよりも症状の期間と程度を加味したDebiopharm社神経症状-感覚性毒性基準 (DEB-NTC) を用いる。 コンバージョンが明らかに困難と思われ、 延命を目的とするような症例では、 QOL低下を考慮して、 OPTIMOX1⁸⁾に準じたオキサリプラチン計画中止も積極的に検討する。
*CIPN : chemotherapy-induced peripheral neuropathies **DEB-NTC : Debiopharm Neurotoxicity Criteria of Debiopharm


5-FU中止なら、 オキサリプラチンも中止
オキサリプラチンは単独では効果がないことが証明されているため、 毒性により5-FUが中止の場合、 同時にオキサリプラチンも中止する。
減量・休薬・中止のポイント
発熱性好中球減少出現や好中球減少による治療開始延期症例で、次回減量を考慮する際にはbolus 5-FUのみ中止・削除することも選択肢になり得る。
好中球数の投与開始基準は 一般的に1500/mm³以上だが、 複数回数投与によりその患者の毒性プロファイルがある程度予想できる場合には、 好中球数1200/mm³前後でも投与可能とする医師はいる。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
上手に使うためのワンポイント
悪心リスクが高い患者への対応
若年・女性などには、 初回投与時から選択的NK1受容体拮抗型制吐剤を前投薬として用いることを検討する。
Bmabによる尿蛋白1+出現時の対応
次コースからの尿蛋白/クレアチニン比 (urine protein/creatinine ratio : UPCR) の事前測定を考慮。 実際には、 尿蛋白2+でもUPCR<2.0で投与可能とする医師はいる。
大手術後の対応
創傷治癒遅延を考慮し、 大手術後1か月未満ではBmab投与を控える。 CVポート造設直後のBmab投与は問題ないことが報告されている。
高齢者への対応
JCOG1018試験では、 75歳以上もしくは、 70-74歳かつPS2の高齢患者では1次治療PFSにおけるオキサリプラチンの上乗せ効果は乏しいことが報告されている。 患者の身体及び腫瘍状況を考慮して治療方針を決定する必要がある。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
関連する臨床試験①|WJOG4407G試験⁶⁾
未治療の転移性直腸結腸癌患者の1次治療において、 FOLFIRI (フルオロウラシル、 レボホリナート、 イリノテカン)+Bmab(ベバシズマブ) のFOLFOX(フルオロウラシル、 レボホリナート、 オキサリプラチン)+Bmab に対する非劣性が、 無増悪生存期間 (PFS) を指標として証明された。
PFS中央値
- FOLFIRI+Bmab群 : 12.1ヵ月
- FOLFOX+Bmab群 : 10.7ヵ月
HR 0.905 (95%CI 0.723-1.133)、 p=0.003
非劣性マージンは0.25に設定 (HR1.25)
OS中央値
- FOLFIRI+Bmab群 : 31.4ヵ月
- FOLFOX+Bmab群 : 30.1ヵ月
HR 0.990 (95%CI 0.785-1.249)、 p=0.730
TTF中央値
- FOLFIRI+Bmab群 : 8.5ヵ月
- FOLFOX+Bmab群 : 7.3ヵ月
奏効率
- FOLFIRI+Bmab群 : 64%
- FOLFOX+Bmab群 : 62%
p=0.757
治癒切除を受けた患者の割合
- FOLFIRI+Bmab群 : 10%
- FOLFOX+Bmab群 : 9%
p=0.736
関連する臨床試験②|TRICOLORE試験⁷⁾
転移性直腸結腸癌患者の1次治療において、 IRIS療法(イリノテカン+S-1)+ベバシズマブ(Bmab)のFOLFOX/CAPOX療法+Bmabに対する非劣性が、 無増悪生存期間 (PFS) を指標として証明された。
PFS中央値
- IRIS+Bmab群 : 14.0ヵ月
(95%CI 12.4-15.5ヵ月)
- FOLFOX / CAPOX+Bmab群 : 10.8ヵ月
(95%CI 9.6-11.6ヵ月)
HR 0.84 (95%CI 0.70-1.02)、 p<0.0001
※非劣性マージンは0.25に設定 (HR1.25)
Post-Hoc解析では、 腫瘍占居部位が左側かつRAS野生型においてIRIS+Bmab群のPFSがより良好であったと報告されている。
HR 0.68 (95%CI 0.48-0.96)、 p=0.028
OS中央値
- IRIS+Bmab群 : 34.9ヵ月
(95%CI 31.9-42.4ヵ月)
- FOLFOX / CAPOX+Bmab群 : 33.6ヵ月
(95%CI 29.8-40.1ヵ月)
HR 0.86 (95%CI 0.66-1.13)、 p=0.28
TTF中央値
- IRIS+Bmab群 : 9.6ヵ月
(95%CI 8.2-11.0ヵ月)
- FOLFOX / CAPOX+Bmab群 : 7.7ヵ月
(95%CI 7.1-8.2ヵ月)
HR 0.71 (95%CI 0.59-0.85)、 p=0.0002
奏効率
- IRIS+Bmab群 : 66.4%
- FOLFOX / CAPOX+Bmab群 : 70.6%
p=0.34
関連する臨床試験③|OPITIMOX1試験⁸⁾
高用量のオキサリプラチンを伴うロイコボリンとフルオロウラシルの簡略化されたレジメンであるFOLFOX7に基づいた、 間欠的オキサリプラチン治療を評価するための無作為化研究
J Clin Oncol. 2006 Jan 20;24(3):394-400.
出典
- 中外製薬株式会社. アバスチン®電子添文 (2024年3月改訂 第5版) [最終閲覧 : 2024/7/16]
- 中外製薬株式会社. アバスチン®適正使用ガイド (2023年11月改訂) [最終閲覧 : 2024/7/16]
- ヤクルト本社. エルプラット®電子添文 (2024年4月改訂 第4版) [最終閲覧 : 2024/7/16]
- ファイザー・ファーマ株式会社. アイソボリン®電子添文 (2023年3月改訂 第1版) [最終閲覧 : 2024/7/16]
- 協和キリン株式会社. 5-FU®電子添文 (2024年6月改訂 第4版) [最終閲覧 : 2024/7/16]
- Randomized phase III study of bevacizumab plus FOLFIRI and bevacizumab plus mFOLFOX6 as first-line treatment for patients with metastatic colorectal cancer (WJOG4407G). Ann Oncol. 2016 Aug;27(8):1539-46. PMID: 27177863
- S-1 and irinotecan plus bevacizumab versus mFOLFOX6 or CapeOX plus bevacizumab as first-line treatment in patients with metastatic colorectal cancer (TRICOLORE): a randomized, open-label, phase III, noninferiority trial. Ann Oncol. 2018 Mar 1;29(3):624-631. PMID: 29293874
- OPTIMOX1: a randomized study of FOLFOX4 or FOLFOX7 with oxaliplatin in a stop-and-Go fashion in advanced colorectal cancer--a GERCOR study. J Clin Oncol. 2006 Jan 20;24(3):394-400. PMID: 16421419
最終更新日 : 2024年8月21日
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
FOLFOX + Bmab
Bmab:Bevacizumab(アバスチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 5mg/kg 点滴 | 1~ | Day1 |
L-OHP:Oxaliplatin(エルプラット®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 85mg/m² 点滴 | 1~ | Day1 |
l-LV:Levofolinate(アイソボリン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg/m² 点滴 | 1~ | Day1 |
5-FU:Fluorouracil(5-FU®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 400mg/m² 急速静注 | 1~ | Day1 |
| 2400mg/m² 持続静注 | 1~ | Day1~3 |
その他
| 1コース14日間。 |
| L-OHP+l-LV+5-FUをFOLFOX療法と呼ぶ。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*中外製薬株式会社の外部サイトへ遷移します
- エルプラット® (添付文書³⁾)
- アイソボリン® (添付文書⁴⁾)
- 5-FU® (添付文書⁵⁾)
用法用量
WJOG4407G試験⁶⁾のプロトコル

Ann Oncol. 2016 Aug;27(8):1539-46⁶⁾より作図
投与開始基準
WJOG4407G試験⁶⁾のプロトコル
①FOLFOX療法の投与開始基準

Ann Oncol. 2016 Aug;27(8):1539-46⁶⁾より作図
②Bmabの投与開始基準

Ann Oncol. 2016 Aug;27(8):1539-46⁶⁾より作図
その他の対応について
- ①を満たさないが ②を満たす場合 : FOLFOX+Bmab併用療法の投与延期 (Bmabのみの投与は行わない)
- ①は満たすが ②を満たさない場合 : FOLFOX療法の投与のみ (Bmabスキップ)
Ann Oncol. 2016 Aug;27(8):1539-46⁶⁾より引用
減量・中止基準
WJOG4407G試験⁶⁾のプロトコル
同時に複数の有害事象を認めた場合、 各種薬剤の減量は1段階ずつ行う。
L-OHPやBmabが中止になった場合、 残りの薬剤は継続する。
L-OHP、 5-FUの減量・中止基準

Ann Oncol. 2016 Aug;27(8):1539-46⁶⁾より作図
初回基準量と減量レベル

Ann Oncol. 2016 Aug;27(8):1539-46⁶⁾より作図
Bmabの中止基準

Ann Oncol. 2016 Aug;27(8):1539-46⁶⁾より作図
主な有害事象
WJOG4407G試験⁶⁾
主な有害事象 (カッコ内はGrade3~4)
- 好中球減少 80% (35%)
- 白血球減少 74% (5%)
- 貧血 33% (3%)
- 血小板減少 17% (1%)
- 食思不振 73% (6%)
- 倦怠感 71% (3%)
- 悪心 65% (5%)
- 粘膜炎 57% (3%)
- 下痢 37% (5%)
- 嘔吐 29% (5%)
- 発熱性好中球減少 2% (2%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 感覚ニューロパチー 85% (22%)
- 蛋白尿 43% (0%)
- 高血圧 40% (6%)
- 脱毛症 34% (0%)
- 手足症候群 30% (3%)
Ann Oncol. 2016 Aug;27(8):1539-46⁶⁾より引用
特徴と注意点
抗がん剤による末梢神経障害 (CIPN)
実臨床では、 末梢神経障害 (CIPN) の評価に、 CTCAEよりも症状の期間と程度を加味したDebiopharm社神経症状-感覚性毒性基準 (DEB-NTC) を用いる。 コンバージョンが明らかに困難と思われ、 延命を目的とするような症例では、 QOL低下を考慮して、 OPTIMOX1⁸⁾に準じたオキサリプラチン計画中止も積極的に検討する。
*CIPN : chemotherapy-induced peripheral neuropathies **DEB-NTC : Debiopharm Neurotoxicity Criteria of Debiopharm


5-FU中止なら、 オキサリプラチンも中止
オキサリプラチンは単独では効果がないことが証明されているため、 毒性により5-FUが中止の場合、 同時にオキサリプラチンも中止する。
減量・休薬・中止のポイント
発熱性好中球減少出現や好中球減少による治療開始延期症例で、次回減量を考慮する際にはbolus 5-FUのみ中止・削除することも選択肢になり得る。
好中球数の投与開始基準は 一般的に1500/mm³以上だが、 複数回数投与によりその患者の毒性プロファイルがある程度予想できる場合には、 好中球数1200/mm³前後でも投与可能とする医師はいる。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
上手に使うためのワンポイント
悪心リスクが高い患者への対応
若年・女性などには、 初回投与時から選択的NK1受容体拮抗型制吐剤を前投薬として用いることを検討する。
Bmabによる尿蛋白1+出現時の対応
次コースからの尿蛋白/クレアチニン比 (urine protein/creatinine ratio : UPCR) の事前測定を考慮。 実際には、 尿蛋白2+でもUPCR<2.0で投与可能とする医師はいる。
大手術後の対応
創傷治癒遅延を考慮し、 大手術後1か月未満ではBmab投与を控える。 CVポート造設直後のBmab投与は問題ないことが報告されている。
高齢者への対応
JCOG1018試験では、 75歳以上もしくは、 70-74歳かつPS2の高齢患者では1次治療PFSにおけるオキサリプラチンの上乗せ効果は乏しいことが報告されている。 患者の身体及び腫瘍状況を考慮して治療方針を決定する必要がある。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
関連する臨床試験①|WJOG4407G試験⁶⁾
未治療の転移性直腸結腸癌患者の1次治療において、 FOLFIRI (フルオロウラシル、 レボホリナート、 イリノテカン)+Bmab(ベバシズマブ) のFOLFOX(フルオロウラシル、 レボホリナート、 オキサリプラチン)+Bmab に対する非劣性が、 無増悪生存期間 (PFS) を指標として証明された。
PFS中央値
- FOLFIRI+Bmab群 : 12.1ヵ月
- FOLFOX+Bmab群 : 10.7ヵ月
HR 0.905 (95%CI 0.723-1.133)、 p=0.003
非劣性マージンは0.25に設定 (HR1.25)
OS中央値
- FOLFIRI+Bmab群 : 31.4ヵ月
- FOLFOX+Bmab群 : 30.1ヵ月
HR 0.990 (95%CI 0.785-1.249)、 p=0.730
TTF中央値
- FOLFIRI+Bmab群 : 8.5ヵ月
- FOLFOX+Bmab群 : 7.3ヵ月
奏効率
- FOLFIRI+Bmab群 : 64%
- FOLFOX+Bmab群 : 62%
p=0.757
治癒切除を受けた患者の割合
- FOLFIRI+Bmab群 : 10%
- FOLFOX+Bmab群 : 9%
p=0.736
関連する臨床試験②|TRICOLORE試験⁷⁾
転移性直腸結腸癌患者の1次治療において、 IRIS療法(イリノテカン+S-1)+ベバシズマブ(Bmab)のFOLFOX/CAPOX療法+Bmabに対する非劣性が、 無増悪生存期間 (PFS) を指標として証明された。
PFS中央値
- IRIS+Bmab群 : 14.0ヵ月
(95%CI 12.4-15.5ヵ月)
- FOLFOX / CAPOX+Bmab群 : 10.8ヵ月
(95%CI 9.6-11.6ヵ月)
HR 0.84 (95%CI 0.70-1.02)、 p<0.0001
※非劣性マージンは0.25に設定 (HR1.25)
Post-Hoc解析では、 腫瘍占居部位が左側かつRAS野生型においてIRIS+Bmab群のPFSがより良好であったと報告されている。
HR 0.68 (95%CI 0.48-0.96)、 p=0.028
OS中央値
- IRIS+Bmab群 : 34.9ヵ月
(95%CI 31.9-42.4ヵ月)
- FOLFOX / CAPOX+Bmab群 : 33.6ヵ月
(95%CI 29.8-40.1ヵ月)
HR 0.86 (95%CI 0.66-1.13)、 p=0.28
TTF中央値
- IRIS+Bmab群 : 9.6ヵ月
(95%CI 8.2-11.0ヵ月)
- FOLFOX / CAPOX+Bmab群 : 7.7ヵ月
(95%CI 7.1-8.2ヵ月)
HR 0.71 (95%CI 0.59-0.85)、 p=0.0002
奏効率
- IRIS+Bmab群 : 66.4%
- FOLFOX / CAPOX+Bmab群 : 70.6%
p=0.34
関連する臨床試験③|OPITIMOX1試験⁸⁾
高用量のオキサリプラチンを伴うロイコボリンとフルオロウラシルの簡略化されたレジメンであるFOLFOX7に基づいた、 間欠的オキサリプラチン治療を評価するための無作為化研究
J Clin Oncol. 2006 Jan 20;24(3):394-400.
出典
- 中外製薬株式会社. アバスチン®電子添文 (2024年3月改訂 第5版) [最終閲覧 : 2024/7/16]
- 中外製薬株式会社. アバスチン®適正使用ガイド (2023年11月改訂) [最終閲覧 : 2024/7/16]
- ヤクルト本社. エルプラット®電子添文 (2024年4月改訂 第4版) [最終閲覧 : 2024/7/16]
- ファイザー・ファーマ株式会社. アイソボリン®電子添文 (2023年3月改訂 第1版) [最終閲覧 : 2024/7/16]
- 協和キリン株式会社. 5-FU®電子添文 (2024年6月改訂 第4版) [最終閲覧 : 2024/7/16]
- Randomized phase III study of bevacizumab plus FOLFIRI and bevacizumab plus mFOLFOX6 as first-line treatment for patients with metastatic colorectal cancer (WJOG4407G). Ann Oncol. 2016 Aug;27(8):1539-46. PMID: 27177863
- S-1 and irinotecan plus bevacizumab versus mFOLFOX6 or CapeOX plus bevacizumab as first-line treatment in patients with metastatic colorectal cancer (TRICOLORE): a randomized, open-label, phase III, noninferiority trial. Ann Oncol. 2018 Mar 1;29(3):624-631. PMID: 29293874
- OPTIMOX1: a randomized study of FOLFOX4 or FOLFOX7 with oxaliplatin in a stop-and-Go fashion in advanced colorectal cancer--a GERCOR study. J Clin Oncol. 2006 Jan 20;24(3):394-400. PMID: 16421419
最終更新日 : 2024年8月21日
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。

