本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
トポテシン® (添付文書¹⁾)
用法用量
WJOG4007試験²⁾のプロトコル

J Clin Oncol. 2013 Dec 10;31(35):4438-44²⁾より作図
前投薬
悪心・嘔吐予防
Day8 : デキサメタゾン3.3mg/mL 2mL+パロノセトロン0.75mg 50mL
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
投与開始基準
WJOG4007試験²⁾のプロトコル
組織学的に転移または再発が確認された20~75歳の胃腺癌患者
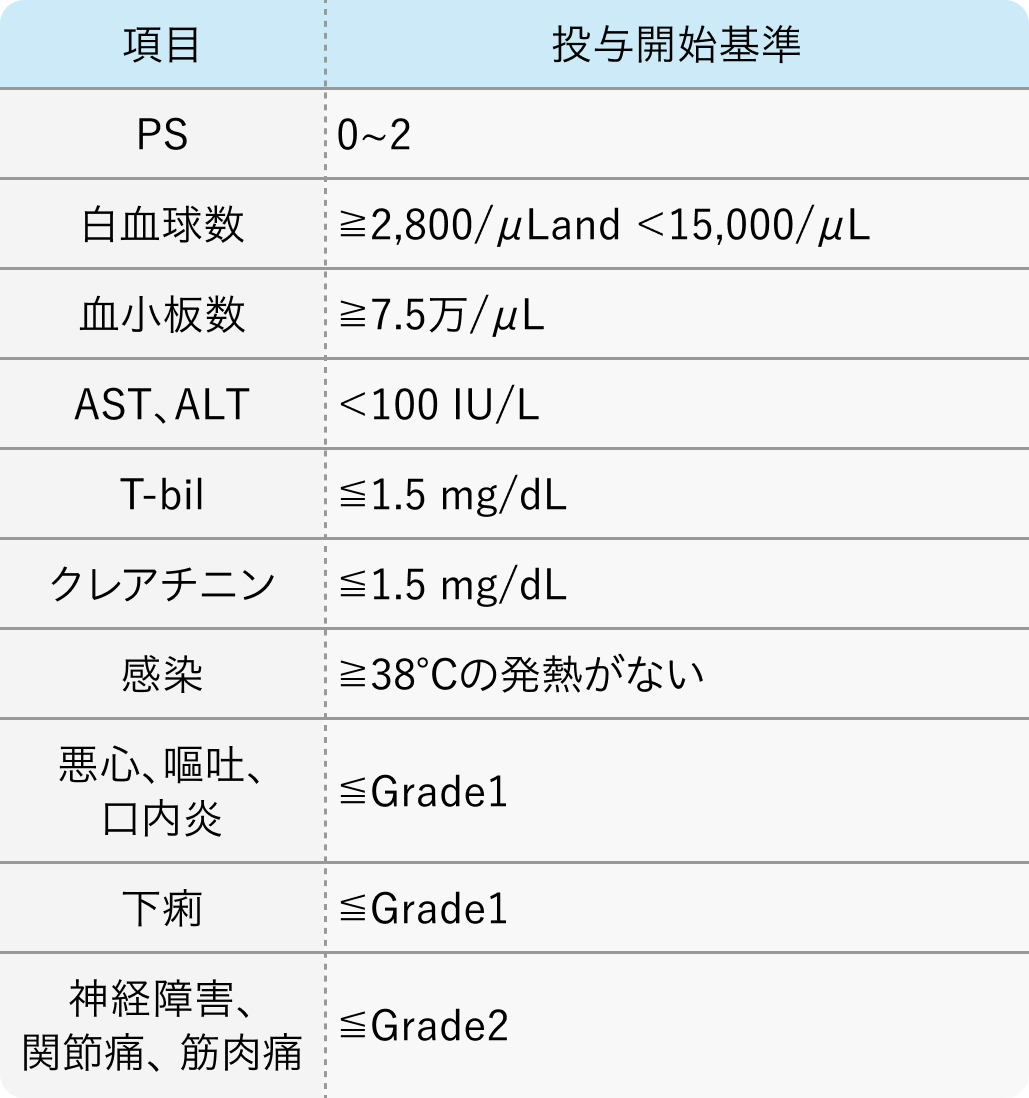
J Clin Oncol. 2013 Dec 10;31(35):4438-44²⁾より作図
減量基準
WJOG4007試験²⁾のプロトコル

J Clin Oncol. 2013 Dec 10;31(35):4438-44²⁾より作図
初回基準量と減量レベル
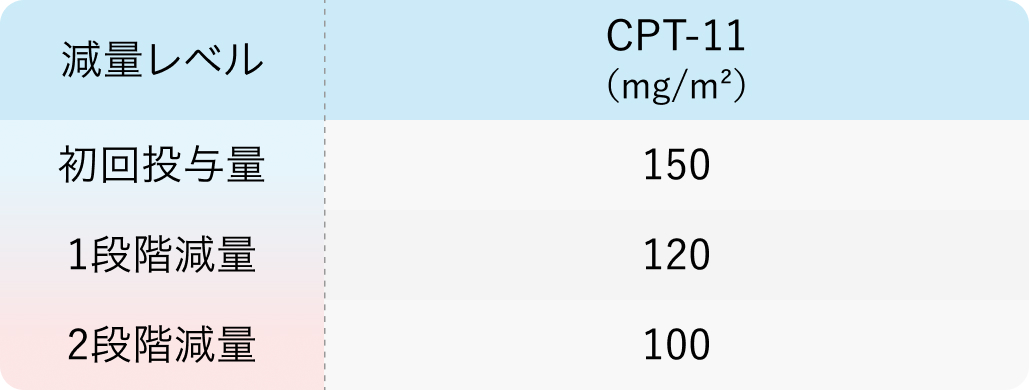
J Clin Oncol. 2013 Dec 10;31(35):4438-44²⁾より作図
主な有害事象
WJOG4007試験²⁾
主な有害事象 (カッコ内はGrade3~4)
- 白血球減少症 69.4% (19.1%)
- 好中球減少 70.0% (39.1%)
- ヘモグロビン減少 76.4% (30.0%)
- 血小板減少症 13.6% (1.8%)
- 発熱性好中球減少症 9.1% (9.1%)
- 悪心 55.5% (4.5%)
- 嘔吐 36.4% (0.9%)
- 下痢 44.5% (4.5%)
- AST上昇 38.2% (8.2%)
- ALT上昇 37.3% (2.7%)
J Clin Oncol. 2013 Dec 10;31(35):4438-44²⁾より引用
RINDBeRG試験³⁾
主な有害事象 (カッコ内はGrade3~4)
- 白血球数減少 48.0% (21.4%)
- 好中球数減少 59.7% (30.1%)
- 血小板数減少 21.4% (2.0%)
- AST上昇 29.6% (5.1%)
- ALT上昇 29.1% (3.6%)
- 下痢 45.9% (5.6%)
- 悪心 50.5% (2.6%)
- 嘔吐 20.4% (2.0%)
- 粘膜炎 8.2% (0%)
- 便秘 18.4% (0.5%)
- 発熱性好中球減少症 6.1% (6.1%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 脱毛症 15.8% (0%)
- 高血圧 1.0% (0.5%)
The primary results of an intergroup phase III randomized controlled trial comparing ramucirumab plus irinotecan with irinotecan in the third or later line treatment beyond progression after ramucirumab for advanced gastric cancer (RINDBeRG Trial)³⁾より引用
上手に使うためのワンポイント
高齢やPS2症例など忍容性に懸念があり、 120~150mg/m²での導入に悩む症例は、 100mg/m²のweekly投与で導入する方法もある。 ただし、 3~4回投与した場合は、 少なくとも2週間休薬を要す。
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
特徴と注意点
- 胃癌治療ガイドライン⁴⁾では、 3次治療以降の推奨されるレジメンの1つである。
- UGT1A1活性が低い症例 (UGT1A1*6及びUGT1A1*28のいずれかがホモ接合体またはダブルヘテロ接合体の多型) で好中球数減少や下痢の頻度が高くなるため、 可能な限り治療開始前に測定しておく。 ホモ欠損、 ダブルヘテロ型では1段階以上減量して開始する。
- IRIの代謝産物であるSN-38は腸管で排泄されるため、 通過障害を有する症例には投与禁忌である。
- 大量腹水も重篤な副作用の発現リスクがあるため、 投与禁忌である。
- 間質性肺炎・肺線維症の症例は薬剤性肺炎のリスクが高いため、 投与禁忌である。 投与前に必ずCTで肺野所見を確認する。
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
関連する臨床試験|WJOG4007試験²⁾
1次治療抵抗性の再発または転移性胃癌患者において、 パクリタキセルまたはイリノテカンによる2次治療の効果を比較検証した第Ⅲ相ランダム化比較試験WJOG4007の結果より、 両群間で全生存期間 (OS) に有意差は認められず、 どちらも再発または転移性胃癌患者の2次治療として妥当な選択肢であることが示された。
OS (中央値)
- パクリタキセル群 : 9.5ヵ月
(95%CI 8.4-10.7ヵ月)
- イリノテカン群 : 8.4ヵ月
(95%CI 7.6-9.8ヵ月)
HR 1.13 (95%CI 0.86-1.49)、 p=0.38
サブグループ解析
パクリタキセル群はほぼ全てのサブグループでわずかな優位性が認められたが、 有意な結果は得られなかった。
PFS (中央値)
- パクリタキセル群 : 3.6ヵ月
(95%CI 3.3-3.8ヵ月)
- イリノテカン群 : 2.3ヵ月
(95%CI 2.2-3.1ヵ月)
HR 1.14 (95%CI 0.88-1.49)、 p=0.33
ORR
- パクリタキセル群 : 20.9%
- イリノテカン群 : 13.6%
p=0.24
3次化学療法を受けた患者の割合
- パクリタキセル群 : 89.8%
- イリノテカン群 : 72.1%
p=0.001
出典
1) アルフレッサ ファーマ株式会社. トポテシン®電子添文 (2023年8月改訂 第1版) [最終閲覧 : 2024/6/15]
*Annals of Oncologyの外部サイトへ遷移します
4) 日本胃癌学会. 胃癌治療ガイドライン医師用2021年7月改訂 第6版
最終更新日 : 2024年8月26日
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
IRI
CPT-11: Irinotecan(トポテシン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 150mg/m² 点滴 | 1~ | Day1 |
その他
| 1コース14日間。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
トポテシン® (添付文書¹⁾)
用法用量
WJOG4007試験²⁾のプロトコル

J Clin Oncol. 2013 Dec 10;31(35):4438-44²⁾より作図
前投薬
悪心・嘔吐予防
Day8 : デキサメタゾン3.3mg/mL 2mL+パロノセトロン0.75mg 50mL
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
投与開始基準
WJOG4007試験²⁾のプロトコル
組織学的に転移または再発が確認された20~75歳の胃腺癌患者

J Clin Oncol. 2013 Dec 10;31(35):4438-44²⁾より作図
減量基準
WJOG4007試験²⁾のプロトコル

J Clin Oncol. 2013 Dec 10;31(35):4438-44²⁾より作図
初回基準量と減量レベル

J Clin Oncol. 2013 Dec 10;31(35):4438-44²⁾より作図
主な有害事象
WJOG4007試験²⁾
主な有害事象 (カッコ内はGrade3~4)
- 白血球減少症 69.4% (19.1%)
- 好中球減少 70.0% (39.1%)
- ヘモグロビン減少 76.4% (30.0%)
- 血小板減少症 13.6% (1.8%)
- 発熱性好中球減少症 9.1% (9.1%)
- 悪心 55.5% (4.5%)
- 嘔吐 36.4% (0.9%)
- 下痢 44.5% (4.5%)
- AST上昇 38.2% (8.2%)
- ALT上昇 37.3% (2.7%)
J Clin Oncol. 2013 Dec 10;31(35):4438-44²⁾より引用
RINDBeRG試験³⁾
主な有害事象 (カッコ内はGrade3~4)
- 白血球数減少 48.0% (21.4%)
- 好中球数減少 59.7% (30.1%)
- 血小板数減少 21.4% (2.0%)
- AST上昇 29.6% (5.1%)
- ALT上昇 29.1% (3.6%)
- 下痢 45.9% (5.6%)
- 悪心 50.5% (2.6%)
- 嘔吐 20.4% (2.0%)
- 粘膜炎 8.2% (0%)
- 便秘 18.4% (0.5%)
- 発熱性好中球減少症 6.1% (6.1%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 脱毛症 15.8% (0%)
- 高血圧 1.0% (0.5%)
The primary results of an intergroup phase III randomized controlled trial comparing ramucirumab plus irinotecan with irinotecan in the third or later line treatment beyond progression after ramucirumab for advanced gastric cancer (RINDBeRG Trial)³⁾より引用
上手に使うためのワンポイント
高齢やPS2症例など忍容性に懸念があり、 120~150mg/m²での導入に悩む症例は、 100mg/m²のweekly投与で導入する方法もある。 ただし、 3~4回投与した場合は、 少なくとも2週間休薬を要す。
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
特徴と注意点
- 胃癌治療ガイドライン⁴⁾では、 3次治療以降の推奨されるレジメンの1つである。
- UGT1A1活性が低い症例 (UGT1A1*6及びUGT1A1*28のいずれかがホモ接合体またはダブルヘテロ接合体の多型) で好中球数減少や下痢の頻度が高くなるため、 可能な限り治療開始前に測定しておく。 ホモ欠損、 ダブルヘテロ型では1段階以上減量して開始する。
- IRIの代謝産物であるSN-38は腸管で排泄されるため、 通過障害を有する症例には投与禁忌である。
- 大量腹水も重篤な副作用の発現リスクがあるため、 投与禁忌である。
- 間質性肺炎・肺線維症の症例は薬剤性肺炎のリスクが高いため、 投与禁忌である。 投与前に必ずCTで肺野所見を確認する。
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
関連する臨床試験|WJOG4007試験²⁾
1次治療抵抗性の再発または転移性胃癌患者において、 パクリタキセルまたはイリノテカンによる2次治療の効果を比較検証した第Ⅲ相ランダム化比較試験WJOG4007の結果より、 両群間で全生存期間 (OS) に有意差は認められず、 どちらも再発または転移性胃癌患者の2次治療として妥当な選択肢であることが示された。
OS (中央値)
- パクリタキセル群 : 9.5ヵ月
(95%CI 8.4-10.7ヵ月)
- イリノテカン群 : 8.4ヵ月
(95%CI 7.6-9.8ヵ月)
HR 1.13 (95%CI 0.86-1.49)、 p=0.38
サブグループ解析
パクリタキセル群はほぼ全てのサブグループでわずかな優位性が認められたが、 有意な結果は得られなかった。
PFS (中央値)
- パクリタキセル群 : 3.6ヵ月
(95%CI 3.3-3.8ヵ月)
- イリノテカン群 : 2.3ヵ月
(95%CI 2.2-3.1ヵ月)
HR 1.14 (95%CI 0.88-1.49)、 p=0.33
ORR
- パクリタキセル群 : 20.9%
- イリノテカン群 : 13.6%
p=0.24
3次化学療法を受けた患者の割合
- パクリタキセル群 : 89.8%
- イリノテカン群 : 72.1%
p=0.001
出典
1) アルフレッサ ファーマ株式会社. トポテシン®電子添文 (2023年8月改訂 第1版) [最終閲覧 : 2024/6/15]
*Annals of Oncologyの外部サイトへ遷移します
4) 日本胃癌学会. 胃癌治療ガイドライン医師用2021年7月改訂 第6版
最終更新日 : 2024年8月26日
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。

