本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ヌクレオシド系抗悪性腫瘍剤 トリフルリジン・チピラシル
*大鵬薬品の外部サイトへ遷移します
用法用量
電子添文¹⁾の用法および用量 (1コース4週)

ロンサーフ®電子添文 (2024年10月改訂 第4版)¹⁾より作図
1コース2週間として以下の投与を繰り返す
- 1日2回 (朝夕) 5日間経口投与し、2日間休薬
- 上記を2回繰り返したのち14日間休薬
<参考: 体表面積に応じたFTD/TPI初回投与量>
基準量 (トリフルリジンとして約35mg/m²/回) をもとに体表面積 (BSA) から1回投与量を決定
BSA<1.07m² :35mg/回 (70mg/日)
1.07≦BSA<1.23:40mg/回 (80mg/日)
1.23≦BSA<1.38:45mg/回 (90mg/日)
1.38≦BSA<1.53:50mg/回 (100mg/日)
1.53≦BSA<1.69:55mg/回 (110mg/日)
1.69≦BSA<1.84:60mg/回 (120mg/日)
1.84≦BSA<1.99:65mg/回 (130mg/日)
1.99≦BSA<2.15:70mg/回 (140mg/日)
2.15≦BSA :75mg/回 (150mg/日)
ロンサーフ®電子添文 (2024年10月改訂 第4版)¹⁾より引用
各プロトコル
投与開始基準
J003試験に投与開始基準を参考²⁾³⁾
PS、 感染症、 下痢の項目を追加
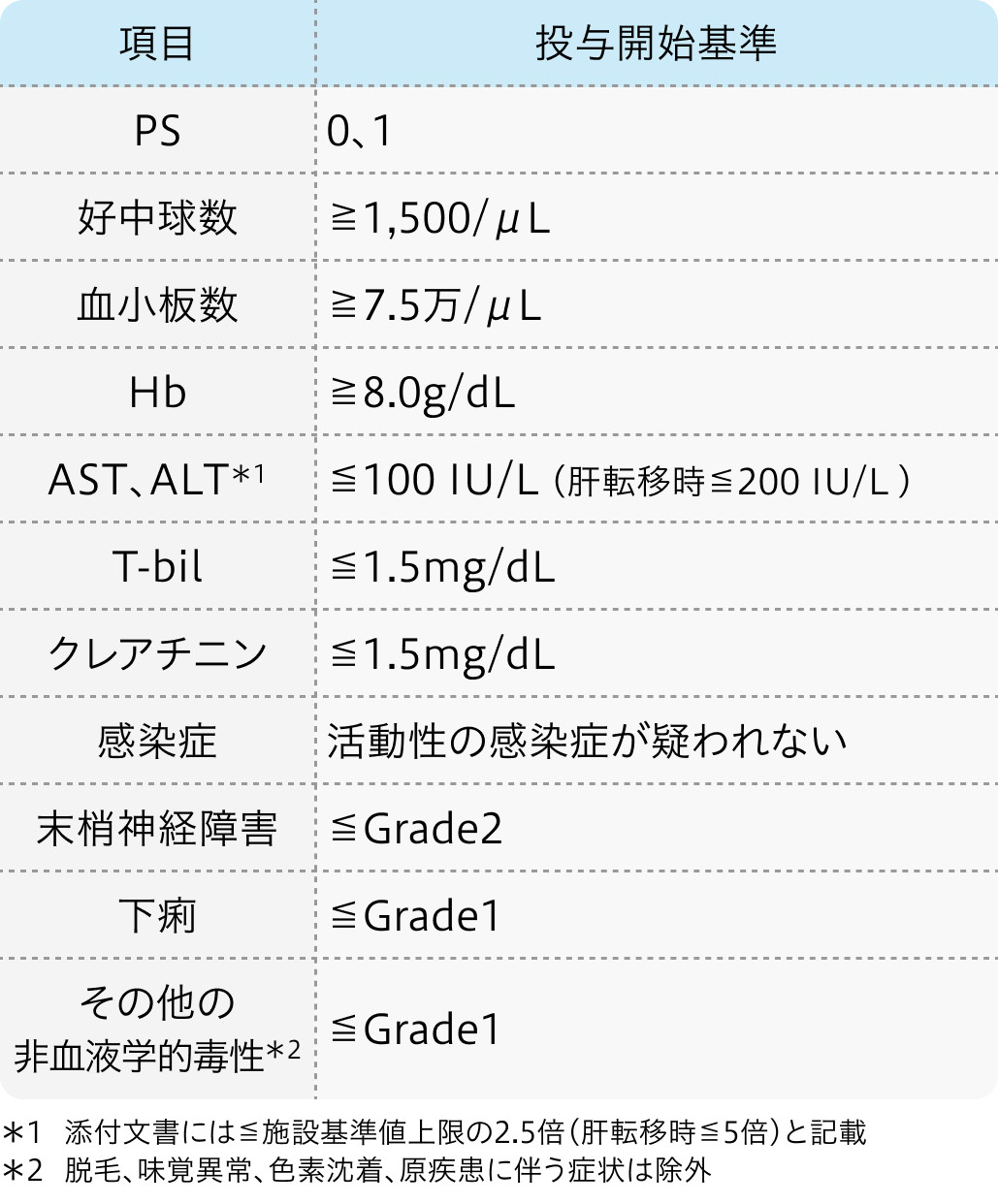
ロンサーフ®適正使用ガイド²⁾より作図
減量・休薬基準
J003試験における休薬基準を参考に設定²⁾³⁾


ロンサーフ®適正使用ガイド²⁾より作図
初回基準量と減量レベル

<参考: 体表面積に応じたFTD/TPI初回投与量>
基準量 (トリフルリジンとして約35mg/m²/回) をもとに体表面積 (BSA) から1回投与量を決定
BSA<1.07m² :35mg/回 (70mg/日)
1.07≦BSA<1.23:40mg/回 (80mg/日)
1.23≦BSA<1.38:45mg/回 (90mg/日)
1.38≦BSA<1.53:50mg/回 (100mg/日)
1.53≦BSA<1.69:55mg/回 (110mg/日)
1.69≦BSA<1.84:60mg/回 (120mg/日)
1.84≦BSA<1.99:65mg/回 (130mg/日)
1.99≦BSA<2.15:70mg/回 (140mg/日)
2.15≦BSA :75mg/回 (150mg/日)
ロンサーフ®適正使用ガイド²⁾より作図、引用
主な有害事象
J003試験²⁾³⁾
主な有害事象 (カッコ内はGrade3~4)
- 発熱性好中球減少症 4.4% (4.4%)
- 腹痛 6.2% (0%)
- 便秘 4.4% (0%)
- 下痢 34.5% (5.3%)
- 悪心 61.9% (2.7%)
- 口内炎15.0% (0%)
- 嘔吐 29.2% (2.7%)
- 疲労 54.0% (6.2%)
- 発熱 7.1% (0%)
- ALT上昇 3.5% (0%)
- AST上昇 8.0% (0.9%)
- 血中アルブミン減少 10.6% (0%)
- 血中ビリルビン増加 18.6% (0.9%)
- 血中Na減少 5.3% (0.9%)
- ヘマトクリット減少 26.5% (0%)
- Hb減少 63.7% (15.9%)
- リンパ球数減少 31.9% (8.8%)
- 好中球数減少 71.7% (50.4%)
- 血小板数減少 38.9% (4.4%)
- 赤血球数数減少 29.2% (0%)
- 体重減少 10.6% (0%)
- 白血球数減少 75.2% (28.3%)
- 蛋白尿 11.5% (0%)
- 食欲減退 54.0% (2.7%)
Lancet Oncol. 2012 Oct;13(10):993-1001.³⁾より引用
上手に使うためのワンポイント
FTD/TPIは一般的に有害事象が軽微と考えられているが、 実際には悪心・嘔吐や疲労が強く出る症例が一定数いるため、 管理に注意を要する。 悪心・嘔吐に関しては、 まずは減量での対応が一般的ではあるが、 減量で改善が得られない場合、 著者はFTD/TPIの内服期間、 糖尿病のない症例においては、 オランザピン2.5~5mgの連日投与を行い (適応外使用)、 悪心・嘔吐のコントロールを行っている。
Day1–5の内服が非血液毒性により継続が困難な症例や、 1サイクル目Day29で好中球数減少など血液毒性のため延期となる症例を良く経験する。 BiTS試験⁴⁾では、 FTD/TPI+Bmab療法において、 FTD/TPIを5日内服9日間休薬を2週毎に繰り返すスケジュールで、 原法よりも有害事象が低い傾向であった³⁾。 スケジュール変更を行うことで、 減量や延期を回避し、 用量強度を保てる可能性がある。
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
特徴と注意点
大腸癌治療ガイドライン医師用2024年版において、 FTD/TPI±Bmabは後方治療の標準治療として推奨されている⁵⁾。
高度腎障害 (CrCl<30mL/min、 ただしCre≧1.5 mg/dL) の症例では、 FTD/TPIの用量を20mg/m²/回に減量して投与することが推奨されている⁵⁾。
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
関連する臨床試験
J003試験³⁾
フッ化ピリミジン系抗悪性腫瘍剤、 イリノテカン及びオキサリプラチンを含む前治療2レジメン以上が施行され不応又は不耐となった治癒切除不能な進行・再発の結腸・直腸癌を対象にロンサーフのプラセボ投与に対する有効性及び安全性の検討を目的とした多施設共同無作為化二重盲検第Ⅱ相比較試験。 主要評価項目は全生存期間 (OS)、 副次評価項目は奏効率 (ORR)、 病勢コントロール率 (DCR)、 無増悪生存期間 (PFS)、 治療成功期間(TTF)、 腫瘍組織中のKRAS遺伝子のコドン12及び13の変異の有無とロンサーフの効果との相関等とされた。
Lancet Oncol. 2012 Oct;13(10):993-1001.³⁾
RECOURSE試験⁶⁾
難治性大腸癌において、 経口薬トリフルリジン/チピラシル配合剤 (開発コードTAS-102 、 商品名ロンサーフ) の効果を、 プラセボ対象に検証した第Ⅲ相二重盲検無作為化比較試験RECOURSEの結果より、 全生存期間 (OS) を有意に延長することが示された。
OS中央値
- TAS-102群 : 7.1ヵ月 (95%CI 6.5-7.8ヵ月)
- プラセボ群 : 5.3ヵ月 (95%CI 4.6-6.0ヵ月)
HR 0.68 (95%CI 0.58-0.81)、 p<0.001
PFS中央値
- TAS-102群 : 2.0ヵ月 (95%CI 1.9-2.1ヵ月)
- プラセボ群 : 1.7ヵ月 (95%CI 1.7-1.8ヵ月)
HR 0.48 (95%CI 0.41-0.57)、 p<0.001
RR
- TAS-102群 : 1.6%
- プラセボ群 : 0.4%
p=0.29
病勢コントロール率
- TAS-102群 : 44%
- プラセボ群 : 16%
p<0.001
出典
- 大鵬薬品工業株式会社. ロンサーフ®電子添文 (2024年10月改訂 第4版) [最終閲覧 : 2024/11/29]
- 大鵬薬品工業株式会社. ロンサーフ®適正使用ガイド [最終閲覧 : 2024/11/29]
- TAS-102 monotherapy for pretreated metastatic colorectal cancer: a double-blind, randomised, placebo-controlled phase 2 trial. Lancet Oncol. 2012 Oct;13(10):993-1001. PMID: 22951287
- Phase Ib/II Study of Biweekly TAS-102 in Combination with Bevacizumab for Patients with Metastatic Colorectal Cancer Refractory to Standard Therapies (BiTS Study). Oncologist. 2020 Dec;25(12):e1855-e1863.
- 金原出版株式会社. 大腸癌治療ガイドライン医師用2024年版. 大腸癌研究会編
- Randomized trial of TAS-102 for refractory metastatic colorectal cancer. N Engl J Med. 2015 May 14;372(20):1909-19. PMID: 25970050
最終更新日 : 2024年11月29日
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
FTD/TPI
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ヌクレオシド系抗悪性腫瘍剤 トリフルリジン・チピラシル
*大鵬薬品の外部サイトへ遷移します
用法用量
電子添文¹⁾の用法および用量 (1コース4週)

ロンサーフ®電子添文 (2024年10月改訂 第4版)¹⁾より作図
1コース2週間として以下の投与を繰り返す
- 1日2回 (朝夕) 5日間経口投与し、2日間休薬
- 上記を2回繰り返したのち14日間休薬
<参考: 体表面積に応じたFTD/TPI初回投与量>
基準量 (トリフルリジンとして約35mg/m²/回) をもとに体表面積 (BSA) から1回投与量を決定
BSA<1.07m² :35mg/回 (70mg/日)
1.07≦BSA<1.23:40mg/回 (80mg/日)
1.23≦BSA<1.38:45mg/回 (90mg/日)
1.38≦BSA<1.53:50mg/回 (100mg/日)
1.53≦BSA<1.69:55mg/回 (110mg/日)
1.69≦BSA<1.84:60mg/回 (120mg/日)
1.84≦BSA<1.99:65mg/回 (130mg/日)
1.99≦BSA<2.15:70mg/回 (140mg/日)
2.15≦BSA :75mg/回 (150mg/日)
ロンサーフ®電子添文 (2024年10月改訂 第4版)¹⁾より引用
各プロトコル
投与開始基準
J003試験に投与開始基準を参考²⁾³⁾
PS、 感染症、 下痢の項目を追加

ロンサーフ®適正使用ガイド²⁾より作図
減量・休薬基準
J003試験における休薬基準を参考に設定²⁾³⁾


ロンサーフ®適正使用ガイド²⁾より作図
初回基準量と減量レベル

<参考: 体表面積に応じたFTD/TPI初回投与量>
基準量 (トリフルリジンとして約35mg/m²/回) をもとに体表面積 (BSA) から1回投与量を決定
BSA<1.07m² :35mg/回 (70mg/日)
1.07≦BSA<1.23:40mg/回 (80mg/日)
1.23≦BSA<1.38:45mg/回 (90mg/日)
1.38≦BSA<1.53:50mg/回 (100mg/日)
1.53≦BSA<1.69:55mg/回 (110mg/日)
1.69≦BSA<1.84:60mg/回 (120mg/日)
1.84≦BSA<1.99:65mg/回 (130mg/日)
1.99≦BSA<2.15:70mg/回 (140mg/日)
2.15≦BSA :75mg/回 (150mg/日)
ロンサーフ®適正使用ガイド²⁾より作図、引用
主な有害事象
J003試験²⁾³⁾
主な有害事象 (カッコ内はGrade3~4)
- 発熱性好中球減少症 4.4% (4.4%)
- 腹痛 6.2% (0%)
- 便秘 4.4% (0%)
- 下痢 34.5% (5.3%)
- 悪心 61.9% (2.7%)
- 口内炎15.0% (0%)
- 嘔吐 29.2% (2.7%)
- 疲労 54.0% (6.2%)
- 発熱 7.1% (0%)
- ALT上昇 3.5% (0%)
- AST上昇 8.0% (0.9%)
- 血中アルブミン減少 10.6% (0%)
- 血中ビリルビン増加 18.6% (0.9%)
- 血中Na減少 5.3% (0.9%)
- ヘマトクリット減少 26.5% (0%)
- Hb減少 63.7% (15.9%)
- リンパ球数減少 31.9% (8.8%)
- 好中球数減少 71.7% (50.4%)
- 血小板数減少 38.9% (4.4%)
- 赤血球数数減少 29.2% (0%)
- 体重減少 10.6% (0%)
- 白血球数減少 75.2% (28.3%)
- 蛋白尿 11.5% (0%)
- 食欲減退 54.0% (2.7%)
Lancet Oncol. 2012 Oct;13(10):993-1001.³⁾より引用
上手に使うためのワンポイント
FTD/TPIは一般的に有害事象が軽微と考えられているが、 実際には悪心・嘔吐や疲労が強く出る症例が一定数いるため、 管理に注意を要する。 悪心・嘔吐に関しては、 まずは減量での対応が一般的ではあるが、 減量で改善が得られない場合、 著者はFTD/TPIの内服期間、 糖尿病のない症例においては、 オランザピン2.5~5mgの連日投与を行い (適応外使用)、 悪心・嘔吐のコントロールを行っている。
Day1–5の内服が非血液毒性により継続が困難な症例や、 1サイクル目Day29で好中球数減少など血液毒性のため延期となる症例を良く経験する。 BiTS試験⁴⁾では、 FTD/TPI+Bmab療法において、 FTD/TPIを5日内服9日間休薬を2週毎に繰り返すスケジュールで、 原法よりも有害事象が低い傾向であった³⁾。 スケジュール変更を行うことで、 減量や延期を回避し、 用量強度を保てる可能性がある。
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
特徴と注意点
大腸癌治療ガイドライン医師用2024年版において、 FTD/TPI±Bmabは後方治療の標準治療として推奨されている⁵⁾。
高度腎障害 (CrCl<30mL/min、 ただしCre≧1.5 mg/dL) の症例では、 FTD/TPIの用量を20mg/m²/回に減量して投与することが推奨されている⁵⁾。
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
関連する臨床試験
J003試験³⁾
フッ化ピリミジン系抗悪性腫瘍剤、 イリノテカン及びオキサリプラチンを含む前治療2レジメン以上が施行され不応又は不耐となった治癒切除不能な進行・再発の結腸・直腸癌を対象にロンサーフのプラセボ投与に対する有効性及び安全性の検討を目的とした多施設共同無作為化二重盲検第Ⅱ相比較試験。 主要評価項目は全生存期間 (OS)、 副次評価項目は奏効率 (ORR)、 病勢コントロール率 (DCR)、 無増悪生存期間 (PFS)、 治療成功期間(TTF)、 腫瘍組織中のKRAS遺伝子のコドン12及び13の変異の有無とロンサーフの効果との相関等とされた。
Lancet Oncol. 2012 Oct;13(10):993-1001.³⁾
RECOURSE試験⁶⁾
難治性大腸癌において、 経口薬トリフルリジン/チピラシル配合剤 (開発コードTAS-102 、 商品名ロンサーフ) の効果を、 プラセボ対象に検証した第Ⅲ相二重盲検無作為化比較試験RECOURSEの結果より、 全生存期間 (OS) を有意に延長することが示された。
OS中央値
- TAS-102群 : 7.1ヵ月 (95%CI 6.5-7.8ヵ月)
- プラセボ群 : 5.3ヵ月 (95%CI 4.6-6.0ヵ月)
HR 0.68 (95%CI 0.58-0.81)、 p<0.001
PFS中央値
- TAS-102群 : 2.0ヵ月 (95%CI 1.9-2.1ヵ月)
- プラセボ群 : 1.7ヵ月 (95%CI 1.7-1.8ヵ月)
HR 0.48 (95%CI 0.41-0.57)、 p<0.001
RR
- TAS-102群 : 1.6%
- プラセボ群 : 0.4%
p=0.29
病勢コントロール率
- TAS-102群 : 44%
- プラセボ群 : 16%
p<0.001
出典
- 大鵬薬品工業株式会社. ロンサーフ®電子添文 (2024年10月改訂 第4版) [最終閲覧 : 2024/11/29]
- 大鵬薬品工業株式会社. ロンサーフ®適正使用ガイド [最終閲覧 : 2024/11/29]
- TAS-102 monotherapy for pretreated metastatic colorectal cancer: a double-blind, randomised, placebo-controlled phase 2 trial. Lancet Oncol. 2012 Oct;13(10):993-1001. PMID: 22951287
- Phase Ib/II Study of Biweekly TAS-102 in Combination with Bevacizumab for Patients with Metastatic Colorectal Cancer Refractory to Standard Therapies (BiTS Study). Oncologist. 2020 Dec;25(12):e1855-e1863.
- 金原出版株式会社. 大腸癌治療ガイドライン医師用2024年版. 大腸癌研究会編
- Randomized trial of TAS-102 for refractory metastatic colorectal cancer. N Engl J Med. 2015 May 14;372(20):1909-19. PMID: 25970050
最終更新日 : 2024年11月29日
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。