2023年9月、 「がん化学療法後に増悪したHER2陽性の治癒切除不能な進行・再発の結腸・直腸癌」 に対して承認取得
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
- フェスゴ配合皮下注 IN® (添付文書)
- フェスゴ配合皮下注 MA® (添付文書)
*中外製薬株式会社の外部サイトへ遷移します
用法用量
がん化学療法後に増悪したHER2陽性の治癒切除不能な進行・再発の結腸・直腸癌
<初回> ペルツズマブ、トラスツズマブ及びボルヒアルロニダーゼ アルファとしてそれぞれ1200mg、 600mg及び30000U (フェスゴ配合皮下注 IN)、 8分以上かけて皮下投与
<2回目以降> ペルツズマブ、 トラスツズマブ及びボルヒアルロニダーゼ アルファとしてそれぞれ600mg、 600mg及び20000U (フェスゴ配合皮下注 MA)、 5分以上かけて3週間間隔で皮下投与
フェスゴ配合皮下注 MA/フェスゴ配合皮下注 IN 添付文書 (2023年11月改訂 第2版) ¹⁾より引用
各プロトコル
投与開始基準
TRIUMPH試験²⁾のプロトコル
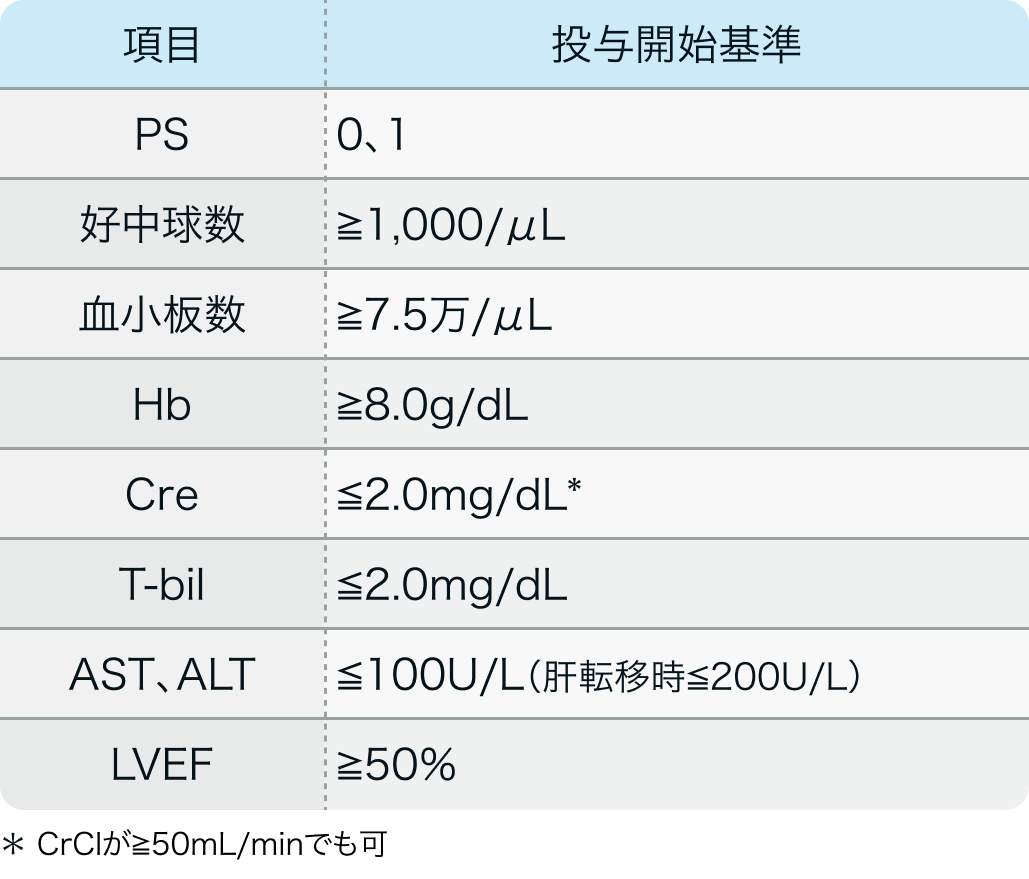
Nat Med. 2021 Nov;27(11):1899-1903²⁾より作図
投与が遅れた場合の対処
何らかの理由により予定された投与が遅れた場合には、 以下のとおり投与することが望ましい
前回投与日から6週間未満
維持投与量 (ペルツズマブ600mg/トラスツズマブ600mg/ボルヒアルロニダーゼ アルファ20000U : フェスゴ配合皮下注 MA) を投与
前回投与日から6週間以上
改めて初回投与量 (ペルツズマブ1200mg/トラスツズマブ600mg/ボルヒアルロニダーゼ アルファ30000U : フェスゴ配合皮下注 IN) を投与し、 次回以降は維持投与量を3週間間隔で投与
主な有害事象
TRIUMPH試験²⁾
主な有害事象
- 下痢 36.7%
- 口内炎 13.3%
- 倦怠感 10.0%
出典
1) 中外製薬株式会社. フェスゴ配合皮下注 MA/フェスゴ配合皮下注 IN 添付文書 (2023年11月改訂 第2版)
最終更新日 : 2024年11月29日
監修医師 : HOKUTO編集部監修医師
Pertuzumab + Trastuzumab + vorhyaluronidase alfa
2023年9月、 「がん化学療法後に増悪したHER2陽性の治癒切除不能な進行・再発の結腸・直腸癌」 に対して承認取得
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
- フェスゴ配合皮下注 IN® (添付文書)
- フェスゴ配合皮下注 MA® (添付文書)
*中外製薬株式会社の外部サイトへ遷移します
用法用量
がん化学療法後に増悪したHER2陽性の治癒切除不能な進行・再発の結腸・直腸癌
<初回> ペルツズマブ、トラスツズマブ及びボルヒアルロニダーゼ アルファとしてそれぞれ1200mg、 600mg及び30000U (フェスゴ配合皮下注 IN)、 8分以上かけて皮下投与
<2回目以降> ペルツズマブ、 トラスツズマブ及びボルヒアルロニダーゼ アルファとしてそれぞれ600mg、 600mg及び20000U (フェスゴ配合皮下注 MA)、 5分以上かけて3週間間隔で皮下投与
フェスゴ配合皮下注 MA/フェスゴ配合皮下注 IN 添付文書 (2023年11月改訂 第2版) ¹⁾より引用
各プロトコル
投与開始基準
TRIUMPH試験²⁾のプロトコル

Nat Med. 2021 Nov;27(11):1899-1903²⁾より作図
投与が遅れた場合の対処
何らかの理由により予定された投与が遅れた場合には、 以下のとおり投与することが望ましい
前回投与日から6週間未満
維持投与量 (ペルツズマブ600mg/トラスツズマブ600mg/ボルヒアルロニダーゼ アルファ20000U : フェスゴ配合皮下注 MA) を投与
前回投与日から6週間以上
改めて初回投与量 (ペルツズマブ1200mg/トラスツズマブ600mg/ボルヒアルロニダーゼ アルファ30000U : フェスゴ配合皮下注 IN) を投与し、 次回以降は維持投与量を3週間間隔で投与
主な有害事象
TRIUMPH試験²⁾
主な有害事象
- 下痢 36.7%
- 口内炎 13.3%
- 倦怠感 10.0%
出典
1) 中外製薬株式会社. フェスゴ配合皮下注 MA/フェスゴ配合皮下注 IN 添付文書 (2023年11月改訂 第2版)
最終更新日 : 2024年11月29日
監修医師 : HOKUTO編集部監修医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。