本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*MSD製薬の外部サイトへ遷移します
用法用量
KEYNOTE-061試験³⁾のプロトコル
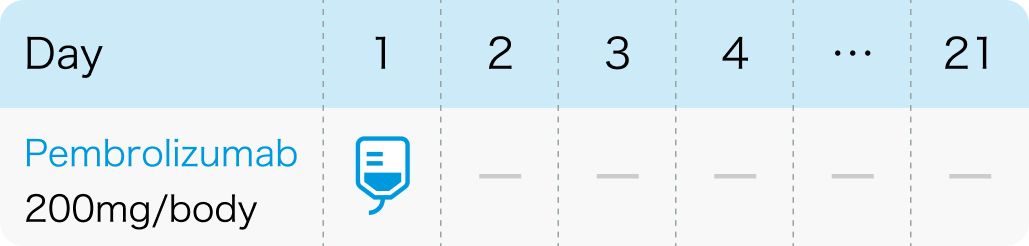
Lancet. 2018 Jul 14;392(10142):123-133³⁾より作図
投与開始基準
KEYNOTE-061試験³⁾のプロトコル
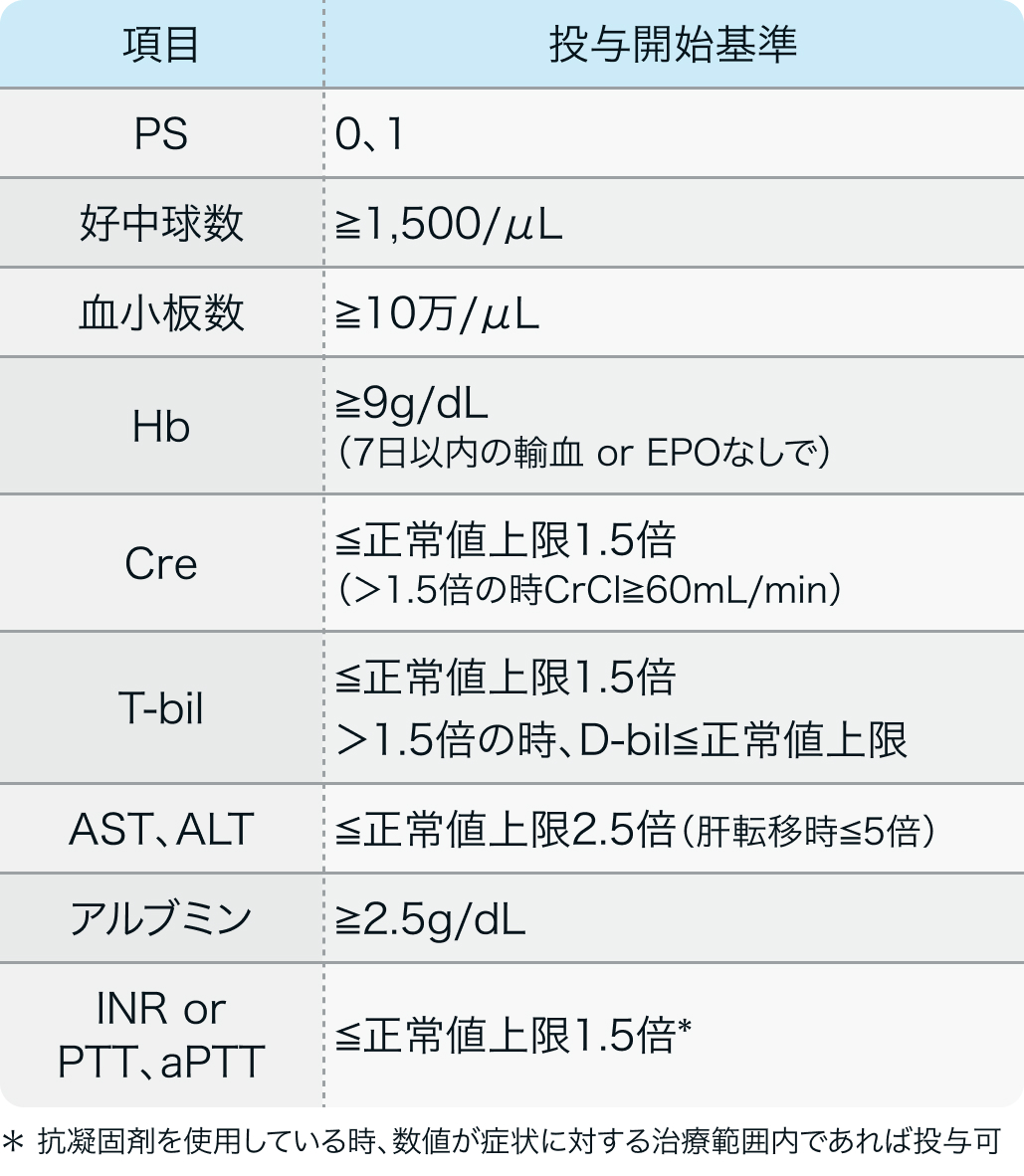
Lancet. 2018 Jul 14;392(10142):123-133³⁾より作図
減量・休薬・中止基準
電子添文¹⁾の基準
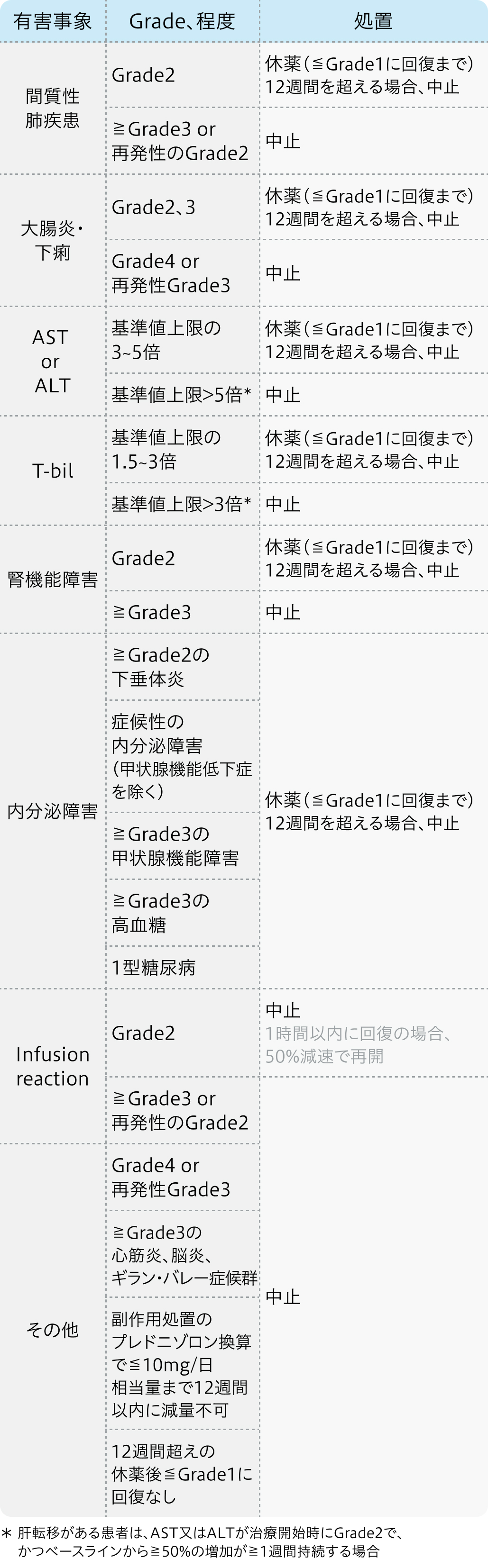
キイトルーダ®電子添文 (2024年1月改訂第17版)¹⁾より作図、引用
主な有害事象
KEYNOTE-061試験³⁾
主な有害事象 (カッコ内はGrade3~5)
- 貧血 3.4% (2.4%)
- 倦怠感 11.9% (2.4%)
- 食欲減退 8.2% (0.7%)
- 甲状腺機能低下症 7.8% (0%)
- 悪心 5.8% (0.3%)
- 下痢 5.4% (0.3%)
- 甲状腺機能亢進症 4.1% (0%)
注意すべき有害事象 (カッコ内はGrade3~5)
- 脱毛症 0.3% (0%)
- 末梢神経障害 0.3% (0%)
- 1型糖尿病 0.3% (0%)
Lancet. 2018 Jul 14;392(10142):123-133³⁾より引用
上手に使うためのワンポイント
- 免疫関連有害事象のマネージメントは基本的にはがん免疫療法ガイドラインを参考に行う⁴⁾。 日本における保険承認状況と異なることに留意が必要ではあるが、ASCO⁵⁾やESMO⁶⁾のガイドラインも参考になる。
- 免疫関連有害事象の管理が最も重要である。 患者教育・多職種チーム医療はもちろん、 採血セットを作成する、 他科コンサルテーションのシステム作り、 患者にirAEを疑う症状が出現した際の相談部署・受診基準など院内のirAE対策システム作りが望ましい。 院内のみで完結できないケースが多々あると考えられるが、 地域の基幹病院とコンサルテーションできるシステム作りが望ましい。 様々な施設の取り組みが各製薬会社のHPで紹介されているため、 参考にしていただきたい。
- Pseudo progressionが一定数存在する。CT上増悪を疑うような場合でも、 (明らかな増悪を除き) CTのみで増悪と判断せず、 腫瘍マーカーの変動、 臨床症状の変化など総合的に判断する。 担当医個人ではなく、 カンファレンスで検討することが望ましい。
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
特徴と注意点
- 胃癌治療ガイドラインでは、 既治療のMSI-H/dMMR胃癌に対する2次治療の標準治療である⁷⁾。
- 現在の標準治療であるPTX+RAMと比較した臨床試験はないが、 KEYNOTE–061試験³⁾のサブグループ解析において、 MSI-Hの症例は、 当時の標準治療であったPTXに対してPembrolizumabが良好な全生存期間 (N.R. vs. 8.1ヵ月)、 奏効割合 (47% vs. 17%) を示している³⁾。
- HER2陽性例の2次治療での使用が想定されるため、 高度腹膜播種症例など、 3次治療以降でNivolumabが使用困難と想定される症例は遅くとも1次治療中にMSIまたはMMR検査を実施しておく。
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
関連する臨床試験|KEYNOTE-061試験³⁾
PD-L1 CPS≧1の胃・食道胃接合部腺癌に対する2次治療以降において、 ペムブロリズマブの効果を、 パクリタキセルを対照に検証した第Ⅲ相ランダム化比較試験KEYNOTE-061の結果より、 全生存期間 (OS) の有意な延長は認められなかった。
OS中央値
PD-L1 CPS≧1
- ペムブロリズマブ群 : 9.1ヵ月
(95%CI 6.2-10.7ヵ月)
- パクリタキセル群 : 8.3ヵ月
(95%CI 7.6-9.0ヵ月)
HR 0.81 (95%CI 0.66-1.00)
PD-L1 CPS≧5
- ペムブロリズマブ群 : 10.4ヵ月
(95%CI 6.7-15.5ヵ月)
- パクリタキセル群 : 8.3ヵ月
(95%CI 6.8-9.4ヵ月)
HR 0.72 (95%CI 0.53-0.99)
PD-L1 CPS≧10
- ペムブロリズマブ群 : 10.4ヵ月
(95%CI 5.9-18.3ヵ月)
- パクリタキセル群 : 8.0ヵ月
(95%CI 5.1-9.9ヵ月)
HR 0.69 (95%CI 0.46-1.05)
サブグループ解析
CPS≧1でECOG PS 0の症例グループ
- ペムブロリズマブ群 : 12.3ヵ月
(95%CI 9.7-15.9ヵ月)
- パクリタキセル群 : 9.3ヵ月
(95%CI 8.3-10.5ヵ月)
HR 0.69 (95%CI 0.50-0.95)
CPS≧1でECOG PS 1の症例グループ
- ペムブロリズマブ群 : 5.4ヵ月
(95%CI 3.7-7.7ヵ月)
- パクリタキセル群 : 7.5ヵ月
(95%CI 5.3-8.4ヵ月)
HR 0.98 (95%CI 0.74-1.31)
OS率
PD-L1 CPS≧1 (12ヵ月時、 18ヵ月時、 24ヵ月時)
- ペムブロリズマブ群 : 40%、 26%、 19.9%
- パクリタキセル群 : 27%、 15%、 8.5%
PD-L1 CPS≧5 (24ヵ月時)
- ペムブロリズマブ群 : 24.2%
- パクリタキセル群 : 8.8%
PD-L1 CPS≧10 (24ヵ月時)
- ペムブロリズマブ群 : 32.1%
- パクリタキセル群 : 10.9%
サブグループ解析 (24ヵ月時)
CPS≧1でECOG PS 0の症例グループ
- ペムブロリズマブ群 : 23.9%
- パクリタキセル群 : 10.9%
CPS≧1でECOG PS 1の症例グループ
- ペムブロリズマブ群 : 16.7%
- パクリタキセル群 : 6.6%
PFS中央値
PD-L1 CPS≧1
- ペムブロリズマブ群 : 1.5ヵ月
(95%CI 1.4-2.0ヵ月)
- パクリタキセル群 : 4.1ヵ月
(95%CI 3.2-4.3ヵ月)
HR 1.25 (95%CI 1.02-1.54)
PD-L1 CPS≧5
- ペムブロリズマブ群 : 1.6ヵ月
(95%CI 1.4-2.8ヵ月)
- パクリタキセル群 : 4.0ヵ月
(95%CI 2.8-4.4ヵ月)
HR 0.98 (95%CI 0.71-1.34)
PD-L1 CPS≧10
- ペムブロリズマブ群 : 2.7ヵ月
(95%CI 1.4-4.3ヵ月)
- パクリタキセル群 : 4.0ヵ月
(95%CI 2.7-4.4ヵ月)
HR 0.79 (95%CI 0.51-1.21)
ORR
PD-L1 CPS≧1
- ペムブロリズマブ群 : 16.3%
- パクリタキセル群 : 13.6%
PD-L1 CPS≧5
- ペムブロリズマブ群 : 20.0%
- パクリタキセル群 : 14.3%
PD-L1 CPS≧10
- ペムブロリズマブ群 : 24.5%
- パクリタキセル群 : 9.1%
奏効期間 (中央値)
PD-L1 CPS≧1
- ペムブロリズマブ群 : 19.1ヵ月
- パクリタキセル群 : 5.2ヵ月
PD-L1 CPS≧5
- ペムブロリズマブ群 : 32.7ヵ月
- パクリタキセル群 : 4.8ヵ月
PD-L1 CPS≧10
- ペムブロリズマブ群 : NR
- パクリタキセル群 : 6.9ヵ月
出典
- MSD製薬. キイトルーダ®電子添文 (2024年1月改訂 第17版) [最終閲覧 : 2024/04/26]
- MSD製薬. キイトルーダ®適正使用ガイド (2024年3月作成) [最終閲覧 : 2024/04/26]
- Pembrolizumab versus paclitaxel for previously treated, advanced gastric or gastro-oesophageal junction cancer (KEYNOTE-061): a randomised, open-label, controlled, phase 3 trial. Lancet. 2018 Jul 14;392(10142):123-133. PMID: 29880231
- 金原出版株式会社. がん免疫療法ガイドライン第3版. 日本臨床腫瘍学会編.
- Management of Immune-Related Adverse Events in Patients Treated With Immune Checkpoint Inhibitor Therapy: ASCO Guideline Update. J Clin Oncol. 2021 Dec 20;39(36):4073-4126. PMID: 34724392
- Management of toxicities from immunotherapy: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2022 Dec;33(12):1217-1238. PMID: 36270461
- 日本胃癌学会. 胃癌治療ガイドライン医師用2021年7月改訂 第6版
最終更新日 : 2024年5月20日
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
Pembrolizumab
Pembrolizumab:Pembrolizumab(キイトルーダ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg/body (3週間間隔) 点滴 | 1~ | Day1 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*MSD製薬の外部サイトへ遷移します
用法用量
KEYNOTE-061試験³⁾のプロトコル

Lancet. 2018 Jul 14;392(10142):123-133³⁾より作図
投与開始基準
KEYNOTE-061試験³⁾のプロトコル

Lancet. 2018 Jul 14;392(10142):123-133³⁾より作図
減量・休薬・中止基準
電子添文¹⁾の基準

キイトルーダ®電子添文 (2024年1月改訂第17版)¹⁾より作図、引用
主な有害事象
KEYNOTE-061試験³⁾
主な有害事象 (カッコ内はGrade3~5)
- 貧血 3.4% (2.4%)
- 倦怠感 11.9% (2.4%)
- 食欲減退 8.2% (0.7%)
- 甲状腺機能低下症 7.8% (0%)
- 悪心 5.8% (0.3%)
- 下痢 5.4% (0.3%)
- 甲状腺機能亢進症 4.1% (0%)
注意すべき有害事象 (カッコ内はGrade3~5)
- 脱毛症 0.3% (0%)
- 末梢神経障害 0.3% (0%)
- 1型糖尿病 0.3% (0%)
Lancet. 2018 Jul 14;392(10142):123-133³⁾より引用
上手に使うためのワンポイント
- 免疫関連有害事象のマネージメントは基本的にはがん免疫療法ガイドラインを参考に行う⁴⁾。 日本における保険承認状況と異なることに留意が必要ではあるが、ASCO⁵⁾やESMO⁶⁾のガイドラインも参考になる。
- 免疫関連有害事象の管理が最も重要である。 患者教育・多職種チーム医療はもちろん、 採血セットを作成する、 他科コンサルテーションのシステム作り、 患者にirAEを疑う症状が出現した際の相談部署・受診基準など院内のirAE対策システム作りが望ましい。 院内のみで完結できないケースが多々あると考えられるが、 地域の基幹病院とコンサルテーションできるシステム作りが望ましい。 様々な施設の取り組みが各製薬会社のHPで紹介されているため、 参考にしていただきたい。
- Pseudo progressionが一定数存在する。CT上増悪を疑うような場合でも、 (明らかな増悪を除き) CTのみで増悪と判断せず、 腫瘍マーカーの変動、 臨床症状の変化など総合的に判断する。 担当医個人ではなく、 カンファレンスで検討することが望ましい。
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
特徴と注意点
- 胃癌治療ガイドラインでは、 既治療のMSI-H/dMMR胃癌に対する2次治療の標準治療である⁷⁾。
- 現在の標準治療であるPTX+RAMと比較した臨床試験はないが、 KEYNOTE–061試験³⁾のサブグループ解析において、 MSI-Hの症例は、 当時の標準治療であったPTXに対してPembrolizumabが良好な全生存期間 (N.R. vs. 8.1ヵ月)、 奏効割合 (47% vs. 17%) を示している³⁾。
- HER2陽性例の2次治療での使用が想定されるため、 高度腹膜播種症例など、 3次治療以降でNivolumabが使用困難と想定される症例は遅くとも1次治療中にMSIまたはMMR検査を実施しておく。
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
関連する臨床試験|KEYNOTE-061試験³⁾
PD-L1 CPS≧1の胃・食道胃接合部腺癌に対する2次治療以降において、 ペムブロリズマブの効果を、 パクリタキセルを対照に検証した第Ⅲ相ランダム化比較試験KEYNOTE-061の結果より、 全生存期間 (OS) の有意な延長は認められなかった。
OS中央値
PD-L1 CPS≧1
- ペムブロリズマブ群 : 9.1ヵ月
(95%CI 6.2-10.7ヵ月)
- パクリタキセル群 : 8.3ヵ月
(95%CI 7.6-9.0ヵ月)
HR 0.81 (95%CI 0.66-1.00)
PD-L1 CPS≧5
- ペムブロリズマブ群 : 10.4ヵ月
(95%CI 6.7-15.5ヵ月)
- パクリタキセル群 : 8.3ヵ月
(95%CI 6.8-9.4ヵ月)
HR 0.72 (95%CI 0.53-0.99)
PD-L1 CPS≧10
- ペムブロリズマブ群 : 10.4ヵ月
(95%CI 5.9-18.3ヵ月)
- パクリタキセル群 : 8.0ヵ月
(95%CI 5.1-9.9ヵ月)
HR 0.69 (95%CI 0.46-1.05)
サブグループ解析
CPS≧1でECOG PS 0の症例グループ
- ペムブロリズマブ群 : 12.3ヵ月
(95%CI 9.7-15.9ヵ月)
- パクリタキセル群 : 9.3ヵ月
(95%CI 8.3-10.5ヵ月)
HR 0.69 (95%CI 0.50-0.95)
CPS≧1でECOG PS 1の症例グループ
- ペムブロリズマブ群 : 5.4ヵ月
(95%CI 3.7-7.7ヵ月)
- パクリタキセル群 : 7.5ヵ月
(95%CI 5.3-8.4ヵ月)
HR 0.98 (95%CI 0.74-1.31)
OS率
PD-L1 CPS≧1 (12ヵ月時、 18ヵ月時、 24ヵ月時)
- ペムブロリズマブ群 : 40%、 26%、 19.9%
- パクリタキセル群 : 27%、 15%、 8.5%
PD-L1 CPS≧5 (24ヵ月時)
- ペムブロリズマブ群 : 24.2%
- パクリタキセル群 : 8.8%
PD-L1 CPS≧10 (24ヵ月時)
- ペムブロリズマブ群 : 32.1%
- パクリタキセル群 : 10.9%
サブグループ解析 (24ヵ月時)
CPS≧1でECOG PS 0の症例グループ
- ペムブロリズマブ群 : 23.9%
- パクリタキセル群 : 10.9%
CPS≧1でECOG PS 1の症例グループ
- ペムブロリズマブ群 : 16.7%
- パクリタキセル群 : 6.6%
PFS中央値
PD-L1 CPS≧1
- ペムブロリズマブ群 : 1.5ヵ月
(95%CI 1.4-2.0ヵ月)
- パクリタキセル群 : 4.1ヵ月
(95%CI 3.2-4.3ヵ月)
HR 1.25 (95%CI 1.02-1.54)
PD-L1 CPS≧5
- ペムブロリズマブ群 : 1.6ヵ月
(95%CI 1.4-2.8ヵ月)
- パクリタキセル群 : 4.0ヵ月
(95%CI 2.8-4.4ヵ月)
HR 0.98 (95%CI 0.71-1.34)
PD-L1 CPS≧10
- ペムブロリズマブ群 : 2.7ヵ月
(95%CI 1.4-4.3ヵ月)
- パクリタキセル群 : 4.0ヵ月
(95%CI 2.7-4.4ヵ月)
HR 0.79 (95%CI 0.51-1.21)
ORR
PD-L1 CPS≧1
- ペムブロリズマブ群 : 16.3%
- パクリタキセル群 : 13.6%
PD-L1 CPS≧5
- ペムブロリズマブ群 : 20.0%
- パクリタキセル群 : 14.3%
PD-L1 CPS≧10
- ペムブロリズマブ群 : 24.5%
- パクリタキセル群 : 9.1%
奏効期間 (中央値)
PD-L1 CPS≧1
- ペムブロリズマブ群 : 19.1ヵ月
- パクリタキセル群 : 5.2ヵ月
PD-L1 CPS≧5
- ペムブロリズマブ群 : 32.7ヵ月
- パクリタキセル群 : 4.8ヵ月
PD-L1 CPS≧10
- ペムブロリズマブ群 : NR
- パクリタキセル群 : 6.9ヵ月
出典
- MSD製薬. キイトルーダ®電子添文 (2024年1月改訂 第17版) [最終閲覧 : 2024/04/26]
- MSD製薬. キイトルーダ®適正使用ガイド (2024年3月作成) [最終閲覧 : 2024/04/26]
- Pembrolizumab versus paclitaxel for previously treated, advanced gastric or gastro-oesophageal junction cancer (KEYNOTE-061): a randomised, open-label, controlled, phase 3 trial. Lancet. 2018 Jul 14;392(10142):123-133. PMID: 29880231
- 金原出版株式会社. がん免疫療法ガイドライン第3版. 日本臨床腫瘍学会編.
- Management of Immune-Related Adverse Events in Patients Treated With Immune Checkpoint Inhibitor Therapy: ASCO Guideline Update. J Clin Oncol. 2021 Dec 20;39(36):4073-4126. PMID: 34724392
- Management of toxicities from immunotherapy: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2022 Dec;33(12):1217-1238. PMID: 36270461
- 日本胃癌学会. 胃癌治療ガイドライン医師用2021年7月改訂 第6版
最終更新日 : 2024年5月20日
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。

